目前研究认为,β细胞功能进行性减退和胰岛素抵抗是2型糖尿病的主要病理生理基础,其中β细胞功能进行性减退是糖尿病持续进展,患者血糖难以长期稳定控制的重要原因之一。2型糖尿病患者β细胞功能进行性减退的机制,人们尚未得到明确答案。随着相关研究的深入,一些可加重β细胞功能恶化的因素被不断认识,如何改善或延缓胰岛β细胞功能的进行性衰退,进行相关的干预或治疗,成为人们关注的热点问题。
多因素加重β细胞功能恶化
表1所示为蒂巴利(Tibaldi)教授对近年来已发现的促进胰岛β细胞功能进行性恶化因素的归纳,糖脂毒性、药物及一些细胞因子、免疫因素等都可能参与其中,并发挥重要作用。
糖毒性
在加重胰岛β细胞功能恶化的众多因素中,高血糖证据充分。多纳特(Donath)等和梅德勒(Maedler)等的体外研究显示,高血糖可促进β细胞凋亡。而长期高血糖可导致葡萄糖诱导的毒性作用,引起可能为不可逆性的β细胞损伤,这种损伤与胰岛素基因表达降低相关,进而导致胰岛素生成减少。
另一方面,高血糖所致氧化应激作用也可能与糖尿病患者胰岛β细胞功能进行性恶化相关。很多研究显示,高血糖与氧化应激存在相互关联,并可发挥协同作用,降低胰岛素基因表达,使胰岛素生物合成减少。长期高血糖本身以及与高血糖相关的血糖偏移频率和程度的增加,可能诱导活性氧簇(ROS)的生成以及慢性氧化应激的发生。已知ROS可影响胰岛素基因表达相关基因PDX-1(胰腺-十二指肠同源框1)mRNA的生成,另外,氧化应激还可能激活Jun氨基末端激酶(JNK)通路,从而引起β细胞凋亡和功能障碍。β细胞易受氧化应激影响的原因可能与β细胞表达的内源性抗氧化酶(如过氧化氢酶和谷胱甘肽过氧化物酶)水平低相关。
脂毒性
循环游离脂肪酸(FFA)增加和血脂异常在糖尿病患者中较常见。在健康人群中,FFA水平升高可能也会使胰岛素抵抗增强,胰岛素分泌增加。但是,在糖尿病患者或糖尿病前期人群中,FFA水平持续升高则可能导致β细胞功能进行性减退,即显示出对β细胞的脂毒性。另外,FFA水平升高还限制了β细胞对胰岛素抵抗的代偿能力,而胰岛素抵抗本身也可能使β细胞功能进一步恶化。就FFA本身而言,体外研究提示,FFA增加可诱导β细胞凋亡。
药物诱导的凋亡
有研究显示,某些药物可能促进β细胞功能障碍的进展,或导致β细胞功能受损。例如,使用糖皮质激素已被证实与糖代谢异常的发生相关,究其原因可能也与β细胞功能受损相关。另外,某些降糖药物也能诱导2型糖尿病患者β细胞功能障碍。例如,Maedler等的体外研究提示,部分磺脲类药物可能加速人胰岛β细胞的凋亡。但是,英国前瞻性糖尿病研究(UKPDS)结果并不支持磺脲类有上述作用。对此尚须进一步研究,积累相关资料。
炎症或免疫因素
炎症或免疫因素与胰岛素抵抗和β细胞功能障碍都存在关联。很多研究显示,与非糖尿病对照者相比,2型糖尿病患者的C反应蛋白(CRP)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)水平显著升高。此外,前瞻性研究也显示,很多2型糖尿病患者在被诊断为糖尿病前数年,就存在白细胞计数和促炎标志物水平的升高。
但是,炎症和免疫介质在β细胞损伤和凋亡中的具体作用机制仍不清楚。有研究者认为,代谢性应激因素可能增强细胞因子的作用,或者降低细胞因子拮抗物质的活性,增加自由基的生成。这些炎症和免疫介质可能作为环境因素,影响胰岛素抵抗和β细胞功能。
其他因素
其他可能促进β细胞功能障碍进展的因素包括瘦素、胰岛淀粉样蛋白沉积等。
瘦素主要表达于脂肪组织。动物研究显示,瘦素可诱导β细胞增殖,并抗击FFA诱导的β细胞凋亡。相反,当人胰岛细胞暴露于瘦素时,胰岛内白细胞介素1β(IL-1β)释放增加而白细胞介素1(IL-1)受体拮抗物释放减少,导致β细胞凋亡。
胰岛淀粉样蛋白多肽(IAPP)沉积在2型糖尿病患者中很常见。作为β细胞肽,IAPP与胰岛素共同储存和释放。学者们对IAPP沉积与β细胞功能恶化的相关性尚存争议。克拉克(Clark)等在关于IAPP沉积的文章中指出,对于2型糖尿病患者,胰岛淀粉样变性主要由糖尿病相关病理因素导致(如胰岛素原生成过程异常,可能使颗粒状的IAPP稳定性丧失),而与IAPP沉积相关的β细胞结构异常会引起严重的胰岛功能异常。
以上多种因素都可促进β细胞功能的恶化,其影响途径和影响方式也多种多样。但是,我们可以看到,这些因素对β细胞影响的共同点几乎都在于导致β细胞凋亡及其功能损伤。
表1 加重2型糖尿病患者β细胞功能进行性恶化的可能因素

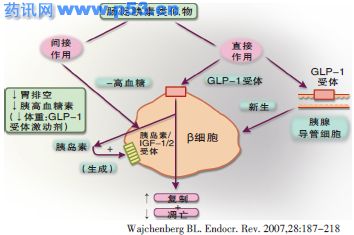
GLP-1对胰岛β细胞的保护作用
胰高血糖素样肽1(GLP-1)是由胃肠道分泌的一类重要的、参与血糖调节的激素,其在营养物摄入后呈葡萄糖浓度依赖性分泌,促进胰岛素释放,降低血糖水平。一旦血糖正常,GLP-1将不会进一步分泌,从而有利于保持血糖稳定。已知2型糖尿病患者存在GLP-1分泌减少,而补充GLP-1可呈葡萄糖浓度依赖性降低患者血糖。除降糖作用之外,GLP-1的β细胞保护作用也在多项研究中得到证实。
动物和体外研究显示,GLP-1可增强胰岛素生物合成,刺激胰岛素基因转录,增加葡萄糖转运子-2和葡糖激酶mRNA的表达,还可促进β细胞增殖,抑制β细胞凋亡,诱导胰岛新生,从而增加β细胞数量。对2型糖尿病患者的研究也显示,GLP-1改善血糖控制的作用不仅仅是调节胰岛素分泌,更重要的是调节β细胞功能,包括通过促进β细胞新生和分化增加β细胞数量,提示GLP-1可同时发挥直接和间接的β细胞保护作用。
如上所述,2型糖尿病患者β细胞功能受多种因素影响,呈进行性恶化,而GLP-1的这种双重β细胞保护作用似乎可以让人们看到通过临床治疗应对β细胞功能进行性恶化的曙光,尤其是其直接针对β细胞新生与凋亡的作用,似乎将保护靶点设在了目前所知多因素影响β细胞的共同途径上。
基于GLP-1的治疗保护β细胞
多项研究证实了人GLP-1的双重β细胞保护作用,与之相似,也有研究证据显示可应用于临床的GLP-1类似物同样具有与体内GLP-1相似的作用(图1)。
利拉鲁肽(liraglutide)作为人GLP-1类似物,已获得欧洲药品管理局(EMEA)的批准用于临床。其相关的动物研究、体外及体内(包括2型糖尿病患者)研究均提示,其与人GLP-1一样,可以对抗多种因素对胰岛β细胞的损伤。
例如,在今年美国糖尿病学会(ADA)年会上最新发布的一项体外研究显示,利拉鲁肽可对抗低密度脂蛋白对胰岛β细胞增殖的抑制作用,并抑制IL-1β诱导的β细胞凋亡,促进β细胞增殖。其他对2型糖尿病患者的研究也显示,无论用稳态模型评估法(HOMA)观察,还是分析胰岛素原/胰岛素比率,利拉鲁肽都可在一定程度上改善胰岛β细胞功能。
结 语
总之,2型糖尿病患者的胰岛β细胞功能受多种因素影响而呈进行性恶化的趋势,目前的研究结果提示应用GLP-1类似物似乎可通过间接(降低血糖等)和直接(一定程度上改善β细胞功能)双重途径,保护β细胞,从而有助于减缓2型糖尿病的进展。当然,对此还需要进行更多的长期研究,积累更多的基础研究证据和临床资料。

