|
普丽康是一种激素,与人类垂体分泌的促卵泡激素(FSH)非常相似,负责使卵巢内的小泡(称卵泡)发育,每个卵泡包含一个卵细胞,一般在月经周期的中期排卵,以接受精子受精。普丽康可促使一个或多个卵泡发育,医生会根据不孕症夫妇准备接受的治疗方案而选择不同的使用剂量,一般而言,若行一般促排卵治疗,则用量较少,若行“试管婴儿”技术治疗,则使用的剂量相对较多。 组促卵泡素β注射液(普丽康)使用说明书 药品名称 通用名:重组促卵泡素β注射液 商品名:普丽康 英文名:Recombinant Follitropin Beta Injection 汉语拼音:chong zu cu luan pao su beta zhu she ye 本品主要成分及其化学名称为:基因重组促卵泡激素(FSH)(促卵泡素β)。辅料包括:蔗糖、枸橼酸钠、L-蛋氨酸及聚山梨酯20,pH值通过氢氧化钠及/或盐酸调节。 性状 无色澄明液体。 药理/毒理 药效学特性 药效学组:促性腺激素:ATC编码: G03G A06 普丽康含有重组FSH,采用重组DNA技术生产,即使用中国苍鼠卵巢细胞系(Chinese hamster ovary cell line)转染人FSH亚单位基因,其基本氨基酸序列与天然的人FSH序列相同,但碳水化合物的链结构存在微小差异。 FSH在促使卵泡正常生长、成熟和性腺甾体类固醇的产生中不可缺少。在女性,FSH的浓度对卵泡发育的启动,及随后使卵泡达到成熟的时间和数目均至关重要,因此普丽康可用于性腺功能障碍的患者,刺激卵泡发育及促进甾体类固醇的产生。此外,普丽康可在各种辅助生殖术{即体外授精-胚胎移植(IVF-ET)、配子输卵管内移植(GIFT)及卵胞浆内精子注射(ICSI)}中,促进多个卵泡发育。以Puregon治疗通常要紧接着用hCG以诱导卵泡成熟的最后阶段、减数分裂恢复和卵泡破出。 毒理 普丽康单一剂量对大鼠未显示出明显毒性反应,在大鼠(2周)、狗(13周)重复给予人类最高剂量的100倍,普丽康亦未引起明显毒性反应,在Ames试验或人淋巴细胞体外染色体变形试验中,普丽康未显示有致畸的潜在性反应。 药代动力学 肌肉注射或皮下注射普丽康后,血浆FSH的最高浓度约在12小时内达到,由于药物在注射部位的持续释放且半衰期约40小时(12-70小时),故FSH浓度在24-48小时内保持上升。因药物半衰期相对较长,重复使用同一剂量,FSH的血浆浓度比仅仅使用一次的血浆浓度高约1.5-2.5倍,从而达到FSH的治疗浓度。肌肉注射和皮下注射普丽康之间并无药动学上的显著差异,两者的绝对生物利用度约77%,重组FSH的生化特性与人尿源FSH很相似,其分布、代谢及排泄均相同。 适应症 · 无排卵症(包括多囊卵巢疾病,PCOD):用于使用枸橼酸克罗米芬治疗无效的女性。 · 辅助生殖技术如体外授精-胚胎转移(IVF-ET)、配子输卵管内移植(GIFT)及卵胞浆内精子注射(ICSI)中,用于控制性超促排卵,以获得多个卵泡发育。 用法及用量 使用普丽康作治疗,开始时应在对治疗生育问题富有经验的医生指导下进行。 普丽康与尿源FSH的临床研究比较显示,普丽康比尿源FSH更有效。在达到排卵前状态,普丽康所需总剂量低,用药时间短,并能获得适宜的卵泡发育,因此可考虑使用较低剂量普丽康,减少发生卵巢过度刺激的危险。 普丽康可以单独用来促排卵,也可与GnRH类似物合用以预防早发性LH峰,在后者,特别是当使用GnRH激动剂时,需要使用较高剂量的普丽康以获得适宜的卵泡反应。使用普丽康的临床经验来自于符合两项适应症的治疗达三个周期。IVF的整体经验提示,通常在最初的四次周期治疗中,成功率保持稳定,之后逐渐下降。 无排卵症 推荐连续用药,即开始通常每天给予50IU的普丽康,这一起始量至少维持7天。若卵巢无反应,则每日用量可逐渐增至有卵泡发育及/或血浆雌二醇浓度提示有适宜的药效学反应,一般以雌二醇水平每日增加40-100%为理想,之后维持此剂量至达到排卵前状态,当超声检查显示至少有一个优势的卵泡直径达18mm以及/或血浆雌二醇浓度达300-900pg/ml(1000-3000pmol/L)时,表明已达到排卵前状态。通常经7-14天治疗可达到此状态,此时可停用普丽康,并使用人绒毛膜促性腺激素(hCG)以诱发排卵。 如果有反应的卵泡数太多或雌二醇浓度增加过快,即连续2至3天中每天雌二醇成倍增加,则需减量。鉴于卵泡直径超过14mm就有可能导致妊娠,因而若有多个排卵前的卵泡超过14mm则有多胎妊娠的危险,对这种情况,hCG应停止使用且避免怀孕以防止发生多胎妊娠。 施行医学辅助生殖术时的控制性超促排卵 可采用不同的刺激方案。推荐至少以150-225 IU为最初四天的起始剂量,随后用量依卵巢反应作个体调节,临床研究显示6-12天75-375IU 的维持剂量即可,亦可能需较长的治疗时间。 普丽康既可单用,也可与GnRH类似物合用以预防早发性LH峰,对于后者,可能需要的普丽康剂量相对较高。卵巢反应可通过超声检查及血浆雌二醇浓度测定来监控,当超声波显示至少有三个卵泡直径为16-20mm并证实有良好的雌二醇反应(每个直径大于18mm的卵泡,对应血浆雌二醇浓度约为300-400pg/ml(1000-1300pmo/L)),则予hCG诱导卵泡的最后成熟阶段,在34-35小时后取卵 用法 为防止注射疼痛及减少注射部位液体渗漏,普丽康注射剂应缓慢地作肌肉注射或皮下注射。皮下注射部位应变换以免脂肪萎缩。未用完的溶液必须抛弃。 普丽康皮下注射可由妇女或其亲友进行,但需经医生正确指导后。普丽康的自行注射只适合那些有意愿,经过适当训练且获得专业指导的妇女。 不良反应 5%接受普丽康治疗的病人可发生卵巢过度刺激症状,主要表现见注意事项。 临床上,肌肉注射或皮下注射普丽康可能导致注射局部的反应如瘀血、疼痛、红斑、肿胀和发痒,多数症状轻微短暂,未见全身性反应。 曾见异位妊娠和多胎妊娠之危险略微增加。在极罕见病例,使用其他促性腺激素与血栓栓塞发生有关,使用普丽康/hCG也可能发生。 禁忌症 卵巢、乳腺、子宫、下丘脑或垂体肿瘤。 妊娠或哺乳期 未经诊断的阴道出血 对普丽康中任一成分过敏 原发性卵巢功能衰竭 与多囊卵巢(PCOD)无关的卵巢囊肿或卵巢增大 性器官畸形不宜妊娠者 子宫纤维瘤不宜妊娠者
注意事项 · 应排除尚未控制的非性腺性内分泌疾病(如甲状腺、肾上腺或脑垂体疾病)的病例 · 在使用促性腺激素促排卵而发生的妊娠,其多胎妊娠的风险会增加 · 首次注射Puregon应在医师监督下进行。 · 由于采用辅助生殖技术特别是体外受精(IVF)的不孕妇女,常有输卵管异常,因而异位妊娠的发生率可能增加,所以早期的超声波检查以确认是否宫冄妊娠至关重要。 · 施行辅助生殖技术的妇女,其妊娠失败率高于正常人群。 · 卵巢过度刺激 治疗女性患者,应在治疗前及治疗中定期监测卵泡发育及雌二醇水平。如发育的卵泡数太多,雌二醇浓度会迅速升高(如连续2-3天,雌二醇水平每天增加超过一倍,达到一个极高值),同时结合超声波检查可诊断卵巢过度刺激。倘若这种不希望发生的卵巢过度刺激情况发生了(并非医学辅助生殖技术中意想的控制性超排卵),则必须停止使用普丽康。这样的病人应避免妊娠且停用hCG,因除了可发生多个排卵外,还可导致卵巢过度刺激综合症。轻度的卵巢过度刺激综合症的临床症状和体征可表现为腹痛、恶心、腹泻及卵巢轻度至中度增大和卵巢囊肿。极少数病人可发生严重卵巢过度刺激综合症,有可能威及生命。其特征为:巨大的卵巢囊肿(易破裂)、腹水,并常有胸水及体重增加,罕见病例在使用其他促性腺激素的治疗中发生血栓,这在使用普丽康/hCG中也可能发生。 · 有血栓危险因素的妇女,如有个人或家族病史,严重肥胖(体重指数>30kg/m2)或血栓炎发作,即使没有并发OHSS,使用促性腺激素治疗也可能会增加静脉或动脉血栓栓塞风险。这些妇女使用IVF治疗需权衡利与弊。然而,应该注意怀孕本身也会提高血栓发生机率。 孕妇与哺乳期妇女用药 对驾驶及机器操作能力的影响 本品对驾驶及操作机器无影响。 普丽康与枸橼酸克罗米芬合用可增加卵泡反应,使用GnRH激动剂使垂体脱敏后,需要Puregon的剂量可能相对较高以达到适当的卵泡反应。 配伍禁忌 缺乏不相容研究,本药品不能与其它药物混合使用。 药物过量 尚无普丽康对人类的急性毒性资料,但动物试验研究表明:普丽康与尿促性腺激素的急性毒性极低,FSH的剂量过高可导致卵巢的过度刺激(参见卵巢过度刺激)。 规格:50 IU/0.5mL和100 IU/0.5mL。 每支0.5 ml的注射剂含50、100 IU 促卵泡激素(FSH),相当于每支含有5、10微克的蛋白质(活体内的生物活性相当于10000国际单位FSH/毫克蛋白质)。 贮藏 2-80C避光保存。 包装 普丽康采用I型、防水解注射用玻璃瓶和橡胶塞包装,并用铝盖封口。 50IU和100IU的包装包括每盒1瓶装和每盒5瓶装。 有效期 3年。 生产企业 企业名称:荷兰欧加农公司
ANEXA I REZUMATUL CARACTERISTICILOR PRODUSULUI 1. DENUMIREA COMERCIALĂ A MEDICAMENTULUIPuregon 50 UI pulbere şi solvent pentru soluţie injectabilă 2. COMPOZIŢIA CALITATIVĂŞI CANTITATIVĂO fiolă conţine 50 UI hormon foliculostimulant (FSH) recombinat corespunzînd la 5 micrograme de proteină (bioactivitate specifică in vivo egală cu aproximativ 10 000 UI FSH / mg proteină). Pulberea pentru soluţie injectabilă conţine substanţa activă folitropină beta, produsă prin inginerie genetică pe culturi de celule ovariene (CHO) de hamster de China. După reconstituire, soluţia conţine 50 UI de folitropină beta per ml. Pentru lista tuturor excipienţilor, vezi pct. 6.1. 3. FORMA FARMACEUTICĂPulbere şi solvent pentru soluţie injectabilă (pulbere pentru injecţie şi solvent pentru uz parenteral). Bulgăre sau pulbere albă sau aproape albă. Solventul este o soluţie limpede şi fără culoare. 4. DATE CLINICE4.1 Indicaţii terapeuticeLa femei: Puregon este indicat pentru tratamentul infertilităţii la femei în următoarele situaţii clinice:
La bărbaţi: • Deficit de spermatogeneză datorat hipogonadismului hipogonadotropic. 4.2 Doze şi mod de administrareTratamentul cu Puregon trebuie iniţiat sub supravegherea unui medic cu experienţă în tratamentul problemelor de fertilitate. Posologie Dozarea la femei Există mari variaţii inter-şi intra-individuale ale răspunsului ovarelor la gonadotropinele exogene. Acest lucru face imposibilă stabilirea unei scheme uniforme de dozare. De aceea, dozarea trebuie ajustată individual, în funcţie de răspunsul ovarian. Aceasta necesită ecografie şi monitorizarea concentraţiilor plasmatice de estradiol. Pe baza rezultatelor din studiile clinice comparative, se consideră adecvată administrarea unei doze mai mici de Puregon decât cea de FSH urinar folosită uzual, nu numai pentru a optimiza dezvoltarea foliculară, dar şi pentru a evita riscul unei hiperstimulări ovariene nedorite. Experienţa clinică cu Puregon se bazează pe maximum 3 cicluri de tratament pentru ambele indicaţii. Experienţa de până acum în FIV indică faptul că, în general, rata de succes a tratamentului rămâne stabilă pentru primele patru încercări şi apoi scade treptat.
Dozarea la bărbaţi Puregon trebuie administrat în doză de 450 UI/săptămână, preferabil fracţionat în 3 doze a 150 UI, concomitent cu hCG. Tratamentul trebuie continuat timp de cel puţin 3 – 4 luni înainte de a se aşteptaameliorarea spermatogenezei. În cazul în care, după această perioadă, pacientul nu a răspuns la tratament, se poate continua terapia combinată; experienţa clinică curentă indică faptul că pentru obtinerea spermatogenezei poate fi necesară continuarea acestui tratament până la 18 luni sau mai mult. Nu există nici o indicaţie relevantă pentru utilizarea Puregon la copii. Mod de administrare Puregon trebuie reconstituit cu solventul furnizat. Soluţia reconstituită trebuie folosită imediat. Pentru a se evita injectarea unui volum mare, 3 sau 4 liosfere de Puregon pot fi dizolvate în 1 ml de solvent. Când sunt necesare doar 1 sau 2 liosfere volumul poate fi redus la 0,5 ml. După reconstituirea fiecărei sfere trebuie verificat vizual dacă tot materialul liofilizat s-a dizolvat complet. Soluţia reconstituită nu trebuie utilizată dacă conţine particule sau nu este limpede. Pentru a preveni injecţiile dureroase şi pentru a reduce scurgerea de la locul injectării, Puregon trebuie administrat lent intramuscular sau subcutanat. Locul de injectare subcutanată trebuie alternat pentru a preveni lipoatrofia. Orice soluţie nefolosită trebuie aruncată. Injecţia subcutanată cu Puregon poate fi efectuată de către pacient sau de către partener, cu condiţia să primească instrucţiunile necesare de la medic. Autoadministrarea de Puregon trebuie efectuată numai de către pacienţi care sunt bine motivaţi, instruiţi adecvat şi care au acces la sfatul unui specialist. 4.3 Contraindicaţii
4.4 Atenţionări şi precauţii speciale pentru utilizare
4.5 Interacţiuni cu alte medicamente şi alte forme de interacţiuneFolosirea concomitentă de Puregon şi clomifen citrat poate creşte răspunsul folicular. După desensibilizarea hipofizara indusă printr-un agonist GnRH, poate fi necesară o doză mai mare de Puregon pentru a obţine un răspuns folicular adecvat. 4.6 Sarcina şi alăptareaNu există indicaţii pentru utilizarea Puregon în timpul sarcinii. Nu a fost raportat un risc teratogenic în utilizarea clinică a gonadotropinelor, după hiperstimulare ovariană controlată. În caz de expunere în timpul sarcinii, datele clinice nu sunt suficiente pentru a exclude un efect teratogen al FSH recombinat. Totuşi, pînă în prezent nu a fost raportat nici un efect malformativ specific. Nu s-au observat efecte teratogene în studiile pe animale. Puregon nu trebuie administrat în timpul alăptării. 4.7 Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilajePuregon nu are nici o influenţă sau are influenţă neglijabilă asupra capacităţii de a conduce vehicule sau de a folosi utilaje. 4.8 Reacţii adverseFolosirea clinică de Puregon pe cale intramusculară sau subcutanată poate duce la reacţii locale la locul injectării: hematomul, durerea, roşeaţa, edemul local şi pruritul sunt frecvent raportate (3% din toţi pacienţii trataţi). Majoritatea acestor reacţii locale sunt uşoare şi trec de la sine. Reacţii de hipersensibilitate generalizate incluzând eritem, urticare, erupţie cutanatăşi prurit s-au observat foarte rar (0,1% din toţi pacienţii trataţi cu Puregon). Tratament la femei: La aproximativ 4% din femeile tratate cu Puregon în cadrul studiilor clinice, au fost raportate semne şi simptome în legătură cu sindromul de hiperstimulare ovariană (OHSS) (vezi pct. 4.4). Alte efecte nedorite asociate cu acest sindrom au fost observate în studii clinice. Acestea includ durere pelvină şi/sau congestie, durere abdominalăşi/sau distensie, acuze la nivelul sânului (sensibilitatea sânului, durere şi/sau tumefacţie), mărire ovariană, şi avort spontan. Toate acestea au fost raportate la o incidenţă de aproximativ 1% (durere pelvinăşi distensie abdominală) sau mai puţin. A fost observată o uşoară creştere a riscului de sarcină ectopicăşi de sarcini multiple. Celelalte simptome mai generale care au fost raportate includ cefaleea şi greaţa (până la 1% din femeile tratate cu Puregon). În cazuri rare, tromboemboliile au fost asociate cu tratamentul cu Puregon/hCG ca şi în tratamentul cu alte gonadotropine. Tratament la bărbaţi: Ocazional, în timpul tratamentului cu Puregon/hCG pot să apară ginecomastie şi acnee. Acestea sunt reacţii cunoscute ale terapiei cu hCG. La un subiect a fost observat un chist epididimal. 4.9 SupradozajNu sunt disponibile date despre toxicitatea acută a Puregon la om, dar în studiile la animale s-a arătat că toxicitatea acută a Puregon şi a preparatelor gonadotropinice urinare a fost foarte mică. O doză prea mare de FSH poate duce la hiperstimularea ovarelor (vezi pct 4.4). 5. PROPRIETĂŢI FARMACOLOGICE5.1 Proprietăţi farmacodinamiceGrupa farmacoterapeutică: gonadotropine, codul ATC: G03G A06. Puregon conţine FSH recombinat. Acesta este produs printr-o tehnologie de recombinare a ADN, folosind o linie celulară ovariană de hamster de China transfectată cu subunităţi genice de FSH uman. Secvenţa primară de aminoacizi este identică cu cea a FSH-ului uman natural. Se cunoaşte existenţa unor mici diferenţe în structura lanţului carbohidrat. FSH este indispensabil pentru creşterea şi maturarea foliculară normalăşi pentru producerea steroizilor gonadali. La femei, concentraţia de FSH este critică pentru iniţierea şi durata dezvoltării foliculare şi, în consecinţă, pentru cronologia şi numărul de foliculi care ajung la maturitate. Prin urmare, Puregon poate fi folosit pentru a stimula dezvoltarea folicularăşi producerea de steroizi în cazuri selecţionate de afectare a funcţiei gonadale. În plus, Puregon poate fi folosit pentru a provoca dezvoltarea foliculară multiplă în programele de reproducere asistată medical [de exemplu fertilizarea in vitro/transferul de embrion (FIV/TE), transfer intrafalopian de gameţi (GIFT) şi injectarea intracitoplasmatică de spermă (ICSI)]. Tratamentul cu Puregon este, în general, urmat de administrarea de hCG pentru a induce faza finală a maturării foliculare, reînceperea meiozei şi ruperea foliculului. La bărbaţii cu deficit de FSH, Puregon trebuie utilizat concomitent cu hCG timp de cel puţin patru luni, pentru inducerea spermatogenezei. 5.2 Proprietăţi farmacocineticeDupă administrare intramusculară sau subcutanată de Puregon, concentraţiile maxime de FSH sunt atinse în aproximativ 12 ore. După administrarea intramusculară de Puregon concentraţia FSH-ului este mai mare şi se atinge mai repede la bărbaţi comparativ cu femeile. Datorită eliberării lente de la locul injecţiei şi a unui timp de înjumătăţire de aproximativ 40 ore (cuprins între 12 şi 70 de ore), concentraţiile de FSH rămân crescute timp de 24-48 de ore. Datorită timpului de înjumătăţire relativ mare, administrarea repetată a aceleiaşi doze va duce la concentraţii plasmatice de FSH care sunt de aproximativ 1,5–2,5 ori mai mari faţă de cele atinse după administrarea unei singure doze. Această creştere permite atingerea concentraţiilor terapeutice de FSH. Nu există diferenţe farmacocinetice semnificative între administrarea intramuscularăşi cea subcutanată de Puregon. Ambele au o biodisponibilitate absolută de aproximativ 77%. FSH-ul recombinat este din punct de vedere biochimic foarte asemănător cu FSH-ul urinar uman şi este distribuit, metabolizat şi eliminat în acelaşi mod. 5.3 Date preclinice de siguranţăAdministrarea unei doze unice de Puregon la şobolan nu a produs efecte semnificative toxicologic. În studii cu doze repetate la şobolan (două săptămâni) şi câine (13 săptămâni), de până la 100 de ori doza umană maximă, Puregon nu a produs efecte semnificative toxicologic. Puregon nu a demonstrat potenţial mutagen la testul Ames şi nici în in vitro la testul aberaţiilor cromozomiale cu limfocite umane. 6. PROPRIETĂŢI FARMACEUTICE6.1 Lista excipienţilorPuregon pulbere pentru soluţie injectabilă conţine: sucroză citrat de sodiu polisorbat 20 Este posibil ca pH-ul să fi fost ajustat cu hidroxid de sodiu şi/sau acid clorhidric. Fiola de solvent conţine clorură de sodiu (4,5 mg) în apă pentru preparate injectabile (1,0 ml). 6.2 IncompatibilităţiÎn absenţa studiilor privind compatibilitatea, acest medicament nu trebuie amestecat cu alte medicamente. 6.3 Perioada de valabilitate2 ani. Deoarece o fiolă deschisă nu poate fi resigilată în aşa fel încît să se garanteze ulterior sterilitatea conţinutului, soluţia trebuie folosită imediat după reconstituire. 6.4 Precauţii speciale pentru păstrareA nu se păstra la temperaturi peste 30 °C. A nu se congela. A se ţine fiolele în cutie. 6.5 Natura şi conţinutul ambalajuluiSferă liofilizată sterilă în fiolă de 1 ml (sticlă tip I) şi 1 ml de solvent (soluţie salină 0,45%) în fiolă de 1 ml (sticlă tip I). Pachet de 1, 3, 5 sau 10. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. 6.6 Precauţii speciale pentru eliminarea reziduurilor şi alte instrucţiuni de manipularePuregon trebuie reconstituit cu solventul furnizat, folosind o mişcare de rotire uşoară. Nu trebuie agitat puternic. Nu folosiţi dacă soluţia conţine particule sau dacă soluţia nu este limpede. Când se dizolvă mai mult de o sferă trebuie verificat vizual dacă tot materialul liofilizat s-a dizolvat complet înainte de a transfera soluţia pentru reconstituirea următoarei fiole. Deoarece o fiolă deschisă nu poate fi resigilată în aşa fel încît să se garanteze ulterior sterilitatea conţinutului, soluţia trebuie folosită imediat după reconstituire. Orice produs neutilizat sau material rezidual trebuie eliminat în conformitate cu reglementările locale. 7. DEŢINĂTORUL AUTORIZAŢIEI DE PUNERE PE PIAŢĂN.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda 8. NUMĂRUL(ELE) AUTORIZAŢIEI DE PUNERE PE PIAŢĂEU/1/96/008/001 EU/1/96/008/002 EU/1/96/008/003 EU/1/96/008/004 9. DATA PRIMEI AUTORIZĂRI SAU A REÎNNOIRII AUTORIZAŢIEI Data primei autorizări: 3 Mai 1996 Data ultimei reautorizări: 3 Mai 2006 10. DATA REVIZUIRII TEXTULUI 1. DENUMIREA COMERCIALĂ A MEDICAMENTULUI Puregon 75 UI pulbere şi solvent pentru soluţie injectabilă 2. COMPOZIŢIA CALITATIVĂŞI CANTITATIVĂ Un flacon conţine 75 UI hormon foliculostimulant (FSH) recombinat corespunzînd la 7,5 micrograme de proteină (bioactivitate specifică in vivo egală cu aproximativ 10 000 UI FSH / mg proteină). Pulberea pentru soluţie injectabilă conţine substanţa activă folitropină beta, produsă prin inginerie genetică pe culturi de celule ovariene (CHO) de hamster de China. După reconstituire, soluţia conţine 75 UI de folitropină beta per ml. Pentru lista tuturor excipienţilor, vezi pct. 6.1. 3. FORMA FARMACEUTICĂ Pulbere şi solvent pentru soluţie injectabilă (pulbere pentru injecţie şi solvent pentru uz parenteral). Bulgăre sau pulbere albă sau aproape albă. Solventul este o soluţie limpede şi fără culoare. 4. DATE CLINICE 4.1 Indicaţii terapeutice La femei: Puregon este indicat pentru tratamentul infertilităţii la femei în următoarele situaţii clinice:
La bărbaţi: • Deficit de spermatogeneză datorat hipogonadismului hipogonadotropic. 4.2 Doze şi mod de administrare Tratamentul cu Puregon trebuie iniţiat sub supravegherea unui medic cu experienţă în tratamentul problemelor de fertilitate. Posologie Dozarea la femei Există mari variaţii inter-şi intra-individuale ale răspunsului ovarelor la gonadotropinele exogene. Acest lucru face imposibilă stabilirea unei scheme uniforme de dozare. De aceea, dozarea trebuie ajustată individual, în funcţie de răspunsul ovarian. Aceasta necesită ecografie şi monitorizarea concentraţiilor plasmatice de estradiol. Pe baza rezultatelor din studiile clinice comparative, se consideră adecvată administrarea unei doze mai mici de Puregon decât cea de FSH urinar folosită uzual, nu numai pentru a optimiza dezvoltarea foliculară, dar şi pentru a evita riscul unei hiperstimulări ovariene nedorite. Experienţa clinică cu Puregon se bazează pe maximum 3 cicluri de tratament pentru ambele indicaţii. Experienţa de până acum în FIV indică faptul că, în general, rata de succes a tratamentului rămâne stabilă pentru primele patru încercări şi apoi scade treptat.
Dozarea la bărbaţi Puregon trebuie administrat în doză de 450 UI/săptămână, preferabil fracţionat în 3 doze a 150 UI, concomitent cu hCG. Tratamentul trebuie continuat timp de cel puţin 3 – 4 luni înainte de a se aşteptaameliorarea spermatogenezei. În cazul în care, după această perioadă, pacientul nu a răspuns la tratament, se poate continua terapia combinată; experienţa clinică curentă indică faptul că pentru obtinerea spermatogenezei poate fi necesară continuarea acestui tratament până la 18 luni sau mai mult. Nu există nici o indicaţie relevantă pentru utilizarea Puregon la copii. Mod de administrare Puregon trebuie reconstituit cu solventul furnizat. Soluţia reconstituită trebuie folosită imediat. Pentru a se evita injectarea unui volum mare, 3 sau 4 bulgări de Puregon pot fi dizolvaţi în 1 ml de solvent. Cînd sunt necesari doar 1 sau 2 bulgări volumul poate fi redus la 0,5 ml. După reconstituirea fiecărui bulgăre trebuie verificat vizual dacă tot materialul liofilizat s-a dizolvat complet. Soluţia reconstituită nu trebuie utilizată dacă conţine particule sau nu este limpede. Pentru a preveni injecţiile dureroase şi pentru a reduce scurgerea de la locul injectării Puregon trebuie administrat lent intramuscular sau subcutanat. Locul de injectare subcutanată trebuie alternat pentru a preveni lipoatrofia. Orice soluţie nefolosită trebuie aruncată. Injecţia subcutanată cu Puregon poate fi efectuată de către pacient sau de către partener, cu condiţia să primească instrucţiunile necesare de la medic. Autoadministrarea de Puregon trebuie efectuată numai de către pacienţi care sunt bine motivaţi, instruiţi adecvat şi care au acces la sfatul unui specialist. 4.3 Contraindicaţii
4.4 Atenţionări şi precauţii speciale pentru utilizare
4.5 Interacţiuni cu alte medicamente şi alte forme de interacţiune Folosirea concomitentă de Puregon şi clomifen citrat poate creşte răspunsul folicular. După desensibilizarea hipofizara indusă printr-un agonist GnRH, poate fi necesară o doză mai mare de Puregon pentru a obţine un răspuns folicular adecvat. 4.6 Sarcina şi alăptarea Nu există indicaţii pentru utilizarea Puregon în timpul sarcinii. Nu a fost raportat un risc teratogenic în utilizarea clinică a gonadotropinelor după hiperstimulare ovariană controlată. În caz de expunere în timpul sarcinii, datele clinice nu sunt suficiente pentru a exclude un efect teratogen al FSH recombinat. Totuşi, pînă în prezent nu a fost raportat nici un efect malformativ specific. Nu s-au observat efecte teratogene în studiile pe animale. Puregon nu trebuie administrat în timpul alăptării. 4.7 Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilaje Puregon nu are nici o influenţă sau are influenţă neglijabilă asupra capacităţii de a conduce vehicule sau de a folosi utilaje. 4.8 Reacţii adverse Folosirea clinică de Puregon pe cale intramusculară sau subcutanată poate duce la reacţii locale la locul injectării: hematomul, durerea, roşeaţa, edemul local şi pruritul sunt frecvent raportate (3% din toţi pacienţii trataţi). Majoritatea acestor reacţii locale sunt uşoare şi trec de la sine. Reacţii de hipersensibilitate generalizate incluzând eritem, urticare, erupţie cutanatăşi prurit s-au observat foarte rar (0,1% din toţi pacienţii trataţi cu Puregon). Tratament la femei: La aproximativ 4% din femeile tratate cu Puregon în cadrul studiilor clinice, au fost raportate semne şi simptome în legătură cu sindromul de hiperstimulare ovariană (OHSS) (vezi pct. 4.4). Alte efecte nedorite asociate cu acest sindrom au fost observate în studii clinice. Acestea includ durere pelvină şi/sau congestie, durere abdominalăşi/sau distensie, acuze la nivelul sânului (sensibilitatea sânului, durere şi/sau tumefacţie), mărire ovariană, şi avort spontan. Toate acestea au fost raportate la o incidenţă de aproximativ 1% (durere pelvinăşi distensie abdominală) sau mai puţin. A fost observată o uşoară creştere a riscului de sarcină ectopicăşi de sarcini multiple. Celelalte simptome mai generale care au fost raportate includ cefaleea şi greaţa (până la 1% din femeile tratate cu Puregon). În cazuri rare, tromboemboliile au fost asociate cu tratamentul cu Puregon/hCG ca şi în tratamentul cu alte gonadotropine. Tratament la bărbaţi: Ocazional, în timpul tratamentului cu Puregon/hCG pot să apară ginecomastie şi acnee. Acestea sunt reacţii cunoscute ale terapiei cu hCG. La un subiect a fost observat un chist epididimal. 4.9 Supradozaj Nu sunt disponibile date despre toxicitatea acută a Puregon la om, dar în studiile la animale s-a arătat că toxicitatea acută a Puregon şi a preparatelor gonadotropinice urinare a fost foarte mică. O doză prea mare de FSH poate duce la hiperstimularea ovarelor (vezi pct 4.4). 5. PROPRIETĂŢI FARMACOLOGICE 5.1 Proprietăţi farmacodinamice Grupa farmacoterapeutică: gonadotropine, codul ATC: G03G A06. Puregon conţine FSH recombinat. Acesta este produs printr-o tehnologie de recombinare a ADN, folosind o linie celulară ovariană de hamster de China transfectată cu subunităţi genice de FSH uman. Secvenţa primară de aminoacizi este identică cu cea a FSH-ului uman natural. Se cunoaşte existenţa unor mici diferenţe în structura lanţului carbohidrat. FSH este indispensabil pentru creşterea şi maturarea foliculară normalăşi pentru producerea steroizilor gonadali. La femei, concentraţia de FSH este critică pentru iniţierea şi durata dezvoltării foliculare şi, în consecinţă, pentru cronologia şi numărul de foliculi care ajung la maturitate. Prin urmare, Puregon poate fi folosit pentru a stimula dezvoltarea folicularăşi producerea de steroizi în cazuri selecţionate de afectare a funcţiei gonadale. În plus, Puregon poate fi folosit pentru a provoca dezvoltarea foliculară multiplă în programele de reproducere asistată medical [de exemplu fertilizarea in vitro/transferul de embrion (FIV/TE), transfer intrafalopian de gameţi (GIFT) şi injectarea intracitoplasmatică de spermă (ICSI)]. Tratamentul cu Puregon este, în general, urmat de administrarea de hCG pentru a induce faza finală a maturării foliculare, reînceperea meiozei şi ruperea foliculului. La bărbaţi cu deficit de FSH, Puregon trebuie utilizat concomitent cu hCG timp de cel puţin patru luni, pentru inducerea spermatogenezei. 5.2 Proprietăţi farmacocinetice După administrare intramusculară sau subcutanată de Puregon, concentraţiile maxime de FSH sunt atinse în aproximativ 12 ore. După administrarea intramusculară de Puregon concentraţia FSH-ului este mai mare şi se atinge mai repede la bărbaţi comparativ cu femeile. Datorită eliberării lente de la locul injecţiei şi a unui timp de înjumătăţire de aproximativ 40 ore (cuprins între 12 şi 70 de ore), concentraţiile de FSH rămân crescute timp de 24-48 de ore. Datorită timpului de înjumătăţire relativ mare, administrarea repetată a aceleiaşi doze va duce la concentraţii plasmatice de FSH care sunt de aproximativ 1,5–2,5 ori mai mari faţă de cele atinse după administrarea unei singure doze. Această creştere permite atingerea concentraţiilor terapeutice de FSH. Nu există diferenţe farmacocinetice semnificative între administrarea intramuscularăşi cea subcutanată de Puregon. Ambele au o biodisponibilitate absolută de aproximativ 77%. FSH-ul recombinat este din punct de vedere biochimic foarte asemănător cu FSH-ul urinar uman şi este distribuit, metabolizat şi eliminat în acelaşi mod. 5.3 Date preclinice de siguranţă Administrarea unei doze unice de Puregon la şobolan nu a produs efecte semnificative toxicologic. În studii cu doze repetate la şobolan (două săptămâni) şi câine (13 săptămâni), de până la 100 de ori doza umană maximă, Puregon nu a produs efecte semnificative toxicologic. Puregon nu a demonstrat potenţial mutagen la testul Ames şi nici în in vitro la testul aberaţiilor cromozomiale cu limfocite umane. 6. PROPRIETĂŢI FARMACEUTICE 6.1 Lista excipienţilor Puregon pulbere pentru soluţie injectabilă conţine: sucroză citrat de sodiu polisorbat 20 Este posibil ca pH-ul să fi fost ajustat cu hidroxid de sodiu şi/sau acid clorhidric. Fiola de solvent conţine clorură de sodiu (4,5 mg) în apă pentru preparate injectabile (1,0 ml). 6.2 Incompatibilităţi În absenţa studiilor privind compatibilitatea, acest medicament nu trebuie amestecat cu alte medicamente. 6.3 Perioada de valabilitate 2 ani. Conţinutul unui flacon trebuie folosit imediat după reconstituire. 6.4 Precauţii speciale pentru păstrare A nu se păstra la temperaturi peste 30 °C. A nu se congela. A se ţine flaconul (flacoanele) şi fiola (fiolele) în cutie. 6.5 Natura şi conţinutul ambalajului Bulgăre liofilizat steril în flacon de 1 ml (sticlă tip I) şi 1 ml de solvent (soluţie salină 0,45%) în fiolă de 1 ml (sticlă tip I). Pachet de 1, 3, 5 sau 10. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. 6.6 Precauţii speciale pentru eliminarea reziduurilor şi alte instrucţiuni de manipulare Puregon trebuie reconstituit cu solventul furnizat, folosind o mişcare de rotire uşoară. Nu trebuie agitat puternic. Nu folosiţi dacă soluţia conţine particule sau dacă soluţia nu este limpede. Când se dizolvă mai mult de un bulgăre trebuie verificat vizual dacă tot materialul liofilizat s-a dizolvat complet înainte de a transfera soluţia pentru reconstituirea următorului flacon. Conţinutul unui flacon trebuie folosit imediat după reconstituire. Orice produs neutilizat sau material rezidual trebuie eliminat în conformitate cu reglementările locale. 7. DEŢINĂTORUL AUTORIZAŢIEI DE PUNERE PE PIAŢĂ N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda 8. NUMĂRUL(ELE) AUTORIZAŢIEI DE PUNERE PE PIAŢĂEU/1/96/008/005 EU/1/96/008/006 EU/1/96/008/007 EU/1/96/008/008
Data primei autorizări: 3 Mai 1996 Data ultimei reautorizări: 3 Mai 2006 1. DENUMIREA COMERCIALĂ A MEDICAMENTULUI Puregon 100 UI pulbere şi solvent pentru soluţie injectabilă 2. COMPOZIŢIA CALITATIVĂŞI CANTITATIVĂ O fiolă conţine 100 UI hormon foliculostimulant (FSH) recombinat corespunzînd la 10 micrograme de proteină (bioactivitate specifică in vivo egală cu aproximativ 10 000 UI FSH / mg proteină). Pulberea pentru soluţie injectabilă conţine substanţa activă folitropină beta, produsă prin inginerie genetică pe culturi de celule ovariene (CHO) de hamster de China. După reconstituire, soluţia conţine 100 UI de folitropină beta per ml. Pentru lista tuturor excipienţilor, vezi pct. 6.1. 3. FORMA FARMACEUTICĂ Pulbere şi solvent pentru soluţie injectabilă (pulbere pentru injecţie şi solvent pentru uz parenteral). Bulgăre sau pulbere albă sau aproape albă. Solventul este o soluţie limpede şi fără culoare. 4. DATE CLINICE 4.1 Indicaţii terapeutice La femei: Puregon este indicat pentru tratamentul infertilităţii la femei în următoarele situaţii clinice:
La bărbaţi: • Deficit de spermatogeneză datorat hipogonadismului hipogonadotropic. 4.2 Doze şi mod de administrare Tratamentul cu Puregon trebuie iniţiat sub supravegherea unui medic cu experienţă în tratamentul problemelor de fertilitate. Posologie Dozarea la femei Există mari variaţii inter-şi intra-individuale ale răspunsului ovarelor la gonadotropinele exogene. Acest lucru face imposibilă stabilirea unei scheme uniforme de dozare. De aceea, dozarea trebuie ajustată individual, în funcţie de răspunsul ovarian. Aceasta necesită ecografie şi monitorizarea concentraţiilor plasmatice de estradiol. Pe baza rezultatelor din studiile clinice comparative, se consideră adecvată administrarea unei doze mai mici de Puregon decât cea de FSH urinar folosită uzual, nu numai pentru a optimiza dezvoltarea foliculară, dar şi pentru a evita riscul unei hiperstimulări ovariene nedorite. Experienţa clinică cu Puregon se bazează pe maximum 3 cicluri de tratament pentru ambele indicaţii. Experienţa de până acum în FIV indică faptul că, în general, rata de succes a tratamentului rămâne stabilă pentru primele patru încercări şi apoi scade treptat.
Dozarea la bărbaţi Puregon trebuie administrat în doză de 450 UI/săptămână, preferabil fracţionat în 3 doze a 150 UI, concomitent cu hCG. Tratamentul trebuie continuat timp de cel puţin 3 – 4 luni înainte de a se aşteptaameliorarea spermatogenezei. În cazul în care, după această perioadă, pacientul nu a răspuns la tratament, se poate continua terapia combinată; experienţa clinică curentă indică faptul că pentru obtinerea spermatogenezei poate fi necesară continuarea acestui tratament până la 18 luni sau mai mult. Nu există nici o indicaţie relevantă pentru utilizarea Puregon la copii. Mod de administrare Puregon trebuie reconstituit cu solventul furnizat. Soluţia reconstituită trebuie folosită imediat. Pentru a se evita injectarea unui volum mare, 3 sau 4 liosfere de Puregon pot fi dizolvate în 1 ml de solvent. Când sunt necesare doar 1 sau 2 liosfere volumul poate fi redus la 0,5 ml. După reconstituirea fiecărei sfere trebuie verificat vizual dacă tot materialul liofilizat s-a dizolvat complet. Soluţia reconstituită nu trebuie utilizată dacă conţine particule sau nu este limpede. Pentru a preveni injecţiile dureroase şi pentru a reduce scurgerea de la locul injectării, Puregon trebuie administrat lent intramuscular sau subcutanat. Locul de injectare subcutanată trebuie alternat pentru a preveni lipoatrofia. Orice soluţie nefolosită trebuie aruncată. Injecţia subcutanată cu Puregon poate fi efectuată de către pacient sau de către partener, cu condiţia să primească instrucţiunile necesare de la medic. Autoadministrarea de Puregon trebuie efectuată numai de către pacienţi care sunt bine motivaţi, instruiţi adecvat şi care au acces la sfatul unui specialist. 4.3 Contraindicaţii
4.4 Atenţionări şi precauţii speciale pentru utilizare
4.5 Interacţiuni cu alte medicamente şi alte forme de interacţiune Folosirea concomitentă de Puregon şi clomifen citrat poate creşte răspunsul folicular. După desensibilizarea hipofizara indusă printr-un agonist GnRH, poate fi necesară o doză mai mare de Puregon pentru a obţine un răspuns folicular adecvat. 4.6 Sarcina şi alăptarea Nu există indicaţii pentru utilizarea Puregon în timpul sarcinii. Nu a fost raportat un risc teratogenic în utilizarea clinică a gonadotropinelor, după hiperstimulare ovariană controlată. În caz de expunere în timpul sarcinii, datele clinice nu sunt suficiente pentru a exclude un efect teratogen al FSH recombinat. Totuşi, pînă în prezent nu a fost raportat nici un efect malformativ specific. Nu s-au observat efecte teratogene în studiile pe animale. Puregon nu trebuie administrat în timpul alăptării. 4.7 Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilaje Puregon nu are nici o influenţă sau are influenţă neglijabilă asupra capacităţii de a conduce vehicule sau de a folosi utilaje. 4.8 Reacţii adverse Folosirea clinică de Puregon pe cale intramusculară sau subcutanată poate duce la reacţii locale la locul injectării: hematomul, durerea, roşeaţa, edemul local şi pruritul sunt frecvent raportate (3% din toţi pacienţii trataţi). Majoritatea acestor reacţii locale sunt uşoare şi trec de la sine. Reacţii de hipersensibilitate generalizate incluzând eritem, urticare, erupţie cutanatăşi prurit s-au observat foarte rar (0,1% din toţi pacienţii trataţi cu Puregon). Tratament la femei: La aproximativ 4% din femeile tratate cu Puregon în cadrul studiilor clinice, au fost raportate semne şi simptome în legătură cu sindromul de hiperstimulare ovariană (OHSS) (vezi pct. 4.4). Alte efecte nedorite asociate cu acest sindrom au fost observate în studii clinice. Acestea includ durere pelvină şi/sau congestie, durere abdominalăşi/sau distensie, acuze la nivelul sânului (sensibilitatea sânului, durere şi/sau tumefacţie), mărire ovariană, şi avort spontan. Toate acestea au fost raportate la o incidenţă de aproximativ 1% (durere pelvinăşi distensie abdominală) sau mai puţin. A fost observată o uşoară creştere a riscului de sarcină ectopicăşi de sarcini multiple. Celelalte simptome mai generale care au fost raportate includ cefaleea şi greaţa (până la 1% din femeile tratate cu Puregon). În cazuri rare, tromboemboliile au fost asociate cu tratamentul cu Puregon/hCG ca şi în tratamentul cu alte gonadotropine. Tratament la bărbaţi: Ocazional, în timpul tratamentului cu Puregon/hCG pot să apară ginecomastie şi acnee. Acestea sunt reacţii cunoscute ale terapiei cu hCG. La un subiect a fost observat un chist epididimal. 4.9 Supradozaj Nu sunt disponibile date despre toxicitatea acută a Puregon la om, dar în studiile la animale s-a arătat că toxicitatea acută a Puregon şi a preparatelor gonadotropinice urinare a fost foarte mică. O doză prea mare de FSH poate duce la hiperstimularea ovarelor (vezi pct 4.4). 5. PROPRIETĂŢI FARMACOLOGICE 5.1 Proprietăţi farmacodinamice Grupa farmacoterapeutică: gonadotropine, codul ATC: G03G A06. Puregon conţine FSH recombinat. Acesta este produs printr-o tehnologie de recombinare a ADN, folosind o linie celulară ovariană de hamster de China transfectată cu subunităţi genice de FSH uman. Secvenţa primară de aminoacizi este identică cu cea a FSH-ului uman natural. Se cunoaşte existenţa unor mici diferenţe în structura lanţului carbohidrat. FSH este indispensabil pentru creşterea şi maturarea foliculară normalăşi pentru producerea steroizilor gonadali. La femei, concentraţia de FSH este critică pentru iniţierea şi durata dezvoltării foliculare şi, în consecinţă, pentru cronologia şi numărul de foliculi care ajung la maturitate. Prin urmare, Puregon poate fi folosit pentru a stimula dezvoltarea folicularăşi producerea de steroizi în cazuri selecţionate de afectare a funcţiei gonadale. În plus, Puregon poate fi folosit pentru a provoca dezvoltarea foliculară multiplă în programele de reproducere asistată medical [de exemplu fertilizarea in vitro/transferul de embrion (FIV/TE), transfer intrafalopian de gameţi (GIFT) şi injectarea intracitoplasmatică de spermă (ICSI)]. Tratamentul cu Puregon este, în general, urmat de administrarea de hCG pentru a induce faza finală a maturării foliculare, reînceperea meiozei şi ruperea foliculului. La bărbaţii cu deficit de FSH, Puregon trebuie utilizat concomitent cu hCG timp de cel puţin patru luni, pentru inducerea spermatogenezei. 5.2 Proprietăţi farmacocinetice După administrare intramusculară sau subcutanată de Puregon, concentraţiile maxime de FSH sunt atinse în aproximativ 12 ore. După administrarea intramusculară de Puregon concentraţia FSH-ului este mai mare şi se atinge mai repede la bărbaţi comparativ cu femeile. Datorită eliberării lente de la locul injecţiei şi a unui timp de înjumătăţire de aproximativ 40 ore (cuprins între 12 şi 70 de ore), concentraţiile de FSH rămân crescute timp de 24-48 de ore. Datorită timpului de înjumătăţire relativ mare, administrarea repetată a aceleiaşi doze va duce la concentraţii plasmatice de FSH care sunt de aproximativ 1,5–2,5 ori mai mari faţă de cele atinse după administrarea unei singure doze. Această creştere permite atingerea concentraţiilor terapeutice de FSH. Nu există diferenţe farmacocinetice semnificative între administrarea intramuscularăşi cea subcutanată de Puregon. Ambele au o biodisponibilitate absolută de aproximativ 77%. FSH-ul recombinat este din punct de vedere biochimic foarte asemănător cu FSH-ul urinar uman şi este distribuit, metabolizat şi eliminat în acelaşi mod. 5.3 Date preclinice de siguranţă Administrarea unei doze unice de Puregon la şobolan nu a produs efecte semnificative toxicologic. În studii cu doze repetate la şobolan (două săptămâni) şi câine (13 săptămâni), de până la 100 de ori doza umană maximă, Puregon nu a produs efecte semnificative toxicologic. Puregon nu a demonstrat potenţial mutagen la testul Ames şi nici în in vitro la testul aberaţiilor cromozomiale cu limfocite umane. 6. PROPRIETĂŢI FARMACEUTICE 6.1 Lista excipienţilor Puregon pulbere pentru soluţie injectabilă conţine: sucroză citrat de sodiu polisorbat 20 Este posibil ca pH-ul să fi fost ajustat cu hidroxid de sodiu şi/sau acid clorhidric. Fiola de solvent conţine clorură de sodiu (4,5 mg) în apă pentru preparate injectabile (1,0 ml). 6.2 Incompatibilităţi În absenţa studiilor privind compatibilitatea, acest medicament nu trebuie amestecat cu alte medicamente. 6.3 Perioada de valabilitate 2 ani. Deoarece o fiolă deschisă nu poate fi resigilată în aşa fel încît să se garanteze ulterior sterilitatea conţinutului, soluţia trebuie folosită imediat după reconstituire. 6.4 Precauţii speciale pentru păstrare A nu se păstra la temperaturi peste 30 °C. A nu se congela. A se ţine fiolele în cutie. 6.5 Natura şi conţinutul ambalajului Sferă liofilizată sterilă în fiolă de 1 ml (sticlă tip I) şi 1 ml de solvent (soluţie salină 0,45%) în fiolă de 1 ml (sticlă tip I). Pachet de 1, 3, 5 sau 10. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. 6.6 Precauţii speciale pentru eliminarea reziduurilor şi alte instrucţiuni de manipulare Puregon trebuie reconstituit cu solventul furnizat, folosind o mişcare de rotire uşoară. Nu trebuie agitat puternic. Nu folosiţi dacă soluţia conţine particule sau dacă soluţia nu este limpede. Când se dizolvă mai mult de o sferă trebuie verificat vizual dacă tot materialul liofilizat s-a dizolvat complet înainte de a transfera soluţia pentru reconstituirea următoarei fiole. Deoarece o fiolă deschisă nu poate fi resigilată în aşa fel încît să se garanteze ulterior sterilitatea conţinutului, soluţia trebuie folosită imediat după reconstituire. Orice produs neutilizat sau material rezidual trebuie eliminat în conformitate cu reglementările locale. 7. DEŢINĂTORUL AUTORIZAŢIEI DE PUNERE PE PIAŢĂ N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda 8. NUMĂRUL(ELE) AUTORIZAŢIEI DE PUNERE PE PIAŢĂEU/1/96/008/009 EU/1/96/008/010 EU/1/96/008/011 EU/1/96/008/012 9. DATA PRIMEI AUTORIZĂRI SAU A REÎNNOIRII AUTORIZAŢIEI Data primei autorizări: 3 Mai 1996 Data ultimei reautorizări: 3 Mai 2006 10. DATA REVIZUIRII TEXTULUI 1. DENUMIREA COMERCIALĂ A MEDICAMENTULUI Puregon 150 UI pulbere şi solvent pentru soluţie injectabilă 2. COMPOZIŢIA CALITATIVĂŞI CANTITATIVĂ O fiolă conţine 150 UI hormon foliculostimulant (FSH) recombinat corespunzînd la 15 micrograme de proteină (bioactivitate specifică in vivo egală cu aproximativ 10 000 UI FSH / mg proteină). Pulberea pentru soluţie injectabilă conţine substanţa activă folitropină beta, produsă prin inginerie genetică pe culturi de celule ovariene (CHO) de hamster de China. După reconstituire, soluţia conţine 150 UI de folitropină beta per ml. Pentru lista tuturor excipienţilor, vezi pct. 6.1. 3. FORMA FARMACEUTICĂ Pulbere şi solvent pentru soluţie injectabilă (pulbere pentru injecţie şi solvent pentru uz parenteral). Bulgăre sau pulbere albă sau aproape albă. Solventul este o soluţie limpede şi fără culoare. 4. DATE CLINICE 4.1 Indicaţii terapeutice La femei: Puregon este indicat pentru tratamentul infertilităţii la femei în următoarele situaţii clinice:
La bărbaţi: • Deficit de spermatogeneză datorat hipogonadismului hipogonadotropic. 4.2 Doze şi mod de administrare Tratamentul cu Puregon trebuie iniţiat sub supravegherea unui medic cu experienţă în tratamentul problemelor de fertilitate. Posologie Dozarea la femei Există mari variaţii inter-şi intra-individuale ale răspunsului ovarelor la gonadotropinele exogene. Acest lucru face imposibilă stabilirea unei scheme uniforme de dozare. De aceea, dozarea trebuie ajustată individual, în funcţie de răspunsul ovarian. Aceasta necesită ecografie şi monitorizarea concentraţiilor plasmatice de estradiol. Pe baza rezultatelor din studiile clinice comparative, se consideră adecvată administrarea unei doze mai mici de Puregon decât cea de FSH urinar folosită uzual, nu numai pentru a optimiza dezvoltarea foliculară, dar şi pentru a evita riscul unei hiperstimulări ovariene nedorite. Experienţa clinică cu Puregon se bazează pe maximum 3 cicluri de tratament pentru ambele indicaţii. Experienţa de până acum în FIV indică faptul că, în general, rata de succes a tratamentului rămâne stabilă pentru primele patru încercări şi apoi scade treptat.
Dozarea la bărbaţi Puregon trebuie administrat în doză de 450 UI/săptămână, preferabil fracţionat în 3 doze a 150 UI, concomitent cu hCG. Tratamentul trebuie continuat timp de cel puţin 3 – 4 luni înainte de a se aşteptaameliorarea spermatogenezei. În cazul în care, după această perioadă, pacientul nu a răspuns la tratament, se poate continua terapia combinată; experienţa clinică curentă indică faptul că pentru obtinerea spermatogenezei poate fi necesară continuarea acestui tratament până la 18 luni sau mai mult. Nu există nici o indicaţie relevantă pentru utilizarea Puregon la copii. Mod de administrare Puregon trebuie reconstituit cu solventul furnizat. Soluţia reconstituită trebuie folosită imediat. Pentru a se evita injectarea unui volum mare, 3 sau 4 liosfere de Puregon pot fi dizolvate în 1 ml de solvent. Când sunt necesare doar 1 sau 2 liosfere volumul poate fi redus la 0,5 ml. După reconstituirea fiecărei sfere trebuie verificat vizual dacă tot materialul liofilizat s-a dizolvat complet. Soluţia reconstituită nu trebuie utilizată dacă conţine particule sau nu este limpede. Pentru a preveni injecţiile dureroase şi pentru a reduce scurgerea de la locul injectării, Puregon trebuie administrat lent intramuscular sau subcutanat. Locul de injectare subcutanată trebuie alternat pentru a preveni lipoatrofia. Orice soluţie nefolosită trebuie aruncată. Injecţia subcutanată cu Puregon poate fi efectuată de către pacient sau de către partener, cu condiţia să primească instrucţiunile necesare de la medic. Autoadministrarea de Puregon trebuie efectuată numai de către pacienţi care sunt bine motivaţi, instruiţi adecvat şi care au acces la sfatul unui specialist. 4.3 Contraindicaţii
4.4 Atenţionări şi precauţii speciale pentru utilizare
4.5 Interacţiuni cu alte medicamente şi alte forme de interacţiune Folosirea concomitentă de Puregon şi clomifen citrat poate creşte răspunsul folicular. După desensibilizarea hipofizara indusă printr-un agonist GnRH, poate fi necesară o doză mai mare de Puregon pentru a obţine un răspuns folicular adecvat. 4.6 Sarcina şi alăptarea Nu există indicaţii pentru utilizarea Puregon în timpul sarcinii. Nu a fost raportat un risc teratogenic în utilizarea clinică a gonadotropinelor, după hiperstimulare ovariană controlată. În caz de expunere în timpul sarcinii, datele clinice nu sunt suficiente pentru a exclude un efect teratogen al FSH recombinat. Totuşi, pînă în prezent nu a fost raportat nici un efect malformativ specific. Nu s-au observat efecte teratogene în studiile pe animale. Puregon nu trebuie administrat în timpul alăptării. 4.7 Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilaje Puregon nu are nici o influenţă sau are influenţă neglijabilă asupra capacităţii de a conduce vehicule sau de a folosi utilaje. 4.8 Reacţii adverse Folosirea clinică de Puregon pe cale intramusculară sau subcutanată poate duce la reacţii locale la locul injectării: hematomul, durerea, roşeaţa, edemul local şi pruritul sunt frecvent raportate (3% din toţi pacienţii trataţi). Majoritatea acestor reacţii locale sunt uşoare şi trec de la sine. Reacţii de hipersensibilitate generalizate incluzând eritem, urticare, erupţie cutanatăşi prurit s-au observat foarte rar (0,1% din toţi pacienţii trataţi cu Puregon). Tratament la femei: La aproximativ 4% din femeile tratate cu Puregon în cadrul studiilor clinice, au fost raportate semne şi simptome în legătură cu sindromul de hiperstimulare ovariană (OHSS) (vezi pct. 4.4). Alte efecte nedorite asociate cu acest sindrom au fost observate în studii clinice. Acestea includ durere pelvină şi/sau congestie, durere abdominalăşi/sau distensie, acuze la nivelul sânului (sensibilitatea sânului, durere şi/sau tumefacţie), mărire ovariană, şi avort spontan. Toate acestea au fost raportate la o incidenţă de aproximativ 1% (durere pelvinăşi distensie abdominală) sau mai puţin. A fost observată o uşoară creştere a riscului de sarcină ectopicăşi de sarcini multiple. Celelalte simptome mai generale care au fost raportate includ cefaleea şi greaţa (până la 1% din femeile tratate cu Puregon). În cazuri rare, tromboemboliile au fost asociate cu tratamentul cu Puregon/hCG ca şi în tratamentul cu alte gonadotropine. Tratament la bărbaţi: Ocazional, în timpul tratamentului cu Puregon/hCG pot să apară ginecomastie şi acnee. Acestea sunt reacţii cunoscute ale terapiei cu hCG. La un subiect a fost observat un chist epididimal. 4.9 Supradozaj Nu sunt disponibile date despre toxicitatea acută a Puregon la om, dar în studiile la animale s-a arătat că toxicitatea acută a Puregon şi a preparatelor gonadotropinice urinare a fost foarte mică. O doză prea mare de FSH poate duce la hiperstimularea ovarelor (vezi pct 4.4). 5. PROPRIETĂŢI FARMACOLOGICE 5.1 Proprietăţi farmacodinamice Grupa farmacoterapeutică: gonadotropine, codul ATC: G03G A06. Puregon conţine FSH recombinat. Acesta este produs printr-o tehnologie de recombinare a ADN, folosind o linie celulară ovariană de hamster de China transfectată cu subunităţi genice de FSH uman. Secvenţa primară de aminoacizi este identică cu cea a FSH-ului uman natural. Se cunoaşte existenţa unor mici diferenţe în structura lanţului carbohidrat. FSH este indispensabil pentru creşterea şi maturarea foliculară normalăşi pentru producerea steroizilor gonadali. La femei, concentraţia de FSH este critică pentru iniţierea şi durata dezvoltării foliculare şi, în consecinţă, pentru cronologia şi numărul de foliculi care ajung la maturitate. Prin urmare, Puregon poate fi folosit pentru a stimula dezvoltarea folicularăşi producerea de steroizi în cazuri selecţionate de afectare a funcţiei gonadale. În plus, Puregon poate fi folosit pentru a provoca dezvoltarea foliculară multiplă în programele de reproducere asistată medical [de exemplu fertilizarea in vitro/transferul de embrion (FIV/TE), transfer intrafalopian de gameţi (GIFT) şi injectarea intracitoplasmatică de spermă (ICSI)]. Tratamentul cu Puregon este, în general, urmat de administrarea de hCG pentru a induce faza finală a maturării foliculare, reînceperea meiozei şi ruperea foliculului. La bărbaţii cu deficit de FSH, Puregon trebuie utilizat concomitent cu hCG timp de cel puţin patru luni, pentru inducerea spermatogenezei. 5.2 Proprietăţi farmacocinetice După administrare intramusculară sau subcutanată de Puregon, concentraţiile maxime de FSH sunt atinse în aproximativ 12 ore. După administrarea intramusculară de Puregon concentraţia FSH-ului este mai mare şi se atinge mai repede la bărbaţi comparativ cu femeile. Datorită eliberării lente de la locul injecţiei şi a unui timp de înjumătăţire de aproximativ 40 ore (cuprins între 12 şi 70 de ore), concentraţiile de FSH rămân crescute timp de 24-48 de ore. Datorită timpului de înjumătăţire relativ mare, administrarea repetată a aceleiaşi doze va duce la concentraţii plasmatice de FSH care sunt de aproximativ 1,5–2,5 ori mai mari faţă de cele atinse după administrarea unei singure doze. Această creştere permite atingerea concentraţiilor terapeutice de FSH. Nu există diferenţe farmacocinetice semnificative între administrarea intramuscularăşi cea subcutanată de Puregon. Ambele au o biodisponibilitate absolută de aproximativ 77%. FSH-ul recombinat este din punct de vedere biochimic foarte asemănător cu FSH-ul urinar uman şi este distribuit, metabolizat şi eliminat în acelaşi mod. 5.3 Date preclinice de siguranţă Administrarea unei doze unice de Puregon la şobolan nu a produs efecte semnificative toxicologic. În studii cu doze repetate la şobolan (două săptămâni) şi câine (13 săptămâni), de până la 100 de ori doza umană maximă, Puregon nu a produs efecte semnificative toxicologic. Puregon nu a demonstrat potenţial mutagen la testul Ames şi nici în in vitro la testul aberaţiilor cromozomiale cu limfocite umane. 6. PROPRIETĂŢI FARMACEUTICE 6.1 Lista excipienţilor Puregon pulbere pentru soluţie injectabilă conţine: sucroză citrat de sodiu polisorbat 20 Este posibil ca pH-ul să fi fost ajustat cu hidroxid de sodiu şi/sau acid clorhidric. Fiola de solvent conţine clorură de sodiu (4,5 mg) în apă pentru preparate injectabile (1,0 ml). 6.2 Incompatibilităţi În absenţa studiilor privind compatibilitatea, acest medicament nu trebuie amestecat cu alte medicamente. 6.3 Perioada de valabilitate 2 ani. Deoarece o fiolă deschisă nu poate fi resigilată în aşa fel încît să se garanteze ulterior sterilitatea conţinutului, soluţia trebuie folosită imediat după reconstituire. 6.4 Precauţii speciale pentru păstrare A nu se păstra la temperaturi peste 30 °C. A nu se congela. A se ţine fiolele în cutie. 6.5 Natura şi conţinutul ambalajului Sferă liofilizată sterilă în fiolă de 1 ml (sticlă tip I) şi 1 ml de solvent (soluţie salină 0,45%) în fiolă de 1 ml (sticlă tip I). Pachet de 1, 3, 5 sau 10. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. 6.6 Precauţii speciale pentru eliminarea reziduurilor şi alte instrucţiuni de manipulare Puregon trebuie reconstituit cu solventul furnizat, folosind o mişcare de rotire uşoară. Nu trebuie agitat puternic. Nu folosiţi dacă soluţia conţine particule sau dacă soluţia nu este limpede. Când se dizolvă mai mult de o sferă trebuie verificat vizual dacă tot materialul liofilizat s-a dizolvat complet înainte de a transfera soluţia pentru reconstituirea următoarei fiole. Deoarece o fiolă deschisă nu poate fi resigilată în aşa fel încît să se garanteze ulterior sterilitatea conţinutului, soluţia trebuie folosită imediat după reconstituire. Orice produs neutilizat sau material rezidual trebuie eliminat în conformitate cu reglementările locale. 7. DEŢINĂTORUL AUTORIZAŢIEI DE PUNERE PE PIAŢĂ N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda 8. NUMĂRUL(ELE) AUTORIZAŢIEI DE PUNERE PE PIAŢĂEU/1/96/008/013 EU/1/96/008/014 EU/1/96/008/015 EU/1/96/008/016 9. DATA PRIMEI AUTORIZĂRI SAU A REÎNNOIRII AUTORIZAŢIEI Data primei autorizări: 3 Mai 1996 Data ultimei reautorizări: 3 Mai 2006 10. DATA REVIZUIRII TEXTULUI 1. DENUMIREA COMERCIALĂ A MEDICAMENTULUI Puregon 100 UI/0,5 ml soluţie injectabilă 2. COMPOZIŢIA CALITATIVĂŞI CANTITATIVĂ Un flacon conţine 100 UI hormon foliculostimulant (FSH) recombinat în 0,5 ml soluţie apoasă. Aceasta corespunde unei concentraţii de 200 UI/ml. Un flacon conţine 10 micrograme de proteină (bioactivitate specifică in vivo egală cu aproximativ 10 000 UI FSH / mg proteină). Soluţia injectabilă conţine substanţa activă folitropină beta, produsă prin inginerie genetică pe culturi de celule ovariene (CHO) de hamster de China. Pentru lista tuturor excipienţilor, vezi pct. 6.1. 3. FORMA FARMACEUTICĂ Soluţie injectabilă. Soluţie limpede şi fără culoare. 4. DATE CLINICE 4.1 Indicaţii terapeutice La femei: Puregon este indicat pentru tratamentul infertilităţii la femei în următoarele situaţii clinice:
La bărbaţi: • Deficit de spermatogeneză datorat hipogonadismului hipogonadotropic. 4.2 Doze şi mod de administrare Tratamentul cu Puregon trebuie iniţiat sub supravegherea unui medic cu experienţă în tratamentul problemelor de fertilitate. Posologie Dozarea la femei Există mari variaţii inter-şi intra-individuale ale răspunsului ovarelor la gonadotropinele exogene. Acest lucru face imposibilă stabilirea unei scheme uniforme de dozare. De aceea, dozarea trebuie ajustată individual, în funcţie de răspunsul ovarian. Aceasta necesită ecografie şi monitorizarea concentraţiilor plasmatice de estradiol. Pe baza rezultatelor din studiile clinice comparative, se consideră adecvată administrarea unei doze mai mici de Puregon decât cea de FSH urinar folosită uzual, nu numai pentru a optimiza dezvoltarea foliculară, dar şi pentru a evita riscul unei hiperstimulări ovariene nedorite. Experienţa clinică cu Puregon se bazează pe maximum 3 cicluri de tratament pentru ambele indicaţii. Experienţa de până acum în FIV indică faptul că, în general, rata de succes a tratamentului rămâne stabilă pentru primele patru încercări şi apoi scade treptat.
Dozarea la bărbaţi Puregon trebuie administrat în doză de 450 UI/săptămână, preferabil fracţionat în 3 doze a 150 UI, concomitent cu hCG. Tratamentul trebuie continuat timp de cel puţin 3 – 4 luni înainte de a se aşteptaameliorarea spermatogenezei. În cazul în care, după această perioadă, pacientul nu a răspuns la tratament, se poate continua terapia combinată; experienţa clinică curentă indică faptul că pentru obtinerea spermatogenezei poate fi necesară continuarea acestui tratament până la 18 luni sau mai mult. Nu există nici o indicaţie relevantă pentru utilizarea Puregon la copii. Mod de administrare Pentru a preveni injecţiile dureroase şi pentru a reduce scurgerea de la locul injectării, Puregon trebuie administrat lent intramuscular sau subcutanat. Locul de injectare subcutanată trebuie alternat pentru a preveni lipoatrofia. Orice soluţie nefolosită trebuie aruncată. Injecţia subcutanată cu Puregon poate fi efectuată de către pacient sau de către partener, cu condiţia să primească instrucţiunile necesare de la medic. Autoadministrarea de Puregon trebuie efectuată numai de către pacienţi care sunt bine motivaţi, instruiţi adecvat şi care au acces la sfatul unui specialist. 4.3 Contraindicaţii
4.4 Atenţionări şi precauţii speciale pentru utilizare
4.5 Interacţiuni cu alte medicamente şi alte forme de interacţiune Folosirea concomitentă de Puregon şi clomifen citrat poate creşte răspunsul folicular. După desensibilizarea hipofizara indusă printr-un agonist GnRH, poate fi necesară o doză mai mare de Puregon pentru a obţine un răspuns folicular adecvat. 4.6 Sarcina şi alăptarea Nu există indicaţii pentru utilizarea Puregon în timpul sarcinii. Nu a fost raportat un risc teratogenic în utilizarea clinică a gonadotropinelor după hiperstimulare ovariană controlată. În caz de expunere în timpul sarcinii, datele clinice nu sunt suficiente pentru a exclude un efect teratogen al FSH recombinat. Totuşi, pînă în prezent nu a fost raportat nici un efect malformativ specific. Nu s-au observat efecte teratogene în studii pe animale. Puregon nu trebuie administrat în timpul alăptării. 4.7 Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilaje Puregon nu are nici o influenţă sau are influenţă neglijabilă asupra capacităţii de a conduce vehicule sau de a folosi utilaje. 4.8 Reacţii adverse Folosirea clinică de Puregon pe cale intramusculară sau subcutanată poate duce la reacţii locale la locul injectării: hematomul, durerea, roşeaţa, edemul local şi pruritul sunt frecvent raportate (3% din toţi pacienţii trataţi). Majoritatea acestor reacţii locale sunt uşoare şi trec de la sine. Reacţii de hipersensibilitate generalizate incluzând eritem, urticare, erupţie cutanatăşi prurit s-au observat foarte rar (0,1% din toţi pacienţii trataţi cu Puregon). Tratament la femei: La aproximativ 4% din femeile tratate cu Puregon în cadrul studiilor clinice, au fost raportate semne şi simptome în legătură cu sindromul de hiperstimulare ovariană (OHSS) (vezi pct. 4.4). Alte efecte nedorite asociate cu acest sindrom au fost observate în studii clinice. Acestea includ durere pelvină şi/sau congestie, durere abdominalăşi/sau distensie, acuze la nivelul sânului (sensibilitatea sânului, durere şi/sau tumefacţie), mărire ovariană, şi avort spontan. Toate acestea au fost raportate la o incidenţă de aproximativ 1% (durere pelvinăşi distensie abdominală) sau mai puţin. A fost observată o uşoară creştere a riscului de sarcină ectopicăşi de sarcini multiple. Celelalte simptome mai generale care au fost raportate includ cefaleea şi greaţa (până la 1% din femeile tratate cu Puregon). În cazuri rare, tromboemboliile au fost asociate cu tratamentul cu Puregon/hCG ca şi în tratamentul cu alte gonadotropine. Tratament la bărbaţi: Ocazional, în timpul tratamentului cu Puregon/hCG pot să apară ginecomastie şi acnee. Acestea sunt reacţii cunoscute ale terapiei cu hCG. La un subiect a fost observat un chist epididimal. 4.9 Supradozaj Nu sunt disponibile date despre toxicitatea acută a Puregon la om, dar în studiile la animale s-a arătat că toxicitatea acută a Puregon şi a preparatelor gonadotropinice urinare a fost foarte mică. O doză prea mare de FSH poate duce la hiperstimularea ovarelor (vezi pct 4.4). 5. PROPRIETĂŢI FARMACOLOGICE 5.1 Proprietăţi farmacodinamice Grupa farmacoterapeutică: gonadotropine, codul ATC: G03G A06. Puregon conţine FSH recombinat. Acesta este produs printr-o tehnologie de recombinare a ADN, folosind o linie celulară ovariană de hamster de China transfectată cu subunităţi genice de FSH uman. Secvenţa primară de aminoacizi este identică cu cea a FSH-ului uman natural. Se cunoaşte existenţa unor mici diferenţe în structura lanţului carbohidrat. FSH este indispensabil pentru creşterea şi maturarea foliculară normalăşi pentru producerea steroizilor gonadali. La femei, concentraţia de FSH este critică pentru iniţierea şi durata dezvoltării foliculare şi, în consecinţă, pentru cronologia şi numărul de foliculi care ajung la maturitate. Prin urmare, Puregon poate fi folosit pentru a stimula dezvoltarea folicularăşi producerea de steroizi în cazuri selecţionate de afectare a funcţiei gonadale. În plus, Puregon poate fi folosit pentru a provoca dezvoltarea foliculară multiplă în programele de reproducere asistată medical [de exemplu fertilizarea in vitro/transferul de embrion (FIV/TE), transfer intrafalopian de gameţi (GIFT) şi injectarea intracitoplasmatică de spermă (ICSI)]. Tratamentul cu Puregon este, în general, urmat de administrarea de hCG pentru a induce faza finală a maturării foliculare, reînceperea meiozei şi ruperea foliculului. La bărbaţii cu deficit de FSH, Puregon trebuie utilizat concomitent cu hCG timp de cel puţin patru luni, pentru inducerea spermatogenezei. 5.2 Proprietăţi farmacocinetice După administrare intramusculară sau subcutanată de Puregon, concentraţiile maxime de FSH sunt atinse în aproximativ 12 ore. După administrarea intramusculară de Puregon concentraţia FSH-ului este mai mare şi se atinge mai repede la bărbaţi comparativ cu femeile. Datorită eliberării lente de la locul injecţiei şi a unui timp de înjumătăţire de aproximativ 40 ore (cuprins între 12 şi 70 de ore), concentraţiile de FSH rămân crescute timp de 24-48 de ore. Datorită timpului de înjumătăţire relativ mare, administrarea repetată a aceleiaşi doze va duce la concentraţii plasmatice de FSH care sunt de aproximativ 1,5–2,5 ori mai mari faţă de cele atinse după administrarea unei singure doze. Această creştere permite atingerea concentraţiilor terapeutice de FSH. Nu există diferenţe farmacocinetice semnificative între administrarea intramuscularăşi cea subcutanată de Puregon. Ambele au o biodisponibilitate absolută de aproximativ 77%. FSH-ul recombinat este din punct de vedere biochimic foarte asemănător cu FSH-ul urinar uman şi este distribuit, metabolizat şi eliminat în acelaşi mod. 5.3 Date preclinice de siguranţă Administrarea unei doze unice de Puregon la şobolan nu a produs efecte semnificative toxicologic. În studii cu doze repetate la şobolan (două săptămâni) şi câine (13 săptămâni), de până la 100 de ori doza umană maximă, Puregon nu a produs efecte semnificative toxicologic. Puregon nu a demonstrat potenţial mutagen la testul Ames şi nici în in vitro la testul aberaţiilor cromozomiale cu limfocite umane. 6. PROPRIETĂŢI FARMACEUTICE 6.1 Lista excipienţilor Puregon soluţie injectabilă conţine: sucroză citrat de sodiu L-metionină polisorbat 20 apă pentru preparate injectabile. Este posibil ca pH-ul să fi fost ajustat cu hidroxid de sodiu şi/sau acid clorhidric. 6.2 Incompatibilităţi În absenţa studiilor privind compatibilitatea, acest medicament nu trebuie amestecat cu alte medicamente. 6.3 Perioada de valabilitate 3 ani. Conţinutul flaconului trebuie folosit imediat după perforarea dopului de cauciuc. 6.4 Precauţii speciale pentru păstrare A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine flaconul (flacoanele) în cutie. Pentru uşurinţă în utilizare, Puregon se poate păstra de către pacient la sau sub 25 °C pentru o singură perioadă de maximum de 3 luni. 6.5 Natura şi conţinutul ambalajului 0,5 ml soluţie în flacoane de 3 ml (sticlă tip I) cu dop (cauciuc clorobutilic). Cutie de 1, 5 sau 10. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. 6.6 Precauţii speciale pentru eliminarea reziduurilor şi alte instrucţiuni de manipulare Nu folosiţi dacă soluţia conţine particule sau nu este limpede. Conţinutul unei flacon trebuie folosit imediat după perforarea dopului de cauciuc. Orice produs neutilizat sau material rezidual trebuie eliminat în conformitate cu reglementările locale. 7. DEŢINĂTORUL AUTORIZAŢIEI DE PUNERE PE PIAŢĂ N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda 8. NUMĂRUL(ELE) AUTORIZAŢIEI DE PUNERE PE PIAŢĂEU/1/96/008/023 EU/1/96/008/024 EU/1/96/008/025 9. DATA PRIMEI AUTORIZĂRI SAU A REÎNNOIRII AUTORIZAŢIEI Data primei autorizări: 3 Mai 1996 Data ultimei reautorizări: 3 Mai 2006 10. DATA REVIZUIRII TEXTULUI 1. DENUMIREA COMERCIALĂ A MEDICAMENTULUI Puregon 225 UI/0,5 ml soluţie injectabilă 2. COMPOZIŢIA CALITATIVĂŞI CANTITATIVĂ Un flacon conţine 225 UI hormon foliculostimulant (FSH) recombinat în 0,5 ml soluţie apoasă. Aceasta corespunde unei concentraţii de 450 UI/ml. Un flacon conţine 22,5 micrograme de proteină (bioactivitate specifică in vivo egală cu aproximativ 10 000 UI FSH / mg proteină). Soluţia injectabilă conţine substanţa activă folitropină beta, produsă prin inginerie genetică pe culturi de celule ovariene (CHO) de hamster de China. Pentru lista tuturor excipienţilor, vezi pct. 6.1. 3. FORMA FARMACEUTICĂ Soluţie injectabilă. Soluţie limpede şi fără culoare. 4. DATE CLINICE 4.1 Indicaţii terapeutice La femei: Puregon este indicat pentru tratamentul infertilităţii la femei în următoarele situaţii clinice:
La bărbaţi: • Deficit de spermatogeneză datorat hipogonadismului hipogonadotropic. 4.2 Doze şi mod de administrare Tratamentul cu Puregon trebuie iniţiat sub supravegherea unui medic cu experienţă în tratamentul problemelor de fertilitate. Posologie Dozarea la femei Există mari variaţii inter-şi intra-individuale ale răspunsului ovarelor la gonadotropinele exogene. Acest lucru face imposibilă stabilirea unei scheme uniforme de dozare. De aceea, dozarea trebuie ajustată individual, în funcţie de răspunsul ovarian. Aceasta necesită ecografie şi monitorizarea concentraţiilor plasmatice de estradiol. Pe baza rezultatelor din studiile clinice comparative, se consideră adecvată administrarea unei doze mai mici de Puregon decât cea de FSH urinar folosită uzual, nu numai pentru a optimiza dezvoltarea foliculară, dar şi pentru a evita riscul unei hiperstimulări ovariene nedorite. Experienţa clinică cu Puregon se bazează pe maximum 3 cicluri de tratament pentru ambele indicaţii. Experienţa de până acum în FIV indică faptul că, în general, rata de succes a tratamentului rămâne stabilă pentru primele patru încercări şi apoi scade treptat.
Dozarea la bărbaţi Puregon trebuie administrat în doză de 450 UI/săptămână, preferabil fracţionat în 3 doze a 150 UI, concomitent cu hCG. Tratamentul trebuie continuat timp de cel puţin 3 – 4 luni înainte de a se aşteptaameliorarea spermatogenezei. În cazul în care, după această perioadă, pacientul nu a răspuns la tratament, se poate continua terapia combinată; experienţa clinică curentă indică faptul că pentru obtinerea spermatogenezei poate fi necesară continuarea acestui tratament până la 18 luni sau mai mult. Nu există nici o indicaţie relevantă pentru utilizarea Puregon la copii. Mod de administrare Pentru a preveni injecţiile dureroase şi pentru a reduce scurgerea de la locul injectării, Puregon trebuie administrat lent intramuscular sau subcutanat. Locul de injectare subcutanată trebuie alternat pentru a preveni lipoatrofia. Orice soluţie nefolosită trebuie aruncată. Injecţia subcutanată cu Puregon poate fi efectuată de către pacient sau de către partener, cu condiţia să primească instrucţiunile necesare de la medic. Autoadministrarea de Puregon trebuie efectuată numai de către pacienţi care sunt bine motivaţi, instruiţi adecvat şi care au acces la sfatul unui specialist. 4.3 Contraindicaţii
4.4 Atenţionări şi precauţii speciale pentru utilizare
4.5 Interacţiuni cu alte medicamente şi alte forme de interacţiune Folosirea concomitentă de Puregon şi clomifen citrat poate creşte răspunsul folicular. După desensibilizarea hipofizara indusă printr-un agonist GnRH, poate fi necesară o doză mai mare de Puregon pentru a obţine un răspuns folicular adecvat. 4.6 Sarcina şi alăptarea Nu există indicaţii pentru utilizarea Puregon în timpul sarcinii. Nu a fost raportat un risc teratogenic în utilizarea clinică a gonadotropinelor după hiperstimulare ovariană controlată. În caz de expunere în timpul sarcinii, datele clinice nu sunt suficiente pentru a exclude un efect teratogen al FSH recombinat. Totuşi, pînă în prezent nu a fost raportat nici un efect malformativ specific. Nu s-au observat efecte teratogene în studii pe animale. Puregon nu trebuie administrat în timpul alăptării. 4.7 Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilaje Puregon nu are nici o influenţă sau are influenţă neglijabilă asupra capacităţii de a conduce vehicule sau de a folosi utilaje. 4.8 Reacţii adverse Folosirea clinică de Puregon pe cale intramusculară sau subcutanată poate duce la reacţii locale la locul injectării: hematomul, durerea, roşeaţa, edemul local şi pruritul sunt frecvent raportate (3% din toţi pacienţii trataţi). Majoritatea acestor reacţii locale sunt uşoare şi trec de la sine. Reacţii de hipersensibilitate generalizate incluzând eritem, urticare, erupţie cutanatăşi prurit s-au observat foarte rar (0,1% din toţi pacienţii trataţi cu Puregon). Tratament la femei: La aproximativ 4% din femeile tratate cu Puregon în cadrul studiilor clinice, au fost raportate semne şi simptome în legătură cu sindromul de hiperstimulare ovariană (OHSS) (vezi pct. 4.4). Alte efecte nedorite asociate cu acest sindrom au fost observate în studii clinice. Acestea includ durere pelvină şi/sau congestie, durere abdominalăşi/sau distensie, acuze la nivelul sânului (sensibilitatea sânului, durere şi/sau tumefacţie), mărire ovariană, şi avort spontan. Toate acestea au fost raportate la o incidenţă de aproximativ 1% (durere pelvinăşi distensie abdominală) sau mai puţin. A fost observată o uşoară creştere a riscului de sarcină ectopicăşi de sarcini multiple. Celelalte simptome mai generale care au fost raportate includ cefaleea şi greaţa (până la 1% din femeile tratate cu Puregon). În cazuri rare, tromboemboliile au fost asociate cu tratamentul cu Puregon/hCG ca şi în tratamentul cu alte gonadotropine. Tratament la bărbaţi: Ocazional, în timpul tratamentului cu Puregon/hCG pot să apară ginecomastie şi acnee. Acestea sunt reacţii cunoscute ale terapiei cu hCG. La un subiect a fost observat un chist epididimal. 4.9 Supradozaj Nu sunt disponibile date despre toxicitatea acută a Puregon la om, dar în studiile la animale s-a arătat că toxicitatea acută a Puregon şi a preparatelor gonadotropinice urinare a fost foarte mică. O doză prea mare de FSH poate duce la hiperstimularea ovarelor (vezi pct 4.4). 5. PROPRIETĂŢI FARMACOLOGICE 5.1 Proprietăţi farmacodinamice Grupa farmacoterapeutică: gonadotropine, codul ATC: G03G A06. Puregon conţine FSH recombinat. Acesta este produs printr-o tehnologie de recombinare a ADN, folosind o linie celulară ovariană de hamster de China transfectată cu subunităţi genice de FSH uman. Secvenţa primară de aminoacizi este identică cu cea a FSH-ului uman natural. Se cunoaşte existenţa unor mici diferenţe în structura lanţului carbohidrat. FSH este indispensabil pentru creşterea şi maturarea foliculară normalăşi pentru producerea steroizilor gonadali. La femei, concentraţia de FSH este critică pentru iniţierea şi durata dezvoltării foliculare şi, în consecinţă, pentru cronologia şi numărul de foliculi care ajung la maturitate. Prin urmare, Puregon poate fi folosit pentru a stimula dezvoltarea folicularăşi producerea de steroizi în cazuri selecţionate de afectare a funcţiei gonadale. În plus, Puregon poate fi folosit pentru a provoca dezvoltarea foliculară multiplă în programele de reproducere asistată medical [de exemplu fertilizarea in vitro/transferul de embrion (FIV/TE), transfer intrafalopian de gameţi (GIFT) şi injectarea intracitoplasmatică de spermă (ICSI)]. Tratamentul cu Puregon este, în general, urmat de administrarea de hCG pentru a induce faza finală a maturării foliculare, reînceperea meiozei şi ruperea foliculului. La bărbaţii cu deficit de FSH, Puregon trebuie utilizat concomitent cu hCG timp de cel puţin patru luni, pentru inducerea spermatogenezei. 5.2 Proprietăţi farmacocinetice După administrare intramusculară sau subcutanată de Puregon, concentraţiile maxime de FSH sunt atinse în aproximativ 12 ore. După administrarea intramusculară de Puregon concentraţia FSH-ului este mai mare şi se atinge mai repede la bărbaţi comparativ cu femeile. Datorită eliberării lente de la locul injecţiei şi a unui timp de înjumătăţire de aproximativ 40 ore (cuprins între 12 şi 70 de ore), concentraţiile de FSH rămân crescute timp de 24-48 de ore. Datorită timpului de înjumătăţire relativ mare, administrarea repetată a aceleiaşi doze va duce la concentraţii plasmatice de FSH care sunt de aproximativ 1,5–2,5 ori mai mari faţă de cele atinse după administrarea unei singure doze. Această creştere permite atingerea concentraţiilor terapeutice de FSH. Nu există diferenţe farmacocinetice semnificative între administrarea intramuscularăşi cea subcutanată de Puregon. Ambele au o biodisponibilitate absolută de aproximativ 77%. FSH-ul recombinat este din punct de vedere biochimic foarte asemănător cu FSH-ul urinar uman şi este distribuit, metabolizat şi eliminat în acelaşi mod. 5.3 Date preclinice de siguranţă Administrarea unei doze unice de Puregon la şobolan nu a produs efecte semnificative toxicologic. În studii cu doze repetate la şobolan (două săptămâni) şi câine (13 săptămâni), de până la 100 de ori doza umană maximă, Puregon nu a produs efecte semnificative toxicologic. Puregon nu a demonstrat potenţial mutagen la testul Ames şi nici în in vitro la testul aberaţiilor cromozomiale cu limfocite umane. 6. PROPRIETĂŢI FARMACEUTICE 6.1 Lista excipienţilor Puregon soluţie injectabilă conţine: sucroză citrat de sodiu L-metionină polisorbat 20 apă pentru preparate injectabile. Este posibil ca pH-ul să fi fost ajustat cu hidroxid de sodiu şi/sau acid clorhidric. 6.2 Incompatibilităţi În absenţa studiilor privind compatibilitatea, acest medicament nu trebuie amestecat cu alte medicamente. 6.3 Perioada de valabilitate 3 ani. Conţinutul flaconului trebuie folosit imediat după perforarea dopului de cauciuc. 6.4 Precauţii speciale pentru păstrare A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine flaconul (flacoanele) în cutie. Pentru uşurinţă în utilizare, Puregon se poate păstra de către pacient la sau sub 25 °C pentru o singură perioadă de maximum de 3 luni. 6.5 Natura şi conţinutul ambalajului 0,5 ml soluţie în flacoane de 3 ml (sticlă tip I) cu dop (cauciuc clorobutilic). Cutie de 1, 5 sau 10. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. 6.6 Precauţii speciale pentru eliminarea reziduurilor şi alte instrucţiuni de manipulare Nu folosiţi dacă soluţia conţine particule sau nu este limpede. Conţinutul unei flacon trebuie folosit imediat după perforarea dopului de cauciuc. Orice produs neutilizat sau material rezidual trebuie eliminat în conformitate cu reglementările locale. 7. DEŢINĂTORUL AUTORIZAŢIEI DE PUNERE PE PIAŢĂ N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda 8. NUMĂRUL(ELE) AUTORIZAŢIEI DE PUNERE PE PIAŢĂEU/1/96/008/032 EU/1/96/008/033 EU/1/96/008/034 9. DATA PRIMEI AUTORIZĂRI SAU A REÎNNOIRII AUTORIZAŢIEI Data primei autorizări: 3 Mai 1996 Data ultimei reautorizări: 3 Mai 2006 10. DATA REVIZUIRII TEXTULUI
1. DENUMIREA COMERCIALĂ A MEDICAMENTULUI Puregon 150 UI/0.18 ml soluţie injectabilă 2. COMPOZIŢIA CALITATIVĂŞI CANTITATIVĂ Un cartuş conţine o doză totală netă de 150 UI hormon foliculostimulant (FSH) recombinat în 0.18 ml soluţie apoasă. Soluţia injectabilă conţine substanţa activă folitropină beta, produsă prin inginerie genetică pe culturi de celule ovariene de hamster de China (CHO), într-o concentraţie de 833 UI/ml în soluţie apoasă. Această concentraţie corespunde la 83.3 micrograme de proteină / ml (bioactivitate specifică in vivo egală cu aproximativ 10 000 UI FSH / mg proteină). Pentru lista tuturor excipienţilor, vezi pct. 6.1. 3. FORMA FARMACEUTICĂ Soluţie injectabilă. Soluţie limpede şi fără culoare. În cartuşe, realizate pentru a fi folosite împreună cu un injector stilou. 4. DATE CLINICE 4.1 Indicaţii terapeutice La femei: Puregon este indicat pentru tratamentul infertilităţii la femei în următoarele situaţii clinice:
La bărbaţi: • Deficit de spermatogeneză datorat hipogonadismului hipogonadotropic. 4.2 Doze şi mod de administrare Tratamentul cu Puregon trebuie iniţiat sub supravegherea unui medic cu experienţă în tratamentul problemelor de fertilitate. Posologie Dozarea la femei Există mari variaţii inter-şi intra-individuale ale răspunsului ovarelor la gonadotropinele exogene. Acest lucru face imposibilă stabilirea unei scheme uniforme de dozare. De aceea, dozarea trebuie ajustată individual, în funcţie de răspunsul ovarian. Aceasta necesită ecografie şi monitorizarea concentraţiilor plasmatice de estradiol. Cînd se foloseşte injectorul stilou trebuie să se realizeze că stiloul este un dispozitiv de precizie care furnizează cu acurateţe doza pentru care este setat. S-a arătat că în medie este dată de către stilou o cantitate cu 18 % mai mare de FSH comparativ cu o seringă convenţională. Aceasta poate avea importanţă în special cînd se face schimb între injectorul stilou şi o seringă convenţională în cadrul unui ciclu de tratament. În special cînd se schimbă de la seringă la stilou, pot fi necesare mici ajustări ale dozei pentru a preveni administrarea unei doze prea mari. Pe baza rezultatelor din studiile clinice comparative, se consideră adecvată administrarea unei doze mai mici de Puregon decât cea de FSH urinar folosită uzual, nu numai pentru a optimiza dezvoltarea foliculară, dar şi pentru a evita riscul unei hiperstimulări ovariene nedorite. Experienţa clinică cu Puregon se bazează pe maximum 3 cicluri de tratament pentru ambele indicaţii. Experienţa de până acum în FIV indică faptul că, în general, rata de succes a tratamentului rămâne stabilă pentru primele patru încercări şi apoi scade treptat.
Dozarea la bărbaţi Puregon trebuie administrat în doză de 450 UI/săptămână, preferabil fracţionat în 3 doze a 150 UI, concomitent cu hCG. Tratamentul trebuie continuat timp de cel puţin 3 – 4 luni înainte de a se aşteptaameliorarea spermatogenezei. În cazul în care, după această perioadă, pacientul nu a răspuns la tratament, se poate continua terapia combinată; experienţa clinică curentă indică faptul că pentru obtinerea spermatogenezei poate fi necesară continuarea acestui tratament până la 18 luni sau mai mult. Nu există nici o indicaţie relevantă pentru utilizarea Puregon la copii. Mod de administrare Puregon soluţie injectabilă în cartuşe a fost creat pentru a fi folosit în Puregon Pen, şi trebuie administrat subcutanat. Locul de injectare trebuie alternat pentru a preveni lipoatrofia. Utilizarea injectorului stilou Puregon poate fi efectuată de către pacientă, cu condiţia să primească instrucţiunile adecvate de la medic. 4.3 Contraindicaţii
4.4 Atenţionări şi precauţii speciale pentru utilizare
balanţă cu riscurile. Trebuie observat, totuşi, căşi sarcina în sine prezintă un risc crescut de tromboză.
4.5 Interacţiuni cu alte medicamente şi alte forme de interacţiune Folosirea concomitentă de Puregon şi clomifen citrat poate creşte răspunsul folicular. După desensibilizarea hipofizara indusă printr-un agonist GnRH, poate fi necesară o doză mai mare de Puregon pentru a obţine un răspuns folicular adecvat. 4.6 Sarcina şi alăptarea Nu există indicaţii pentru utilizarea Puregon în timpul sarcinii. Nu a fost raportat un risc teratogenic în utilizarea clinică a gonadotropinelor după hiperstimulare ovariană controlată. În caz de expunere în timpul sarcinii, datele clinice nu sunt suficiente pentru a exclude un efect teratogen al FSH recombinat. Totuşi, pînă în prezent nu a fost raportat nici un efect malformativ specific. Nu s-au observat efecte teratogene în studiile pe animale. Puregon nu trebuie administrat în timpul alăptării. 4.7 Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilaje Puregon nu are nici o influenţă sau are influenţă neglijabilă asupra capacităţii de a conduce vehicule sau de a folosi utilaje. 4.8 Reacţii adverse Folosirea clinică de Puregon pe cale intramusculară sau subcutanată poate duce la reacţii locale la locul injectării: hematomul, durerea, roşeaţa, edemul local şi pruritul sunt frecvent raportate (3% din toţi pacienţii trataţi). Majoritatea acestor reacţii locale sunt uşoare şi trec de la sine. Reacţii de hipersensibilitate generalizate incluzând eritem, urticare, erupţie cutanatăşi prurit s-au observat foarte rar (0,1% din toţi pacienţii trataţi cu Puregon). Tratament la femei: La aproximativ 4% din femeile tratate cu Puregon în cadrul studiilor clinice, au fost raportate semne şi simptome în legătură cu sindromul de hiperstimulare ovariană (OHSS) (vezi pct. 4.4). Alte efecte nedorite asociate cu acest sindrom au fost observate în studii clinice. Acestea includ durere pelvină şi/sau congestie, durere abdominalăşi/sau distensie, acuze la nivelul sânului (sensibilitatea sânului, durere şi/sau tumefacţie), mărire ovariană, şi avort spontan. Toate acestea au fost raportate la o incidenţă de aproximativ 1% (durere pelvinăşi distensie abdominală) sau mai puţin. A fost observată o uşoară creştere a riscului de sarcină ectopicăşi de sarcini multiple. Celelalte simptome mai generale care au fost raportate includ cefaleea şi greaţa (până la 1% din femeile tratate cu Puregon). În cazuri rare, tromboemboliile au fost asociate cu tratamentul cu Puregon/hCG ca şi în tratamentul cu alte gonadotropine. Tratament la bărbaţi: Ocazional, în timpul tratamentului cu Puregon/hCG pot să apară ginecomastie şi acnee. Acestea sunt reacţii cunoscute ale terapiei cu hCG. La un subiect a fost observat un chist epididimal. 4.9 Supradozaj Nu sunt disponibile date despre toxicitatea acută a Puregon la om, dar în studiile la animale s-a arătat că toxicitatea acută a Puregon şi a preparatelor gonadotropinice urinare a fost foarte mică. O doză prea mare de FSH poate duce la hiperstimularea ovarelor (vezi pct 4.4). 5. PROPRIETĂŢI FARMACOLOGICE 5.1 Proprietăţi farmacodinamice Grupa farmacoterapeutică: gonadotropine, codul ATC: G03G A06. Puregon conţine FSH recombinat. Acesta este produs printr-o tehnologie de recombinare a ADN, folosind o linie celulară ovariană de hamster de China transfectată cu subunităţi genice de FSH uman. Secvenţa primară de aminoacizi este identică cu cea a FSH-ului uman natural. Se cunoaşte existenţa unor mici diferenţe în structura lanţului carbohidrat. FSH este indispensabil pentru creşterea şi maturarea foliculară normalăşi pentru producerea steroizilor gonadali. La femei, concentraţia de FSH este critică pentru iniţierea şi durata dezvoltării foliculare şi, în consecinţă, pentru cronologia şi numărul de foliculi care ajung la maturitate. Prin urmare, Puregon poate fi folosit pentru a stimula dezvoltarea folicularăşi producerea de steroizi în cazuri selecţionate de afectare a funcţiei gonadale. În plus, Puregon poate fi folosit pentru a provoca dezvoltarea foliculară multiplă în programele de reproducere asistată medical [de exemplu fertilizarea in vitro/transferul de embrion (FIV/TE), transfer intrafalopian de gameţi (GIFT) şi injectarea intracitoplasmatică de spermă (ICSI)]. Tratamentul cu Puregon este, în general, urmat de administrarea de hCG pentru a induce faza finală a maturării foliculare, reînceperea meiozei şi ruperea foliculului. La bărbaţii cu deficit de FSH, Puregon trebuie utilizat concomitent cu hCG timp de cel puţin patru luni, pentru inducerea spermatogenezei. 5.2 Proprietăţi farmacocinetice După administrare subcutanată de Puregon, concentraţiile maxime de FSH sunt atinse în aproximativ 12 ore. Datorită eliberării lente de la locul injecţiei şi a unui timp de înjumătăţire de aproximativ 40 ore (cuprins între 12 şi 70 de ore), concentraţiile de FSH rămân crescute timp de 24-48 de ore. Datorită timpului de înjumătăţire relativ mare, administrarea repetată a aceleiaşi doze va duce la concentraţii plasmatice de FSH care sunt de aproximativ 1,5–2,5 ori mai mari faţă de cele atinse după administrarea unei singure doze. Această creştere permite atingerea concentraţiilor terapeutice de FSH. Biodisponibilitatea absolută la administrare subcutanată de Puregon este aproximativ 77%. FSH-ul recombinat este din punct de vedere biochimic foarte asemănător cu FSH-ul urinar uman şi este distribuit, metabolizat şi eliminat în acelaşi mod. 5.3 Date preclinice de siguranţă Administrarea unei doze unice de Puregon la şobolan nu a produs efecte semnificative toxicologic. În studii cu doze repetate la şobolan (două săptămâni) şi câine (13 săptămâni), de până la 100 de ori doza umană maximă, Puregon nu a produs efecte semnificative toxicologic. Puregon nu a demonstrat potenţial mutagen la testul Ames şi nici în in vitro la testul aberaţiilor cromozomiale cu limfocite umane. 6. PROPRIETĂŢI FARMACEUTICE 6.1 Lista excipienţilor Puregon 150 UI/0.18 ml soluţie injectabilă conţine: sucroză citrat de sodiu L-metionină polisorbat 20 alcool benzilic apă pentru preparate injectabile. Este posibil ca pH-ul să fi fost ajustat cu hidroxid de sodiu şi/sau acid clorhidric. 6.2 Incompatibilităţi În absenţa studiilor privind compatibilitatea, acest medicament nu trebuie amestecat cu alte medicamente. 6.3 Perioada de valabilitate 3 ani. După perforarea inserţiei de cauciuc a cartuşului cu un ac produsul poate fi păstrat pentru maximum 28 de zile. 6.4 Precauţii speciale pentru păstrare A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine cartuşul în cutie. Pentru uşurinţă în utilizare, Puregon se poate păstra de către pacient la sau sub 25 °C pentru o singură perioadă de maximum de 3 luni. 6.5 Natura şi conţinutul ambalajului 0.18 ml soluţie în cartuş de 1.5 ml (sticlă tip I) cu un piston din cauciuc gri şi un capac din aluminiu cu inserţie de cauciuc. Pachet cu un cartuşşi 3 ace pentru a fi folosit cu Puregon Pen. Cartuşele conţin minim 225 UI FSH-activitate în 0.270 ml soluţie apoasă, fiind suficient pentru o doză totală netă de 150 UI. 6.6 Precauţii speciale pentru eliminarea reziduurilor şi alte instrucţiuni de manipulare Nu folosiţi dacă soluţia conţine particule sau nu este limpede. Puregon 150 UI/0.18 ml soluţie injectabilă a fost creat pentru a fi folosit împreună cu Puregon Pen. Trebuie urmate cu atenţie instrucţiunile de utilizare a stiloului. Bulele de aer trebuie eliminate din cartuş înainte de injecţie ( vezi instrucţiunile de utilizare a stiloului). Cartuşele goale nu trebuiesc reumplute. Cartuşele Puregon nu sunt concepute pentru a permite amestecul cu oricare alte medicamente în cartuşe. Orice produs neutilizat sau material rezidual trebuie eliminat în conformitate cu reglementările locale. 7. DEŢINĂTORUL AUTORIZAŢIEI DE PUNERE PE PIAŢĂ N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda 8. NUMĂRUL AUTORIZAŢIEI DE PUNERE PE PIAŢĂEU/1/96/008/040 9. DATA PRIMEI AUTORIZĂRI SAU A REÎNNOIRII AUTORIZAŢIEI Data primei autorizări: 3 Mai 1996 Data ultimei reautorizări: 3 Mai 2006 10. DATA REVIZUIRII TEXTULUI ANEXA II A. PRODUCĂTORII SUBSTANŢEI BIOLOGIC ACTIVE ŞI DEŢINĂTORII AUTORIZAŢIEI DE FABRICAŢIE RESPONSABILI PENTRU ELIBERAREA SERIEI B. CONDIŢIILE EMITERII AUTORIZAŢIEI DE PUNERE PE PIAŢĂA. PRODUCĂTORII SUBSTANŢEI BIOLOGIC ACTIVE ŞI DEŢINĂTORII AUTORIZAŢIEI DE FABRICAŢIE RESPONSABILI PENTRU ELIBERAREA SERIEI Numele şi adresa producătorilor substanţei biologic active N.V. Organon, P.O. Box 20, 5340 BH Oss, Olanda. Biosearch Ireland, National Cell & Tissue Culture Centre, Glasnevin, Dublin 9, Irlanda. Numele şi adresa producătorilor responsabili pentru eliberarea seriei Puregon pulbere şi solvent pentru soluţie injectabilă 50 UI, 100 UI, 150 UI Puregon soluţie injectabilă în flacoane 50 UI/0,5 ml, 75 UI/0,5 ml, 100 UI/0,5 ml, 150 UI/0,5 ml, 200 UI/0,5 ml, 225 UI/0,5 ml, 250 UI/0,5 ml: N.V. Organon,
Organon S.A., Usine Saint-Charles, 60590 Eragny sur Epte, Franţa. Puregon pulbere şi solvent pentru soluţie injectabilă 75 UI: N.V. Organon, P.O. Box 20, 5340 BH Oss, Olanda. Puregon soluţie injectabilă în cartuşe 150 UI/0,18 ml, 300 UI/0,36 ml, 600 UI/0,72 ml, 900 UI/1.08 ml: N.V. Organon,
Organon S.A., Usine Saint-Charles, 60590 Eragny sur Epte, Franţa. Prospectul tipărit al medicamentului trebuie să menţioneze numele şi adresa producătorului responsabil pentru eliberarea seriei respective. B. CONDIŢIILE EMITERII AUTORIZAŢIEI DE PUNERE PE PIAŢĂ • CONDIŢII SAU RESTRICŢII PRIVIND FURNIZAREA ŞI UTILIZAREA IMPUSE DEŢINĂTORULUI AUTORIZAŢIEI DE PUNERE PE PIAŢĂ Medicament cu eliberare pe bază de prescripţie medicală restrictivă (Vezi Anexa I: Rezumatul caracteristicilor produsului, pct. 4.2) • CONDIŢII SAU RESTRICŢII CU PRIVIRE LA SIGURANŢA ŞI EFICACITATEA UTILIZĂRII MEDICAMENTULUI Nu este cazul. ANEXA III PROSPECTUL B. PROSPECTUL PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 50 pulbere şi solvent pentru soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon pulbere şi solvent pentru soluţie injectabilă conţine folitropină beta, un hormon cunoscut ca hormon foliculostimulant (FSH). FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare, luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FVI Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon are efect numai dacă este injectat într-un muşchi sau sub piele. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Pulberea uscată trebuie dizolvată cu solventul conţinut în fiola cu lichid iar această soluţie trebuie administrată imediat. Pentru a se evita injectarea unui volum mare, 3 sau 4 liosfere de Puregon pot fi dizolvate în 1 ml solvent. Daca sînt necesare doar 1 sau 2 liosfere volumul poate fi redus la 0,5 ml. Injecţiile trebuie făcute încet într-un muşchi (de exemplu în fesă, coapsă sau în braţ) sau imediat sub piele (de exemplu în peretele abdominal). Injecţiile în muşchi (intramusculare) trebuie făcute numai de un medic sau o asistentă medicală. În unele cazuri injecţiile sub piele (subcutanate) pot fi făcute de către dumneavoastră sau de partenerul dumneavoastră. Medicul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Instrucţiuni de folosire Etapa 1 – Prepararea seringii Puregon vine în 2 fiole de sticlă ale căror conţinuturi trebuie amestecate. Iniţial, rupeţi vârful fiolei cu soluţie de clorură de sodiu (a, b). Aspiraţi lichidul în seringă cu ajutorul acului (c). Apoi desfaceţi a doua fiolă care conţine sfera liofilizată (cu punctul negru în poziţia indicată în figurile a şi b) şi adăugaţi soluţia de clorură de sodiu din seringă (d). NU AGITAŢI, ci rotiţi uşor pînă cînd soluţia este limpede. În general Puregon se dizolvă imediat. Dacă soluţia conţine particule sau nu devine limpede nu o folosiţi,. Dacă aveţi nevoie să dizolvaţi mai mult de o sferă liofilizată, atunci repetaţi acţiunile descrise la punctele c şi d până când se dizolvă numărul necesar de sfere liofilizate. Vă rugăm să vă asiguraţi că toate operaţiile sunt făcute în aşa fel încît să se menţină condiţiile sterile în timpul procesului de dizolvare (de exemplu nu lăsaţi seringa jos fără a acoperi acul cu capacul protector). Aspiraţi soluţia de Puregon în seringa goală (e) şi acum înlocuiţi acul cu un ac steril pentru injecţie (f).În final ţineţi seringa cu acul îndreptat în sus şi loviţi uşor corpul seringii pentru ca bulele de aer să urce la suprafaţă; apoi apăsaţi pistonul pînă cînd tot aerul este scos şi rămîne în seringă numai soluţia Puregon (g) 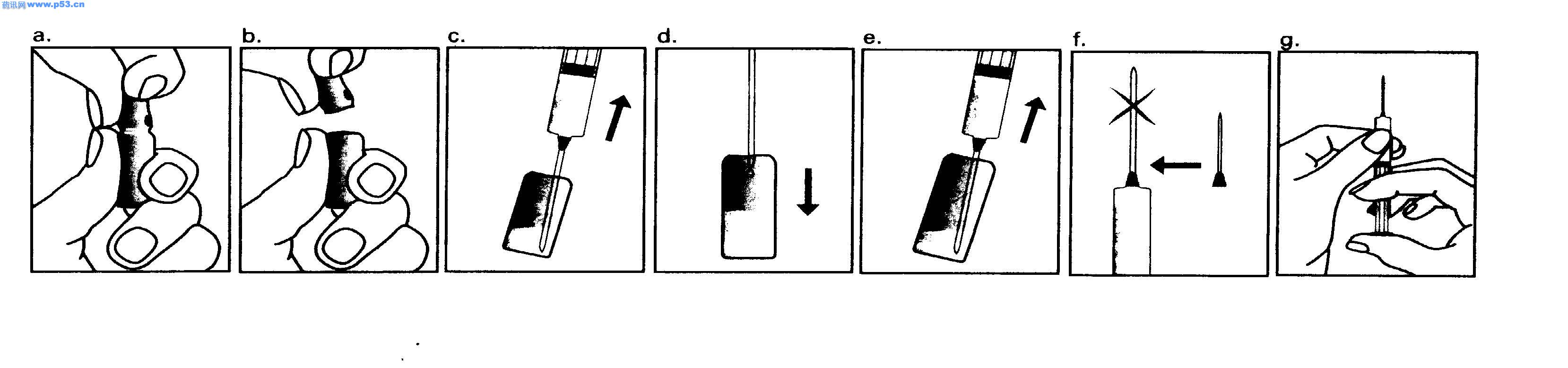
Etapa 2 – Locul injectării Cel mai bun loc pentru injecţia subcutanată este în abdomen în jurul buricului (h) unde există mai multă piele şi ţesut gras. Trebuie să schimbaţi puţin locul de injectare de fiecare dată. Este posibilă injectarea în alte locuri. Doctorul dumneavoastră sau asistenta medicală vă pot sfătui unde să faceţi injecţia. Etapa 3 – Pregătirea zonei Câteva bătăi uşoare la locul injecţiei vor stimula micile terminaţii nervoase şi vor reduce disconfortul din momentul introducerii acului. Mâinile trebuie să fie spălate şi locul de injectare trebuie dezinfectat (de exemplu cu clorhexidină 0,5%) pentru a îndepărta orice bacterie de pe suprafaţă. Dezinfectaţi locul pe aproximativ cinci centimetri în jurul locului de pătrundere a acului şi lăsaţi dezinfectantul să se usuce cel puţin un minut înainte de a continua. Etapa 4 – Introducerea acului Ciupiţi puţin pielea. Cu cealaltă mână, introduceţi acul la un unghi de 90 de grade cu suprafaţa pielii (i). 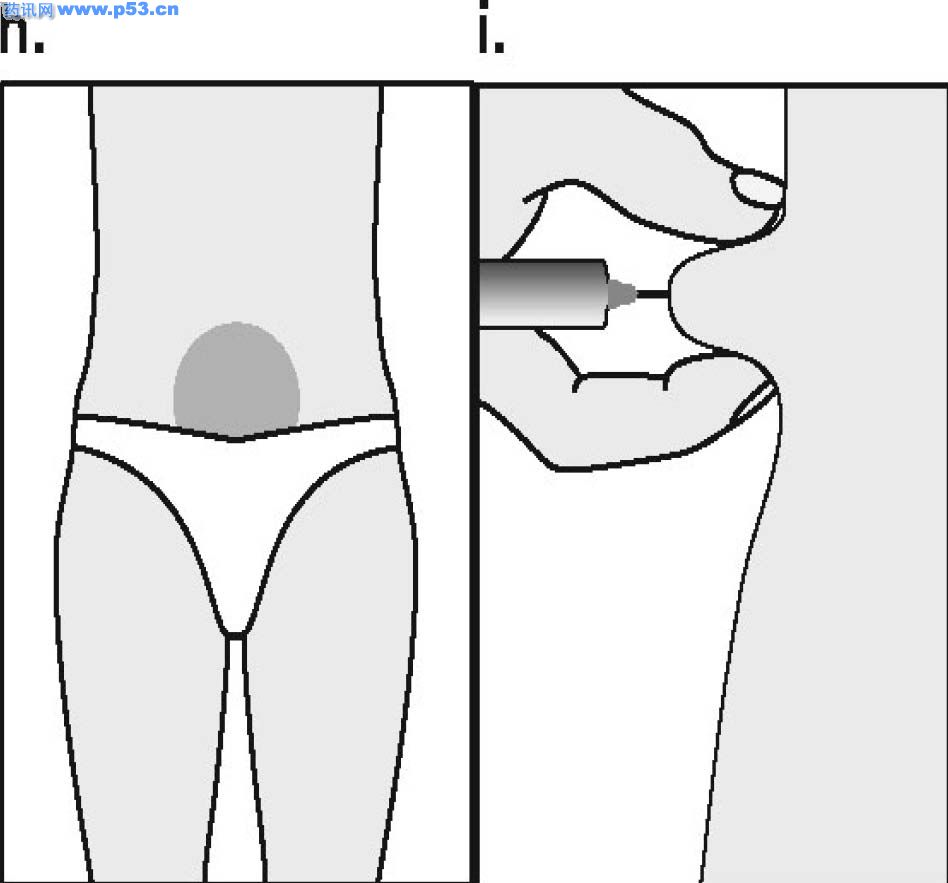
Etapa 5 – Verificarea poziţiei corecte a acului Dacă acul este corect poziţionat, pistonul se trage destul de greu înapoi. Orice cantitate de sânge trasă înapoi în seringă arată că vârful acului a pătruns într-o venă sau arteră. Dacă se întâmplă acest lucru, scoateţi seringa, acoperiţi locul injectării cu un tampon care conţine dezinfectant şi ţineţi apăsat; sângerarea se va opri după 1-2 minute. Nu mai folosiţi soluţia respectivă, aruncaţi-o. Trebuie atunci să începeţi din nou cu Etapa 1 folosind o nouă seringă, ace noi, şi noi fiole de Puregon şi soluţie de clorură de sodiu. Etapa 6 – Injectarea soluţiei Împingeţi pistonul încet şi constant astfel încât soluţia să fie injectată corect şi structura pielii să nu fie afectată. Etapa 7 – Îndepărtarea seringii Scoateţi seringa rapid şi ţineţi apăsat pe locul injectării cu un tampon cu dezinfectant. Un masaj uşor al locului – menţinând încă apăsarea – ajută la dispersarea soluţiei de Puregon şi la înlăturarea oricărui disconfort. Orice cantitate de soluţie nefolosită trebuie aruncată. Nu amestecaţi Puregon cu niciun alt medicament. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A nu se păstra la temperaturi peste 30°C. A nu se congela. A se ţine fiolele în cutie. După ce Puregon a fost dizolvat în solvent, soluţia trebuie folosită imediat. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6. INFORMAŢII SUPLIMENTARE Ce conţine Puregon
Cum arată Puregon şi conţinutul ambalajului Puregon 50 UI pulbere şi solvent pentru soluţie injectabilă (pulbere pentru injecţie) este un bulgăre sau pulbere albă sau aproape albăşi este furnizat într-o fiolă de sticlă. Trebuie dizolvat cu solventul (solvent pentru uz parenteral)-o soluţie limpede şi fără culoare- conţinut în a doua fiolă de sticlă. Este disponibil în cutii de 1, 3, 5 sau 10 fiole. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 75 UI pulbere şi solvent pentru soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon pulbere şi solvent pentru soluţie injectabilă conţine folitropină beta, un hormon cunoscut ca hormon foliculostimulant (FSH). FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FIV Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon are efect numai dacă este injectat într-un muşchi sau sub piele. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Pulberea uscată trebuie dizolvată cu solventul conţinut în fiola cu lichid iar această soluţie trebuie administrată imediat. Pentru a se evita injectarea unui volum mare 3 sau 4 bulgări de Puregon pot fi dizolvaţi în 1 ml solvent. Daca sînt necesari doar 1 sau 2 bulgări volumul poate fi redus la 0,5 ml. Injecţiile trebuie făcute încet într-un muşchi (de exemplu în fesă, coapsă sau în braţ) sau imediat sub piele (de exemplu în peretele abdominal). Injecţiile în muşchi (intramusculare) trebuie făcute numai de un medic sau o asistentă medicală. În unele cazuri injecţiile sub piele (subcutanate) pot fi făcute de către dumneavoastră sau de partenerul dumneavoastră. Medicul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Instrucţiuni de folosire Etapa 1 – Prepararea seringii Puregon vine într-un flacon de sticlă al cărui conţinut trebuie amestecat cu solventul din fiola de sticlă. Iniţial, rupeţi vârful fiolei cu soluţie de clorură de sodiu (a, b). Aspiraţi lichidul în seringă cu ajutorulacului (c). Îndepărtaţi capacul flip-off al flaconului de Puregon şi injectaţi soluţia de clorură de sodiu din seringă prin dopul de cauciuc în flaconul care conţine bulgărele liofilizat (d). NU AGITAŢI, ci rotiţi uşor pînă cînd soluţia este limpede. În general Puregon se dizolvă imediat. Dacă soluţia conţine particule sau nu devine limpede nu o folosiţi. Dacă aveţi nevoie să dizolvaţi mai mult de un bulgăre liofilizat, atunci repetaţi acţiunile descrise la punctele c şi d până când se dizolvă numărul necesar de bulgări liofilizaţi. Vă rugăm să vă asiguraţi că toate operaţiile sunt făcute în aşa fel încît să se menţină condiţiile sterile în timpul procesului de dizolvare (de exemplu nu lăsaţi seringa jos fără a acoperi acul cu capacul protector). Aspiraţi soluţia de Puregon în seringa goală (e) şi acum înlocuiţi acul cu un ac steril pentru injecţie (f).În final ţineţi seringa cu acul îndreptat în sus şi loviţi uşor corpul seringii pentru ca bulele de aer să urce la suprafaţă; apoi apăsaţi pistonul pînă cînd tot aerul este scos şi rămîne în seringă numai soluţia Puregon (g) 
Etapa 2 – Locul injectării Cel mai bun loc pentru injecţia subcutanată este în abdomen în jurul buricului (h) unde există mai multă piele şi ţesut gras. Trebuie să schimbaţi puţin locul de injectare de fiecare dată. Este posibilă injectarea în alte locuri. Doctorul dumneavoastră sau asistenta medicală vă pot sfătui unde să faceţi injecţia. Etapa 3 – Pregătirea zonei Câteva bătăi uşoare la locul injecţiei vor stimula micile terminaţii nervoase şi vor reduce disconfortul din momentul introducerii acului. Mâinile trebuie să fie spălate şi locul de injectare trebuie dezinfectat (de exemplu cu clorhexidină 0,5%) pentru a îndepărta orice bacterie de pe suprafaţă. Dezinfectaţi locul pe aproximativ cinci centimetri în jurul locului de pătrundere a acului şi lăsaţi dezinfectantul să se usuce cel puţin un minut înainte de a continua. Etapa 4 – Introducerea acului Ciupiţi puţin pielea. Cu cealaltă mână, introduceţi acul la un unghi de 90 de grade cu suprafaţa pielii (i). 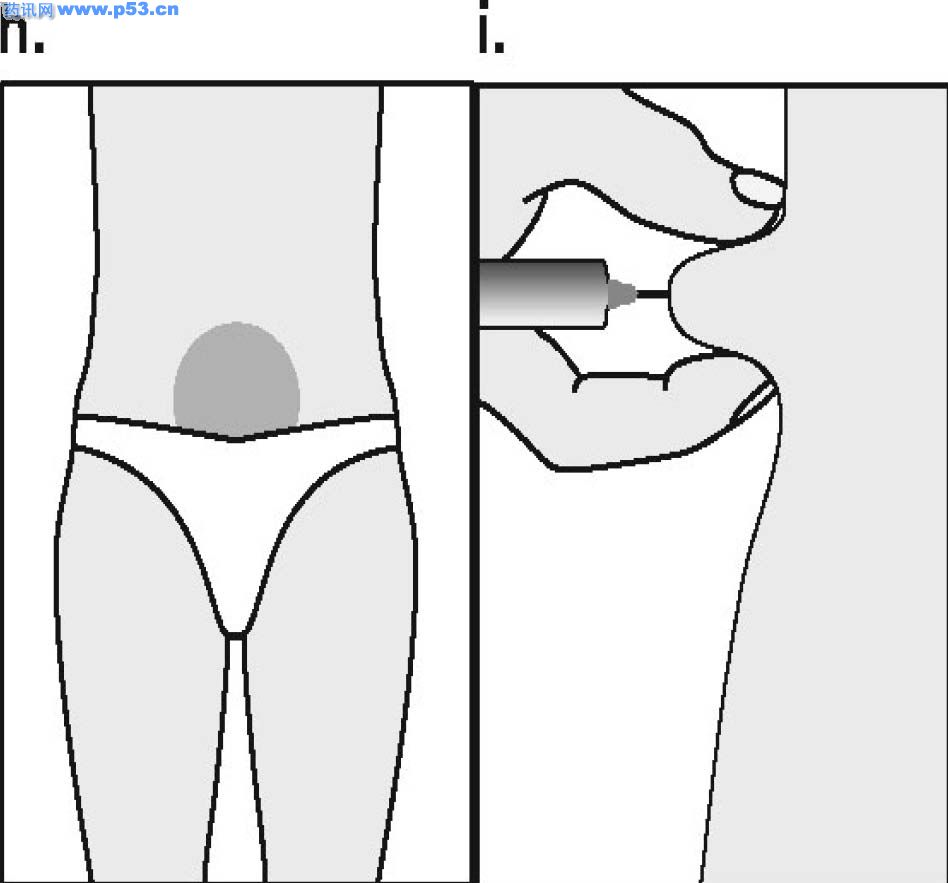
Etapa 5 – Verificarea poziţiei corecte a acului Dacă acul este corect poziţionat, pistonul se trage destul de greu înapoi. Orice cantitate de sânge trasă înapoi în seringă arată că vârful acului a pătruns într-o venă sau arteră. Dacă se întâmplă acest lucru, scoateţi seringa, acoperiţi locul injectării cu un tampon care conţine dezinfectant şi ţineţi apăsat; sângerarea se va opri după 1-2 minute. Nu mai folosiţi soluţia respectivă, aruncaţi-o. Trebuie atunci să începeţi din nou cu Etapa 1 folosind o nouă seringă, ace noi, şi noi flacoane de Puregon şi fiole de soluţie de clorură de sodiu. Etapa 6 – Injectarea soluţiei Împingeţi pistonul încet şi constant astfel încât soluţia să fie injectată corect şi structura pielii să nu fie afectată. Etapa 7 – Îndepărtarea seringii Scoateţi seringa rapid şi ţineţi apăsat pe locul injectării cu un tampon cu dezinfectant. Un masaj uşor al locului – menţinând încă apăsarea – ajută la dispersarea soluţiei de Puregon şi la înlăturarea oricărui disconfort. Orice cantitate de soluţie nefolosită trebuie aruncată. Nu amestecaţi Puregon cu niciun alt medicament. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A nu se păstra la temperaturi peste 30°C. A nu se congela. A se ţine flaconul (flacoanele) şi fiola (fiolele) în cutie. După ce Puregon a fost dizolvat în solvent, soluţia trebuie folosită imediat. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6. INFORMAŢII SUPLIMENTARE Ce conţine Puregon
Cum arată Puregon şi conţinutul ambalajului Puregon 75 UI pulbere şi solvent pentru soluţie injectabilă (pulbere pentru injecţie) este un bulgăre sau pulbere albă sau aproape albăşi este furnizat într-un flacon de sticlă. Trebuie dizolvat cu solventul (solvent pentru uz parenteral)-o soluţie limpede şi fără culoare- conţinut în fiola de sticlă. Este disponibil în cutii de 1, 3, 5 sau 10 fiole. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 100 pulbere şi solvent pentru soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon pulbere şi solvent pentru soluţie injectabilă conţine folitropină beta, un hormon cunoscut ca hormon foliculostimulant (FSH). FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare, luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FVI Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon are efect numai dacă este injectat într-un muşchi sau sub piele. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Pulberea uscată trebuie dizolvată cu solventul conţinut în fiola cu lichid iar această soluţie trebuie administrată imediat. Pentru a se evita injectarea unui volum mare, 3 sau 4 liosfere de Puregon pot fi dizolvate în 1 ml solvent. Daca sînt necesare doar 1 sau 2 liosfere volumul poate fi redus la 0,5 ml. Injecţiile trebuie făcute încet într-un muşchi (de exemplu în fesă, coapsă sau în braţ) sau imediat sub piele (de exemplu în peretele abdominal). Injecţiile în muşchi (intramusculare) trebuie făcute numai de un medic sau o asistentă medicală. În unele cazuri injecţiile sub piele (subcutanate) pot fi făcute de către dumneavoastră sau de partenerul dumneavoastră. Medicul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Instrucţiuni de folosire Etapa 1 – Prepararea seringii Puregon vine în 2 fiole de sticlă ale căror conţinuturi trebuie amestecate. Iniţial, rupeţi vârful fiolei cu soluţie de clorură de sodiu (a, b). Aspiraţi lichidul în seringă cu ajutorul acului (c). Apoi desfaceţi a doua fiolă care conţine sfera liofilizată (cu punctul negru în poziţia indicată în figurile a şi b) şi adăugaţi soluţia de clorură de sodiu din seringă (d). NU AGITAŢI, ci rotiţi uşor pînă cînd soluţia este limpede. În general Puregon se dizolvă imediat. Dacă soluţia conţine particule sau nu devine limpede nu o folosiţi,. Dacă aveţi nevoie să dizolvaţi mai mult de o sferă liofilizată, atunci repetaţi acţiunile descrise la punctele c şi d până când se dizolvă numărul necesar de sfere liofilizate. Vă rugăm să vă asiguraţi că toate operaţiile sunt făcute în aşa fel încît să se menţină condiţiile sterile în timpul procesului de dizolvare (de exemplu nu lăsaţi seringa jos fără a acoperi acul cu capacul protector). Aspiraţi soluţia de Puregon în seringa goală (e) şi acum înlocuiţi acul cu un ac steril pentru injecţie (f).În final ţineţi seringa cu acul îndreptat în sus şi loviţi uşor corpul seringii pentru ca bulele de aer să urce la suprafaţă; apoi apăsaţi pistonul pînă cînd tot aerul este scos şi rămîne în seringă numai soluţia Puregon (g) 
Etapa 2 – Locul injectării Cel mai bun loc pentru injecţia subcutanată este în abdomen în jurul buricului (h) unde există mai multă piele şi ţesut gras. Trebuie să schimbaţi puţin locul de injectare de fiecare dată. Este posibilă injectarea în alte locuri. Doctorul dumneavoastră sau asistenta medicală vă pot sfătui unde să faceţi injecţia. Etapa 3 – Pregătirea zonei Câteva bătăi uşoare la locul injecţiei vor stimula micile terminaţii nervoase şi vor reduce disconfortul din momentul introducerii acului. Mâinile trebuie să fie spălate şi locul de injectare trebuie dezinfectat (de exemplu cu clorhexidină 0,5%) pentru a îndepărta orice bacterie de pe suprafaţă. Dezinfectaţi locul pe aproximativ cinci centimetri în jurul locului de pătrundere a acului şi lăsaţi dezinfectantul să se usuce cel puţin un minut înainte de a continua. Etapa 4 – Introducerea acului Ciupiţi puţin pielea. Cu cealaltă mână, introduceţi acul la un unghi de 90 de grade cu suprafaţa pielii (i). 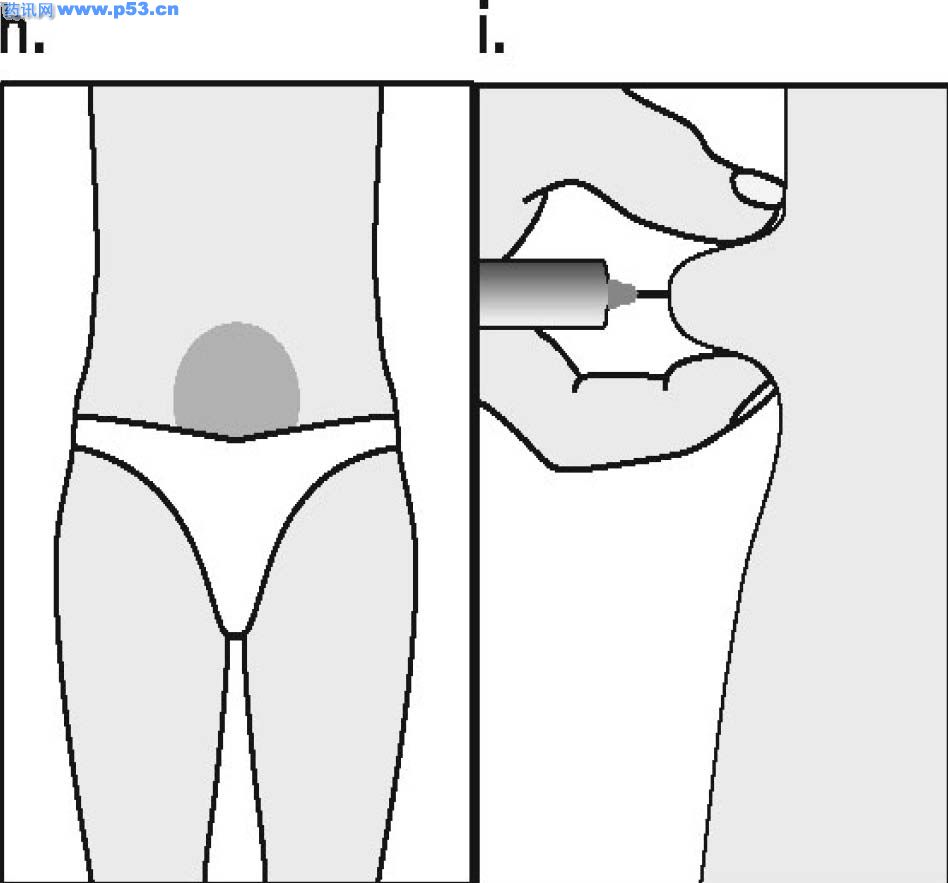
Etapa 5 – Verificarea poziţiei corecte a acului Dacă acul este corect poziţionat, pistonul se trage destul de greu înapoi. Orice cantitate de sânge trasă înapoi în seringă arată că vârful acului a pătruns într-o venă sau arteră. Dacă se întâmplă acest lucru, scoateţi seringa, acoperiţi locul injectării cu un tampon care conţine dezinfectant şi ţineţi apăsat; sângerarea se va opri după 1-2 minute. Nu mai folosiţi soluţia respectivă, aruncaţi-o. Trebuie atunci să începeţi din nou cu Etapa 1 folosind o nouă seringă, ace noi, şi noi fiole de Puregon şi soluţie de clorură de sodiu. Etapa 6 – Injectarea soluţiei Împingeţi pistonul încet şi constant astfel încât soluţia să fie injectată corect şi structura pielii să nu fie afectată. Etapa 7 – Îndepărtarea seringii Scoateţi seringa rapid şi ţineţi apăsat pe locul injectării cu un tampon cu dezinfectant. Un masaj uşor al locului – menţinând încă apăsarea – ajută la dispersarea soluţiei de Puregon şi la înlăturarea oricărui disconfort. Orice cantitate de soluţie nefolosită trebuie aruncată. Nu amestecaţi Puregon cu niciun alt medicament. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A nu se păstra la temperaturi peste 30°C. A nu se congela. A se ţine fiolele în cutie. După ce Puregon a fost dizolvat în solvent, soluţia trebuie folosită imediat. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6. INFORMAŢII SUPLIMENTARE Ce conţine Puregon
Cum arată Puregon şi conţinutul ambalajului Puregon 100 UI pulbere şi solvent pentru soluţie injectabilă (pulbere pentru injecţie) este un bulgăre sau pulbere albă sau aproape albăşi este furnizat într-o fiolă de sticlă. Trebuie dizolvat cu solventul (solvent pentru uz parenteral)-o soluţie limpede şi fără culoare- conţinut în a doua fiolă de sticlă. Este disponibil în cutii de 1, 3, 5 sau 10 fiole. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 150 pulbere şi solvent pentru soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon pulbere şi solvent pentru soluţie injectabilă conţine folitropină beta, un hormon cunoscut ca hormon foliculostimulant (FSH). FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare, luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FVI Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon are efect numai dacă este injectat într-un muşchi sau sub piele. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Pulberea uscată trebuie dizolvată cu solventul conţinut în fiola cu lichid iar această soluţie trebuie administrată imediat. Pentru a se evita injectarea unui volum mare, 3 sau 4 liosfere de Puregon pot fi dizolvate în 1 ml solvent. Daca sînt necesare doar 1 sau 2 liosfere volumul poate fi redus la 0,5 ml. Injecţiile trebuie făcute încet într-un muşchi (de exemplu în fesă, coapsă sau în braţ) sau imediat sub piele (de exemplu în peretele abdominal). Injecţiile în muşchi (intramusculare) trebuie făcute numai de un medic sau o asistentă medicală. În unele cazuri injecţiile sub piele (subcutanate) pot fi făcute de către dumneavoastră sau de partenerul dumneavoastră. Medicul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Instrucţiuni de folosire Etapa 1 – Prepararea seringii Puregon vine în 2 fiole de sticlă ale căror conţinuturi trebuie amestecate. Iniţial, rupeţi vârful fiolei cu soluţie de clorură de sodiu (a, b). Aspiraţi lichidul în seringă cu ajutorul acului (c). Apoi desfaceţi a doua fiolă care conţine sfera liofilizată (cu punctul negru în poziţia indicată în figurile a şi b) şi adăugaţi soluţia de clorură de sodiu din seringă (d). NU AGITAŢI, ci rotiţi uşor pînă cînd soluţia este limpede. În general Puregon se dizolvă imediat. Dacă soluţia conţine particule sau nu devine limpede nu o folosiţi,. Dacă aveţi nevoie să dizolvaţi mai mult de o sferă liofilizată, atunci repetaţi acţiunile descrise la punctele c şi d până când se dizolvă numărul necesar de sfere liofilizate. Vă rugăm să vă asiguraţi că toate operaţiile sunt făcute în aşa fel încît să se menţină condiţiile sterile în timpul procesului de dizolvare (de exemplu nu lăsaţi seringa jos fără a acoperi acul cu capacul protector). Aspiraţi soluţia de Puregon în seringa goală (e) şi acum înlocuiţi acul cu un ac steril pentru injecţie (f).În final ţineţi seringa cu acul îndreptat în sus şi loviţi uşor corpul seringii pentru ca bulele de aer să urce la suprafaţă; apoi apăsaţi pistonul pînă cînd tot aerul este scos şi rămîne în seringă numai soluţia Puregon (g) 
Etapa 2 – Locul injectării Cel mai bun loc pentru injecţia subcutanată este în abdomen în jurul buricului (h) unde există mai multă piele şi ţesut gras. Trebuie să schimbaţi puţin locul de injectare de fiecare dată. Este posibilă injectarea în alte locuri. Doctorul dumneavoastră sau asistenta medicală vă pot sfătui unde să faceţi injecţia. Etapa 3 – Pregătirea zonei Câteva bătăi uşoare la locul injecţiei vor stimula micile terminaţii nervoase şi vor reduce disconfortul din momentul introducerii acului. Mâinile trebuie să fie spălate şi locul de injectare trebuie dezinfectat (de exemplu cu clorhexidină 0,5%) pentru a îndepărta orice bacterie de pe suprafaţă. Dezinfectaţi locul pe aproximativ cinci centimetri în jurul locului de pătrundere a acului şi lăsaţi dezinfectantul să se usuce cel puţin un minut înainte de a continua. Etapa 4 – Introducerea acului Ciupiţi puţin pielea. Cu cealaltă mână, introduceţi acul la un unghi de 90 de grade cu suprafaţa pielii (i). 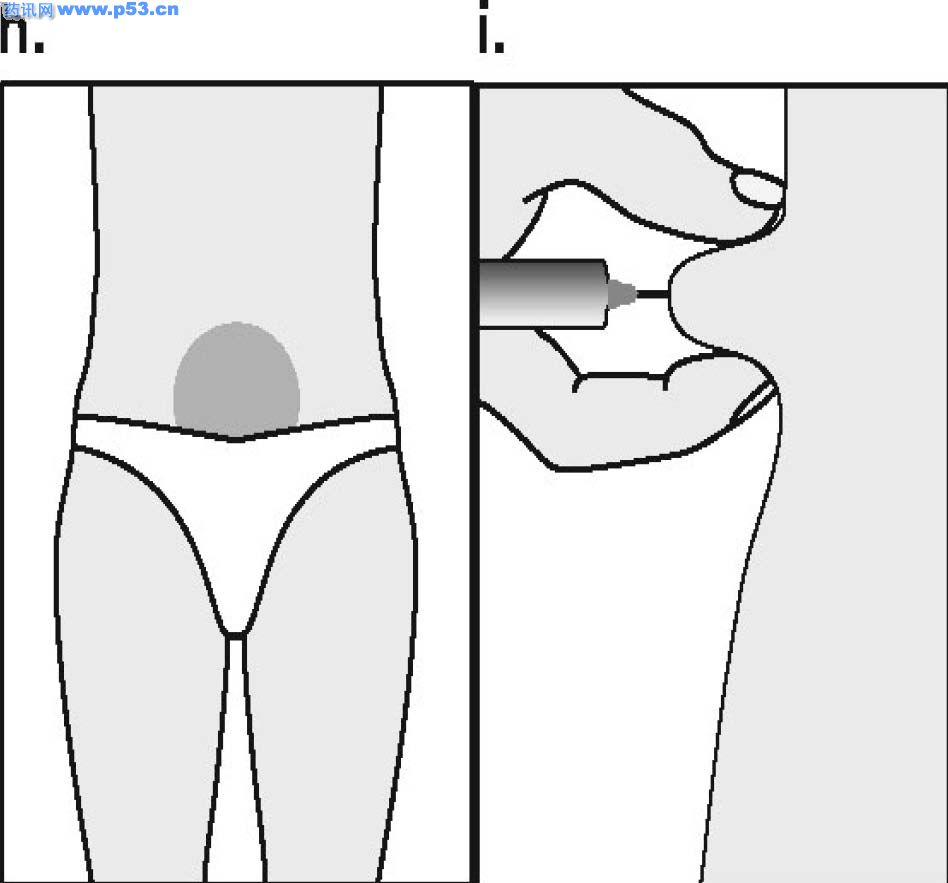
Etapa 5 – Verificarea poziţiei corecte a acului Dacă acul este corect poziţionat, pistonul se trage destul de greu înapoi. Orice cantitate de sânge trasă înapoi în seringă arată că vârful acului a pătruns într-o venă sau arteră. Dacă se întâmplă acest lucru, scoateţi seringa, acoperiţi locul injectării cu un tampon care conţine dezinfectant şi ţineţi apăsat; sângerarea se va opri după 1-2 minute. Nu mai folosiţi soluţia respectivă, aruncaţi-o. Trebuie atunci să începeţi din nou cu Etapa 1 folosind o nouă seringă, ace noi, şi noi fiole de Puregon şi soluţie de clorură de sodiu. Etapa 6 – Injectarea soluţiei Împingeţi pistonul încet şi constant astfel încât soluţia să fie injectată corect şi structura pielii să nu fie afectată. Etapa 7 – Îndepărtarea seringii Scoateţi seringa rapid şi ţineţi apăsat pe locul injectării cu un tampon cu dezinfectant. Un masaj uşor al locului – menţinând încă apăsarea – ajută la dispersarea soluţiei de Puregon şi la înlăturarea oricărui disconfort. Orice cantitate de soluţie nefolosită trebuie aruncată. Nu amestecaţi Puregon cu niciun alt medicament. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A nu se păstra la temperaturi peste 30°C. A nu se congela. A se ţine fiolele în cutie. După ce Puregon a fost dizolvat în solvent, soluţia trebuie folosită imediat. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6. INFORMAŢII SUPLIMENTARE Ce conţine Puregon
Cum arată Puregon şi conţinutul ambalajului Puregon 150 UI pulbere şi solvent pentru soluţie injectabilă (pulbere pentru injecţie) este un bulgăre sau pulbere albă sau aproape albăşi este furnizat într-o fiolă de sticlă. Trebuie dizolvat cu solventul (solvent pentru uz parenteral)-o soluţie limpede şi fără culoare- conţinut în a doua fiolă de sticlă. Este disponibil în cutii de 1, 3, 5 sau 10 fiole. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 50UI/0,5 ml soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon soluţie injectabilă conţine folitropină beta, un hormon cunoscut ca hormon foliculostimulant (FSH). FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FIV Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon are efect numai dacă este injectat într-un muşchi sau sub piele. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Injecţiile trebuie făcute încet în muşchi (de exemplu în fesă, coapsă sau în braţ) sau imediat sub piele (de exemplu în peretele abdominal). Injecţiile în muşchi (intramusculare) trebuie făcute numai de un medic sau o asistentă medicală. În unele cazuri injecţiile sub piele (subcutanate) pot fi făcute de către dumneavoastră sau de partenerul dumneavoastră. Medicul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Instrucţiuni de folosire Etapa 1 – Prepararea seringii Pentru administrarea de Puregon trebuie utilizate seringi şi ace sterile de unică folosinţă. Volumul seringii trebuie să fie suficient de mic pentru ca doza prescrisă să fie administrată cu o precizie rezonabilă. Puregon soluţie injectabilă este disponibil în flacoane de sticlă. Nu folosiţi dacă soluţia conţine particule sau nu este limpede. Întâi scoateţi capacul flip-off al flaconului. Montaţi acul la seringăşi perforaţi cu acul dopul de cauciuc al flaconului (a). Aspiraţi soluţia în seringă (b) şi înlocuiţi acul cu un ac pentru injecţie (c). În final ţineţi seringa cu acul îndreptat în sus şi loviţi uşor corpul seringii pentru ca bulele de aer să urce la suprafaţă; apoi apăsaţi pistonul până când tot aerul este scos şi rămâne în seringă numai soluţia Puregon (d). Dacă este nevoie, pistonul poate fi apăsat şi mai mult pentru a ajusta volumul care va fi administrat. 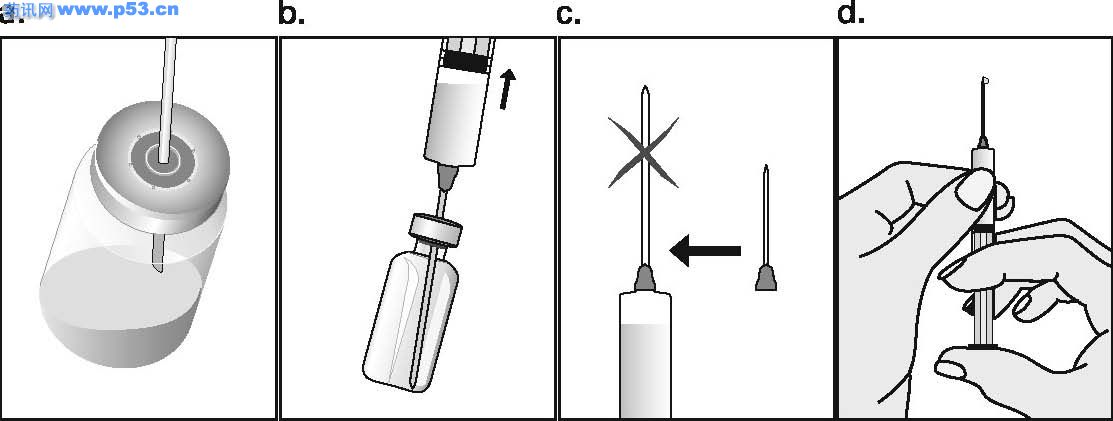
Etapa 2 – Locul injectării Cel mai bun loc pentru injecţia subcutanată este în abdomen în jurul buricului (e) acolo unde există mai multă piele şi ţesut gras. Trebuie să schimbaţi puţin locul de injectare de fiecare dată. Este posibilă injectarea în alte locuri. Doctorul dumneavoastră sau asistenta medicală vă pot sfătui unde să faceţi injecţia. Etapa 3 – Pregătirea zonei Câteva bătăi uşoare la locul injecţiei vor stimula micile terminaţii nervoase şi vor reduce disconfortul din momentul introducerii acului. Mâinile trebuie să fie spălate şi locul de injectare trebuie dezinfectat (de exemplu cu clorhexidină 0,5%) pentru a îndepărta orice bacterie de pe suprafaţă. Dezinfectaţi locul pe aproximativ cinci centimetri în jurul locului de pătrundere a acului şi lăsaţi dezinfectantul să se usuce cel puţin un minut înainte de a continua. Etapa 4 – Introducerea acului Ciupiţi puţin pielea. Cu cealaltă mână introduceţi acul la un unghi de 90 de grade cu suprafaţa pielii (f). 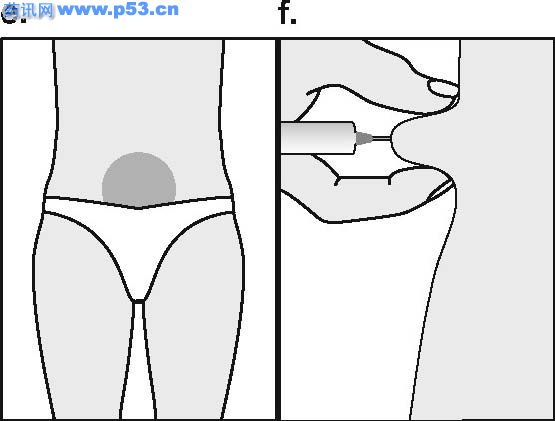
Etapa 5 – Verificarea poziţiei corecte a acului Dacă acul este corect poziţionat, pistonul se trage destul de greu înapoi. Orice cantitate de sânge trasă înapoi în seringă arată că vârful acului a pătruns într-o venă sau arteră. Dacă se întâmplă acest lucru, scoateţi seringa, acoperiţi locul injectării cu un tampon care conţine dezinfectant şi ţineţi apăsat; sângerarea se va opri după 1-2 minute. Nu mai folosiţi soluţia respectivă, aruncaţi-o. Trebuie să reîncepeţi cu Etapa 1 folosind un ac şi o seringă noi şi un nou flacon de Puregon. Etapa 6 – Injectarea soluţiei Împingeţi pistonul încet şi constant astfel încât soluţia să fie injectată corect şi structura pielii să nu fie afectată. Etapa 7 – Îndepărtarea seringii Scoateţi seringa rapid şi ţineţi apăsat pe locul injectării cu un tampon cu dezinfectant. Un masaj uşor al locului – menţinând încă apăsarea – ajută la dispersarea soluţiei de Puregon şi la înlăturarea oricărui disconfort. Orice cantitate de soluţie nefolosită trebuie aruncată. Nu amestecaţi Puregon cu niciun alt medicament. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine flaconul (flacoanele) în cutie. Pentru uşurinţă în utilizare se poate păstra Puregon la sau sub 25°C (la temperatura camerei), pentru o singură perioadă de maximum 3 luni. Notaţi momentul de când începeţi să păstraţi produsul în afara frigiderului. Conţinutul unui flacon trebuie folosit imediat după perforarea dopului de cauciuc. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6. INFORMAŢII SUPLIMENTARE Ce conţine Puregon
Cum arată Puregon şi conţinutul ambalajului Puregon soluţie injectabilă este o soluţie limpede şi incoloră. Este furnizat în flacon de sticlă. Este disponibil în cutii de 1, 5 sau 10 flacoane. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 75 UI/0,5 ml soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon soluţie injectabilă conţine folitropină beta, un hormon cunoscut ca hormon foliculostimulant (FSH). FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FIV Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon are efect numai dacă este injectat într-un muşchi sau sub piele. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Injecţiile trebuie făcute încet în muşchi (de exemplu în fesă, coapsă sau în braţ) sau imediat sub piele (de exemplu în peretele abdominal). Injecţiile în muşchi (intramusculare) trebuie făcute numai de un medic sau o asistentă medicală. În unele cazuri injecţiile sub piele (subcutanate) pot fi făcute de către dumneavoastră sau de partenerul dumneavoastră. Medicul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Instrucţiuni de folosire Etapa 1 – Prepararea seringii Pentru administrarea de Puregon trebuie utilizate seringi şi ace sterile de unică folosinţă. Volumul seringii trebuie să fie suficient de mic pentru ca doza prescrisă să fie administrată cu o precizie rezonabilă. Puregon soluţie injectabilă este disponibil în flacoane de sticlă. Nu folosiţi dacă soluţia conţine particule sau nu este limpede. Întâi scoateţi capacul flip-off al flaconului. Montaţi acul la seringăşi perforaţi cu acul dopul de cauciuc al flaconului (a). Aspiraţi soluţia în seringă (b) şi înlocuiţi acul cu un ac pentru injecţie (c). În final ţineţi seringa cu acul îndreptat în sus şi loviţi uşor corpul seringii pentru ca bulele de aer să urce la suprafaţă; apoi apăsaţi pistonul până când tot aerul este scos şi rămâne în seringă numai soluţia Puregon (d). Dacă este nevoie, pistonul poate fi apăsat şi mai mult pentru a ajusta volumul care va fi administrat. 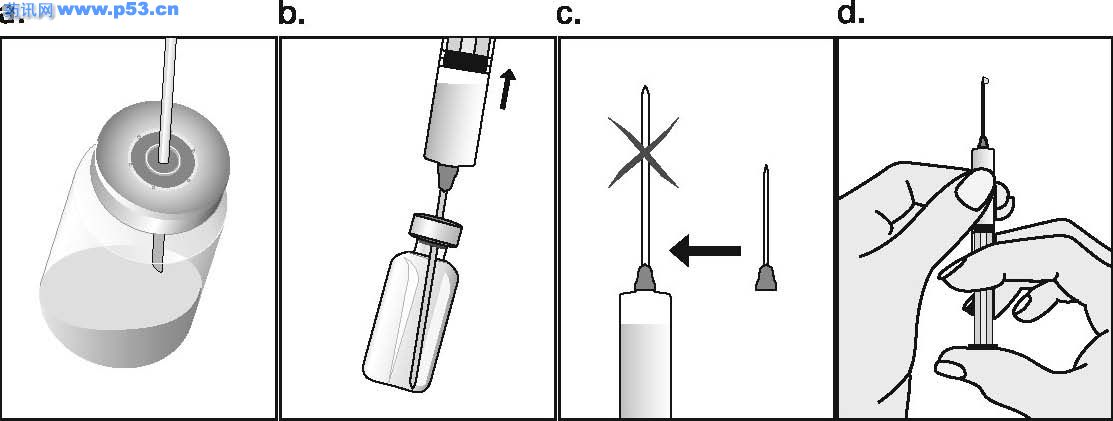
Etapa 2 – Locul injectării Cel mai bun loc pentru injecţia subcutanată este în abdomen în jurul buricului (e) acolo unde există mai multă piele şi ţesut gras. Trebuie să schimbaţi puţin locul de injectare de fiecare dată. Este posibilă injectarea în alte locuri. Doctorul dumneavoastră sau asistenta medicală vă pot sfătui unde să faceţi injecţia. Etapa 3 – Pregătirea zonei Câteva bătăi uşoare la locul injecţiei vor stimula micile terminaţii nervoase şi vor reduce disconfortul din momentul introducerii acului. Mâinile trebuie să fie spălate şi locul de injectare trebuie dezinfectat (de exemplu cu clorhexidină 0,5%) pentru a îndepărta orice bacterie de pe suprafaţă. Dezinfectaţi locul pe aproximativ cinci centimetri în jurul locului de pătrundere a acului şi lăsaţi dezinfectantul să se usuce cel puţin un minut înainte de a continua. Etapa 4 – Introducerea acului Ciupiţi puţin pielea. Cu cealaltă mână introduceţi acul la un unghi de 90 de grade cu suprafaţa pielii (f). 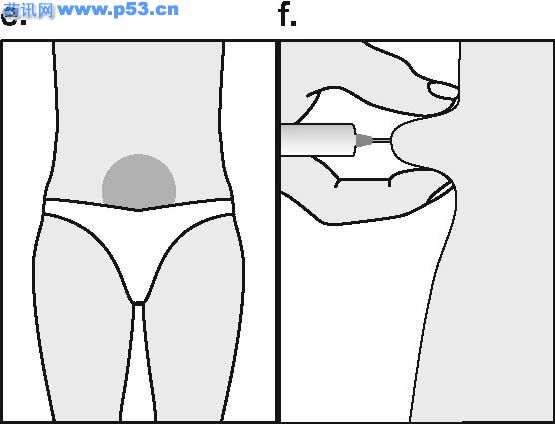
Etapa 5 – Verificarea poziţiei corecte a acului Dacă acul este corect poziţionat, pistonul se trage destul de greu înapoi. Orice cantitate de sânge trasă înapoi în seringă arată că vârful acului a pătruns într-o venă sau arteră. Dacă se întâmplă acest lucru, scoateţi seringa, acoperiţi locul injectării cu un tampon care conţine dezinfectant şi ţineţi apăsat; sângerarea se va opri după 1-2 minute. Nu mai folosiţi soluţia respectivă, aruncaţi-o. Trebuie să reîncepeţi cu Etapa 1 folosind un ac şi o seringă noi şi un nou flacon de Puregon. Etapa 6 – Injectarea soluţiei Împingeţi pistonul încet şi constant astfel încât soluţia să fie injectată corect şi structura pielii să nu fie afectată. Etapa 7 – Îndepărtarea seringii Scoateţi seringa rapid şi ţineţi apăsat pe locul injectării cu un tampon cu dezinfectant. Un masaj uşor al locului – menţinând încă apăsarea – ajută la dispersarea soluţiei de Puregon şi la înlăturarea oricărui disconfort. Orice cantitate de soluţie nefolosită trebuie aruncată. Nu amestecaţi Puregon cu niciun alt medicament. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine flaconul (flacoanele) în cutie. Pentru uşurinţă în utilizare se poate păstra Puregon la sau sub 25°C (la temperatura camerei), pentru o singură perioadă de maximum 3 luni. Notaţi momentul de când începeţi să păstraţi produsul în afara frigiderului. Conţinutul unui flacon trebuie folosit imediat după perforarea dopului de cauciuc. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6. INFORMAŢII SUPLIMENTARE Ce conţine Puregon
Cum arată Puregon şi conţinutul ambalajului Puregon soluţie injectabilă este o soluţie limpede şi incoloră. Este furnizat în flacon de sticlă. Este disponibil în cutii de 1, 5 sau 10 flacoane. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 100 UI/0,5 ml soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon soluţie injectabilă conţine folitropină beta, un hormon cunoscut ca hormon foliculostimulant (FSH). FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FIV Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon are efect numai dacă este injectat într-un muşchi sau sub piele. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Injecţiile trebuie făcute încet în muşchi (de exemplu în fesă, coapsă sau în braţ) sau imediat sub piele (de exemplu în peretele abdominal). Injecţiile în muşchi (intramusculare) trebuie făcute numai de un medic sau o asistentă medicală. În unele cazuri injecţiile sub piele (subcutanate) pot fi făcute de către dumneavoastră sau de partenerul dumneavoastră. Medicul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Instrucţiuni de folosire Etapa 1 – Prepararea seringii Pentru administrarea de Puregon trebuie utilizate seringi şi ace sterile de unică folosinţă. Volumul seringii trebuie să fie suficient de mic pentru ca doza prescrisă să fie administrată cu o precizie rezonabilă. Puregon soluţie injectabilă este disponibil în flacoane de sticlă. Nu folosiţi dacă soluţia conţine particule sau nu este limpede. Întâi scoateţi capacul flip-off al flaconului. Montaţi acul la seringăşi perforaţi cu acul dopul de cauciuc al flaconului (a). Aspiraţi soluţia în seringă (b) şi înlocuiţi acul cu un ac pentru injecţie (c). În final ţineţi seringa cu acul îndreptat în sus şi loviţi uşor corpul seringii pentru ca bulele de aer să urce la suprafaţă; apoi apăsaţi pistonul până când tot aerul este scos şi rămâne în seringă numai soluţia Puregon (d). Dacă este nevoie, pistonul poate fi apăsat şi mai mult pentru a ajusta volumul care va fi administrat. 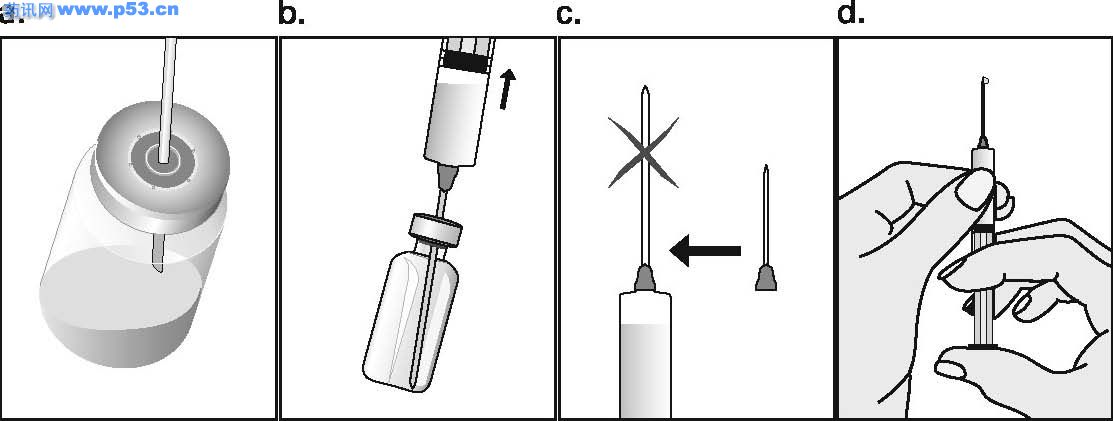
Etapa 2 – Locul injectării Cel mai bun loc pentru injecţia subcutanată este în abdomen în jurul buricului (e) acolo unde există mai multă piele şi ţesut gras. Trebuie să schimbaţi puţin locul de injectare de fiecare dată. Este posibilă injectarea în alte locuri. Doctorul dumneavoastră sau asistenta medicală vă pot sfătui unde să faceţi injecţia. Etapa 3 – Pregătirea zonei Câteva bătăi uşoare la locul injecţiei vor stimula micile terminaţii nervoase şi vor reduce disconfortul din momentul introducerii acului. Mâinile trebuie să fie spălate şi locul de injectare trebuie dezinfectat (de exemplu cu clorhexidină 0,5%) pentru a îndepărta orice bacterie de pe suprafaţă. Dezinfectaţi locul pe aproximativ cinci centimetri în jurul locului de pătrundere a acului şi lăsaţi dezinfectantul să se usuce cel puţin un minut înainte de a continua. Etapa 4 – Introducerea acului Ciupiţi puţin pielea. Cu cealaltă mână introduceţi acul la un unghi de 90 de grade cu suprafaţa pielii (f). 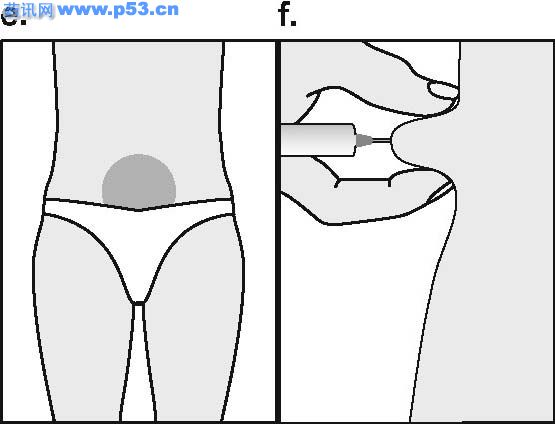
Etapa 5 – Verificarea poziţiei corecte a acului Dacă acul este corect poziţionat, pistonul se trage destul de greu înapoi. Orice cantitate de sânge trasă înapoi în seringă arată că vârful acului a pătruns într-o venă sau arteră. Dacă se întâmplă acest lucru, scoateţi seringa, acoperiţi locul injectării cu un tampon care conţine dezinfectant şi ţineţi apăsat; sângerarea se va opri după 1-2 minute. Nu mai folosiţi soluţia respectivă, aruncaţi-o. Trebuie să reîncepeţi cu Etapa 1 folosind un ac şi o seringă noi şi un nou flacon de Puregon. Etapa 6 – Injectarea soluţiei Împingeţi pistonul încet şi constant astfel încât soluţia să fie injectată corect şi structura pielii să nu fie afectată. Etapa 7 – Îndepărtarea seringii Scoateţi seringa rapid şi ţineţi apăsat pe locul injectării cu un tampon cu dezinfectant. Un masaj uşor al locului – menţinând încă apăsarea – ajută la dispersarea soluţiei de Puregon şi la înlăturarea oricărui disconfort. Orice cantitate de soluţie nefolosită trebuie aruncată. Nu amestecaţi Puregon cu niciun alt medicament. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine flaconul (flacoanele) în cutie. Pentru uşurinţă în utilizare se poate păstra Puregon la sau sub 25°C (la temperatura camerei), pentru o singură perioadă de maximum 3 luni. Notaţi momentul de când începeţi să păstraţi produsul în afara frigiderului. Conţinutul unui flacon trebuie folosit imediat după perforarea dopului de cauciuc. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6. INFORMAŢII SUPLIMENTARE Ce conţine Puregon
Cum arată Puregon şi conţinutul ambalajului Puregon soluţie injectabilă este o soluţie limpede şi incoloră. Este furnizat în flacon de sticlă. Este disponibil în cutii de 1, 5 sau 10 flacoane. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 100 UI/0,5 ml soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon soluţie injectabilă conţine folitropină beta, un hormon cunoscut ca hormon foliculostimulant (FSH). FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FIV Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon are efect numai dacă este injectat într-un muşchi sau sub piele. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Injecţiile trebuie făcute încet în muşchi (de exemplu în fesă, coapsă sau în braţ) sau imediat sub piele (de exemplu în peretele abdominal). Injecţiile în muşchi (intramusculare) trebuie făcute numai de un medic sau o asistentă medicală. În unele cazuri injecţiile sub piele (subcutanate) pot fi făcute de către dumneavoastră sau de partenerul dumneavoastră. Medicul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Instrucţiuni de folosire Etapa 1 – Prepararea seringii Pentru administrarea de Puregon trebuie utilizate seringi şi ace sterile de unică folosinţă. Volumul seringii trebuie să fie suficient de mic pentru ca doza prescrisă să fie administrată cu o precizie rezonabilă. Puregon soluţie injectabilă este disponibil în flacoane de sticlă. Nu folosiţi dacă soluţia conţine particule sau nu este limpede. Întâi scoateţi capacul flip-off al flaconului. Montaţi acul la seringăşi perforaţi cu acul dopul de cauciuc al flaconului (a). Aspiraţi soluţia în seringă (b) şi înlocuiţi acul cu un ac pentru injecţie (c). În final ţineţi seringa cu acul îndreptat în sus şi loviţi uşor corpul seringii pentru ca bulele de aer să urce la suprafaţă; apoi apăsaţi pistonul până când tot aerul este scos şi rămâne în seringă numai soluţia Puregon (d). Dacă este nevoie, pistonul poate fi apăsat şi mai mult pentru a ajusta volumul care va fi administrat. 
Etapa 2 – Locul injectării Cel mai bun loc pentru injecţia subcutanată este în abdomen în jurul buricului (e) acolo unde există mai multă piele şi ţesut gras. Trebuie să schimbaţi puţin locul de injectare de fiecare dată. Este posibilă injectarea în alte locuri. Doctorul dumneavoastră sau asistenta medicală vă pot sfătui unde să faceţi injecţia. Etapa 3 – Pregătirea zonei Câteva bătăi uşoare la locul injecţiei vor stimula micile terminaţii nervoase şi vor reduce disconfortul din momentul introducerii acului. Mâinile trebuie să fie spălate şi locul de injectare trebuie dezinfectat (de exemplu cu clorhexidină 0,5%) pentru a îndepărta orice bacterie de pe suprafaţă. Dezinfectaţi locul pe aproximativ cinci centimetri în jurul locului de pătrundere a acului şi lăsaţi dezinfectantul să se usuce cel puţin un minut înainte de a continua. Etapa 4 – Introducerea acului Ciupiţi puţin pielea. Cu cealaltă mână introduceţi acul la un unghi de 90 de grade cu suprafaţa pielii (f). 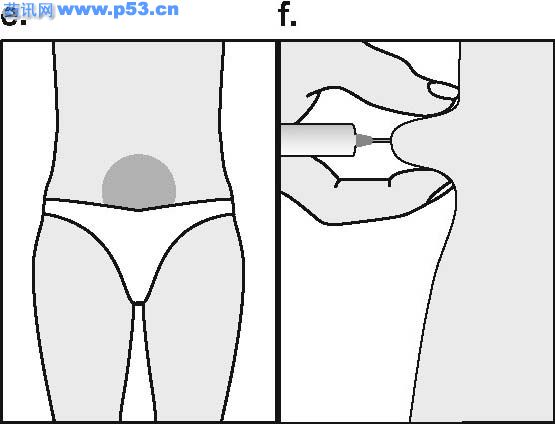
Etapa 5 – Verificarea poziţiei corecte a acului Dacă acul este corect poziţionat, pistonul se trage destul de greu înapoi. Orice cantitate de sânge trasă înapoi în seringă arată că vârful acului a pătruns într-o venă sau arteră. Dacă se întâmplă acest lucru, scoateţi seringa, acoperiţi locul injectării cu un tampon care conţine dezinfectant şi ţineţi apăsat; sângerarea se va opri după 1-2 minute. Nu mai folosiţi soluţia respectivă, aruncaţi-o. Trebuie să reîncepeţi cu Etapa 1 folosind un ac şi o seringă noi şi un nou flacon de Puregon. Etapa 6 – Injectarea soluţiei Împingeţi pistonul încet şi constant astfel încât soluţia să fie injectată corect şi structura pielii să nu fie afectată. Etapa 7 – Îndepărtarea seringii Scoateţi seringa rapid şi ţineţi apăsat pe locul injectării cu un tampon cu dezinfectant. Un masaj uşor al locului – menţinând încă apăsarea – ajută la dispersarea soluţiei de Puregon şi la înlăturarea oricărui disconfort. Orice cantitate de soluţie nefolosită trebuie aruncată. Nu amestecaţi Puregon cu niciun alt medicament. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine flaconul (flacoanele) în cutie. Pentru uşurinţă în utilizare se poate păstra Puregon la sau sub 25°C (la temperatura camerei), pentru o singură perioadă de maximum 3 luni. Notaţi momentul de când începeţi să păstraţi produsul în afara frigiderului. Conţinutul unui flacon trebuie folosit imediat după perforarea dopului de cauciuc. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6. INFORMAŢII SUPLIMENTARE Ce conţine Puregon
Cum arată Puregon şi conţinutul ambalajului Puregon soluţie injectabilă este o soluţie limpede şi incoloră. Este furnizat în flacon de sticlă. Este disponibil în cutii de 1, 5 sau 10 flacoane. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 200 UI/0,5 ml soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon soluţie injectabilă conţine folitropină beta, un hormon cunoscut ca hormon foliculostimulant (FSH). FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FIV Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon are efect numai dacă este injectat într-un muşchi sau sub piele. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Injecţiile trebuie făcute încet în muşchi (de exemplu în fesă, coapsă sau în braţ) sau imediat sub piele (de exemplu în peretele abdominal). Injecţiile în muşchi (intramusculare) trebuie făcute numai de un medic sau o asistentă medicală. În unele cazuri injecţiile sub piele (subcutanate) pot fi făcute de către dumneavoastră sau de partenerul dumneavoastră. Medicul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Instrucţiuni de folosire Etapa 1 – Prepararea seringii Pentru administrarea de Puregon trebuie utilizate seringi şi ace sterile de unică folosinţă. Volumul seringii trebuie să fie suficient de mic pentru ca doza prescrisă să fie administrată cu o precizie rezonabilă. Puregon soluţie injectabilă este disponibil în flacoane de sticlă. Nu folosiţi dacă soluţia conţine particule sau nu este limpede. Întâi scoateţi capacul flip-off al flaconului. Montaţi acul la seringăşi perforaţi cu acul dopul de cauciuc al flaconului (a). Aspiraţi soluţia în seringă (b) şi înlocuiţi acul cu un ac pentru injecţie (c). În final ţineţi seringa cu acul îndreptat în sus şi loviţi uşor corpul seringii pentru ca bulele de aer să urce la suprafaţă; apoi apăsaţi pistonul până când tot aerul este scos şi rămâne în seringă numai soluţia Puregon (d). Dacă este nevoie, pistonul poate fi apăsat şi mai mult pentru a ajusta volumul care va fi administrat. 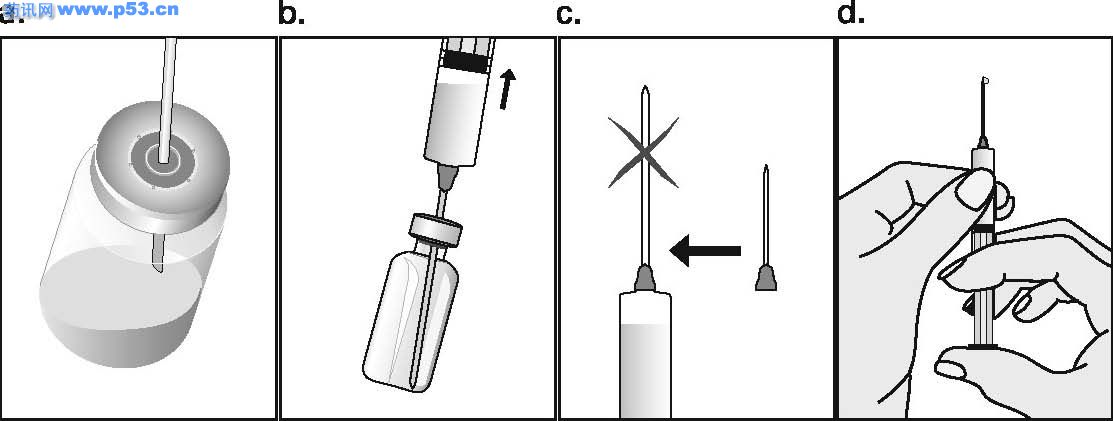
Etapa 2 – Locul injectării Cel mai bun loc pentru injecţia subcutanată este în abdomen în jurul buricului (e) acolo unde există mai multă piele şi ţesut gras. Trebuie să schimbaţi puţin locul de injectare de fiecare dată. Este posibilă injectarea în alte locuri. Doctorul dumneavoastră sau asistenta medicală vă pot sfătui unde să faceţi injecţia. Etapa 3 – Pregătirea zonei Câteva bătăi uşoare la locul injecţiei vor stimula micile terminaţii nervoase şi vor reduce disconfortul din momentul introducerii acului. Mâinile trebuie să fie spălate şi locul de injectare trebuie dezinfectat (de exemplu cu clorhexidină 0,5%) pentru a îndepărta orice bacterie de pe suprafaţă. Dezinfectaţi locul pe aproximativ cinci centimetri în jurul locului de pătrundere a acului şi lăsaţi dezinfectantul să se usuce cel puţin un minut înainte de a continua. Etapa 4 – Introducerea acului Ciupiţi puţin pielea. Cu cealaltă mână introduceţi acul la un unghi de 90 de grade cu suprafaţa pielii (f). 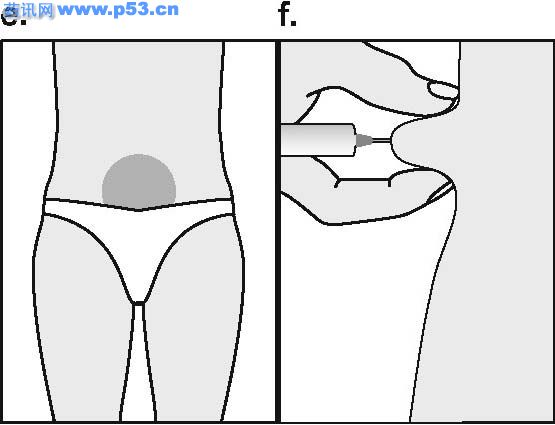
Etapa 5 – Verificarea poziţiei corecte a acului Dacă acul este corect poziţionat, pistonul se trage destul de greu înapoi. Orice cantitate de sânge trasă înapoi în seringă arată că vârful acului a pătruns într-o venă sau arteră. Dacă se întâmplă acest lucru, scoateţi seringa, acoperiţi locul injectării cu un tampon care conţine dezinfectant şi ţineţi apăsat; sângerarea se va opri după 1-2 minute. Nu mai folosiţi soluţia respectivă, aruncaţi-o. Trebuie să reîncepeţi cu Etapa 1 folosind un ac şi o seringă noi şi un nou flacon de Puregon. Etapa 6 – Injectarea soluţiei Împingeţi pistonul încet şi constant astfel încât soluţia să fie injectată corect şi structura pielii să nu fie afectată. Etapa 7 – Îndepărtarea seringii Scoateţi seringa rapid şi ţineţi apăsat pe locul injectării cu un tampon cu dezinfectant. Un masaj uşor al locului – menţinând încă apăsarea – ajută la dispersarea soluţiei de Puregon şi la înlăturarea oricărui disconfort. Orice cantitate de soluţie nefolosită trebuie aruncată. Nu amestecaţi Puregon cu niciun alt medicament. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine flaconul (flacoanele) în cutie. Pentru uşurinţă în utilizare se poate păstra Puregon la sau sub 25°C (la temperatura camerei), pentru o singură perioadă de maximum 3 luni. Notaţi momentul de când începeţi să păstraţi produsul în afara frigiderului. Conţinutul unui flacon trebuie folosit imediat după perforarea dopului de cauciuc. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6. INFORMAŢII SUPLIMENTARE Ce conţine Puregon
Cum arată Puregon şi conţinutul ambalajului Puregon soluţie injectabilă este o soluţie limpede şi incoloră. Este furnizat în flacon de sticlă. Este disponibil în cutii de 1, 5 sau 10 flacoane. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 225 UI/0,5 ml soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon soluţie injectabilă conţine folitropină beta, un hormon cunoscut ca hormon foliculostimulant (FSH). FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FIV Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon are efect numai dacă este injectat într-un muşchi sau sub piele. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Injecţiile trebuie făcute încet în muşchi (de exemplu în fesă, coapsă sau în braţ) sau imediat sub piele (de exemplu în peretele abdominal). Injecţiile în muşchi (intramusculare) trebuie făcute numai de un medic sau o asistentă medicală. În unele cazuri injecţiile sub piele (subcutanate) pot fi făcute de către dumneavoastră sau de partenerul dumneavoastră. Medicul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Instrucţiuni de folosire Etapa 1 – Prepararea seringii Pentru administrarea de Puregon trebuie utilizate seringi şi ace sterile de unică folosinţă. Volumul seringii trebuie să fie suficient de mic pentru ca doza prescrisă să fie administrată cu o precizie rezonabilă. Puregon soluţie injectabilă este disponibil în flacoane de sticlă. Nu folosiţi dacă soluţia conţine particule sau nu este limpede. Întâi scoateţi capacul flip-off al flaconului. Montaţi acul la seringăşi perforaţi cu acul dopul de cauciuc al flaconului (a). Aspiraţi soluţia în seringă (b) şi înlocuiţi acul cu un ac pentru injecţie (c). În final ţineţi seringa cu acul îndreptat în sus şi loviţi uşor corpul seringii pentru ca bulele de aer să urce la suprafaţă; apoi apăsaţi pistonul până când tot aerul este scos şi rămâne în seringă numai soluţia Puregon (d). Dacă este nevoie, pistonul poate fi apăsat şi mai mult pentru a ajusta volumul care va fi administrat. 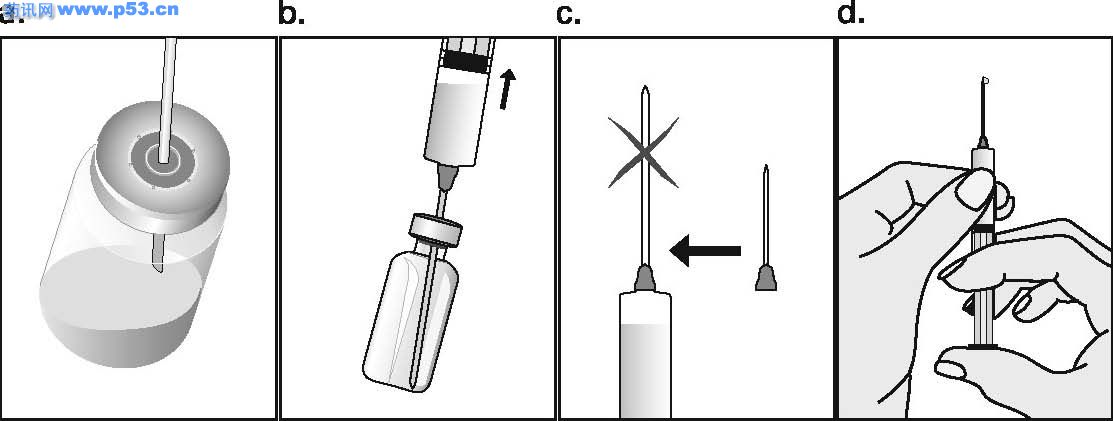
Etapa 2 – Locul injectării Cel mai bun loc pentru injecţia subcutanată este în abdomen în jurul buricului (e) acolo unde există mai multă piele şi ţesut gras. Trebuie să schimbaţi puţin locul de injectare de fiecare dată. Este posibilă injectarea în alte locuri. Doctorul dumneavoastră sau asistenta medicală vă pot sfătui unde să faceţi injecţia. Etapa 3 – Pregătirea zonei Câteva bătăi uşoare la locul injecţiei vor stimula micile terminaţii nervoase şi vor reduce disconfortul din momentul introducerii acului. Mâinile trebuie să fie spălate şi locul de injectare trebuie dezinfectat (de exemplu cu clorhexidină 0,5%) pentru a îndepărta orice bacterie de pe suprafaţă. Dezinfectaţi locul pe aproximativ cinci centimetri în jurul locului de pătrundere a acului şi lăsaţi dezinfectantul să se usuce cel puţin un minut înainte de a continua. Etapa 4 – Introducerea acului Ciupiţi puţin pielea. Cu cealaltă mână introduceţi acul la un unghi de 90 de grade cu suprafaţa pielii (f). 
Etapa 5 – Verificarea poziţiei corecte a acului Dacă acul este corect poziţionat, pistonul se trage destul de greu înapoi. Orice cantitate de sânge trasă înapoi în seringă arată că vârful acului a pătruns într-o venă sau arteră. Dacă se întâmplă acest lucru, scoateţi seringa, acoperiţi locul injectării cu un tampon care conţine dezinfectant şi ţineţi apăsat; sângerarea se va opri după 1-2 minute. Nu mai folosiţi soluţia respectivă, aruncaţi-o. Trebuie să reîncepeţi cu Etapa 1 folosind un ac şi o seringă noi şi un nou flacon de Puregon. Etapa 6 – Injectarea soluţiei Împingeţi pistonul încet şi constant astfel încât soluţia să fie injectată corect şi structura pielii să nu fie afectată. Etapa 7 – Îndepărtarea seringii Scoateţi seringa rapid şi ţineţi apăsat pe locul injectării cu un tampon cu dezinfectant. Un masaj uşor al locului – menţinând încă apăsarea – ajută la dispersarea soluţiei de Puregon şi la înlăturarea oricărui disconfort. Orice cantitate de soluţie nefolosită trebuie aruncată. Nu amestecaţi Puregon cu niciun alt medicament. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine flaconul (flacoanele) în cutie. Pentru uşurinţă în utilizare se poate păstra Puregon la sau sub 25°C (la temperatura camerei), pentru o singură perioadă de maximum 3 luni. Notaţi momentul de când începeţi să păstraţi produsul în afara frigiderului. Conţinutul unui flacon trebuie folosit imediat după perforarea dopului de cauciuc. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6. INFORMAŢII SUPLIMENTARE Ce conţine Puregon
Cum arată Puregon şi conţinutul ambalajului Puregon soluţie injectabilă este o soluţie limpede şi incoloră. Este furnizat în flacon de sticlă. Este disponibil în cutii de 1, 5 sau 10 flacoane. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 250 UI/0,5 ml soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon soluţie injectabilă conţine folitropină beta, un hormon cunoscut ca hormon foliculostimulant (FSH). FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FIV Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon are efect numai dacă este injectat într-un muşchi sau sub piele. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Injecţiile trebuie făcute încet în muşchi (de exemplu în fesă, coapsă sau în braţ) sau imediat sub piele (de exemplu în peretele abdominal). Injecţiile în muşchi (intramusculare) trebuie făcute numai de un medic sau o asistentă medicală. În unele cazuri injecţiile sub piele (subcutanate) pot fi făcute de către dumneavoastră sau de partenerul dumneavoastră. Medicul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Instrucţiuni de folosire Etapa 1 – Prepararea seringii Pentru administrarea de Puregon trebuie utilizate seringi şi ace sterile de unică folosinţă. Volumul seringii trebuie să fie suficient de mic pentru ca doza prescrisă să fie administrată cu o precizie rezonabilă. Puregon soluţie injectabilă este disponibil în flacoane de sticlă. Nu folosiţi dacă soluţia conţine particule sau nu este limpede. Întâi scoateţi capacul flip-off al flaconului. Montaţi acul la seringăşi perforaţi cu acul dopul de cauciuc al flaconului (a). Aspiraţi soluţia în seringă (b) şi înlocuiţi acul cu un ac pentru injecţie (c). În final ţineţi seringa cu acul îndreptat în sus şi loviţi uşor corpul seringii pentru ca bulele de aer să urce la suprafaţă; apoi apăsaţi pistonul până când tot aerul este scos şi rămâne în seringă numai soluţia Puregon (d). Dacă este nevoie, pistonul poate fi apăsat şi mai mult pentru a ajusta volumul care va fi administrat. 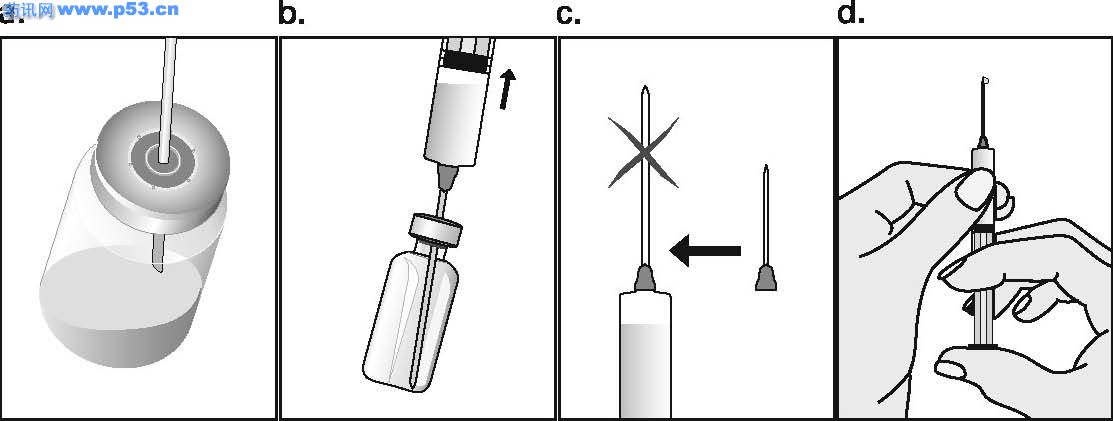
Etapa 2 – Locul injectării Cel mai bun loc pentru injecţia subcutanată este în abdomen în jurul buricului (e) acolo unde există mai multă piele şi ţesut gras. Trebuie să schimbaţi puţin locul de injectare de fiecare dată. Este posibilă injectarea în alte locuri. Doctorul dumneavoastră sau asistenta medicală vă pot sfătui unde să faceţi injecţia. Etapa 3 – Pregătirea zonei Câteva bătăi uşoare la locul injecţiei vor stimula micile terminaţii nervoase şi vor reduce disconfortul din momentul introducerii acului. Mâinile trebuie să fie spălate şi locul de injectare trebuie dezinfectat (de exemplu cu clorhexidină 0,5%) pentru a îndepărta orice bacterie de pe suprafaţă. Dezinfectaţi locul pe aproximativ cinci centimetri în jurul locului de pătrundere a acului şi lăsaţi dezinfectantul să se usuce cel puţin un minut înainte de a continua. Etapa 4 – Introducerea acului Ciupiţi puţin pielea. Cu cealaltă mână introduceţi acul la un unghi de 90 de grade cu suprafaţa pielii (f). 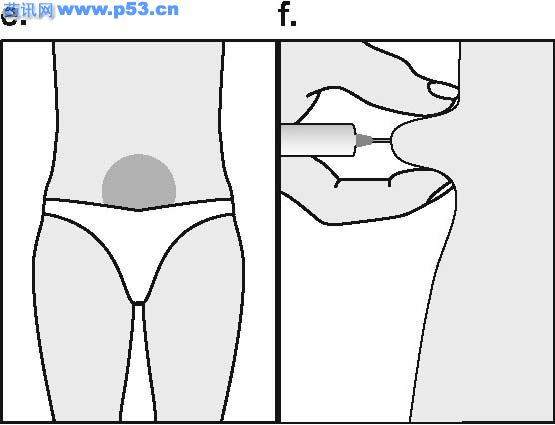
Etapa 5 – Verificarea poziţiei corecte a acului Dacă acul este corect poziţionat, pistonul se trage destul de greu înapoi. Orice cantitate de sânge trasă înapoi în seringă arată că vârful acului a pătruns într-o venă sau arteră. Dacă se întâmplă acest lucru, scoateţi seringa, acoperiţi locul injectării cu un tampon care conţine dezinfectant şi ţineţi apăsat; sângerarea se va opri după 1-2 minute. Nu mai folosiţi soluţia respectivă, aruncaţi-o. Trebuie să reîncepeţi cu Etapa 1 folosind un ac şi o seringă noi şi un nou flacon de Puregon. Etapa 6 – Injectarea soluţiei Împingeţi pistonul încet şi constant astfel încât soluţia să fie injectată corect şi structura pielii să nu fie afectată. Etapa 7 – Îndepărtarea seringii Scoateţi seringa rapid şi ţineţi apăsat pe locul injectării cu un tampon cu dezinfectant. Un masaj uşor al locului – menţinând încă apăsarea – ajută la dispersarea soluţiei de Puregon şi la înlăturarea oricărui disconfort. Orice cantitate de soluţie nefolosită trebuie aruncată. Nu amestecaţi Puregon cu niciun alt medicament. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine flaconul (flacoanele) în cutie. Pentru uşurinţă în utilizare se poate păstra Puregon la sau sub 25°C (la temperatura camerei), pentru o singură perioadă de maximum 3 luni. Notaţi momentul de când începeţi să păstraţi produsul în afara frigiderului. Conţinutul unui flacon trebuie folosit imediat după perforarea dopului de cauciuc. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6. INFORMAŢII SUPLIMENTARE Ce conţine Puregon
Cum arată Puregon şi conţinutul ambalajului Puregon soluţie injectabilă este o soluţie limpede şi incoloră. Este furnizat în flacon de sticlă. Este disponibil în cutii de 1, 5 sau 10 flacoane. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 150 UI/0.18 ml soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon 150 UI/0.18 ml soluţie injectabilă conţine un hormon cunoscut ca hormon foliculostimulant (FSH), la o concentraţie de 833 UI/ml. FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FVI Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon soluţie injectabilă în cartuşe a fost creat pentru a fi folosit împreună cu Puregon Pen. Trebuie urmate cu atenţie instrucţiunile de folosire ale injectorului stilou. Nu folosiţi cartuşul dacă soluţia conţine particule sau nu este limpede. Folosind stiloul, injecţiile imediat sub piele (de exemplu în peretele abdominal), pot fi făcute de către dumneavoastră sau de către partener. Doctorul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine cartuşul (cartuşele) în cutie. Pentru uşurinţă în utilizare se poate păstra Puregon la sau sub 25°C (la temperatura camerei), pentru o singură perioadă de maximum 3 luni. Notaţi momentul de când începeţi să păstraţi produsul în afara frigiderului. Dupa ce dopul din cauciuc al cartuşului a fost perforat de ac, produsul poate fi păstrat pentru maximum 28 de zile. Scrieţi data primei utilizări a cartuşului pe tabelul de evidenţă a dozelor, aşa cum este arătat în Manualul cu Instrucţiuni al Puregon Pen. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Aruncaţi acele folosite imediat după injecţie. Cartuşele Puregon nu sunt concepute pentru a permite amestecul cu oricare alte medicamente în cartuşe. Cartuşele goale nu trebuie reumplute. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6.Ce conţine Puregon INFORMAŢII SUPLIMENTARE
Cum arată Puregon şi conţinutul ambalajului Puregon soluţie injectabilă este o soluţie limpede şi incoloră. Este furnizat într-un cartuş de sticlă. Este disponibil în cutii cu 1 cartuş. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 300 UI/0.36 ml soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon 300 UI/0.36 ml soluţie injectabilă conţine un hormon cunoscut ca hormon foliculostimulant (FSH), la o concentraţie de 833 UI/ml. FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FVI Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon soluţie injectabilă în cartuşe a fost creat pentru a fi folosit împreună cu Puregon Pen. Trebuie urmate cu atenţie instrucţiunile de folosire ale injectorului stilou. Nu folosiţi cartuşul dacă soluţia conţine particule sau nu este limpede. Folosind stiloul, injecţiile imediat sub piele (de exemplu în peretele abdominal), pot fi făcute de către dumneavoastră sau de către partener. Doctorul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine cartuşul (cartuşele) în cutie. Pentru uşurinţă în utilizare se poate păstra Puregon la sau sub 25°C (la temperatura camerei), pentru o singură perioadă de maximum 3 luni. Notaţi momentul de când începeţi să păstraţi produsul în afara frigiderului. Dupa ce dopul din cauciuc al cartuşului a fost perforat de ac, produsul poate fi păstrat pentru maximum 28 de zile. Scrieţi data primei utilizări a cartuşului pe tabelul de evidenţă a dozelor, aşa cum este arătat în Manualul cu Instrucţiuni al Puregon Pen. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Aruncaţi acele folosite imediat după injecţie. Cartuşele Puregon nu sunt concepute pentru a permite amestecul cu oricare alte medicamente în cartuşe. Cartuşele goale nu trebuie reumplute. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6.Ce conţine Puregon INFORMAŢII SUPLIMENTARE
Cum arată Puregon şi conţinutul ambalajului Puregon soluţie injectabilă este o soluţie limpede şi incoloră. Este furnizat într-un cartuş de sticlă. Este disponibil în cutii cu 1 cartuş. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 600 UI/0.72 ml soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon 600 UI/0.72 ml soluţie injectabilă conţine un hormon cunoscut ca hormon foliculostimulant (FSH), la o concentraţie de 833 UI/ml. FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FVI Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon soluţie injectabilă în cartuşe a fost creat pentru a fi folosit împreună cu Puregon Pen. Trebuie urmate cu atenţie instrucţiunile de folosire ale injectorului stilou. Nu folosiţi cartuşul dacă soluţia conţine particule sau nu este limpede. Folosind stiloul, injecţiile imediat sub piele (de exemplu în peretele abdominal), pot fi făcute de către dumneavoastră sau de către partener. Doctorul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine cartuşul (cartuşele) în cutie. Pentru uşurinţă în utilizare se poate păstra Puregon la sau sub 25°C (la temperatura camerei), pentru o singură perioadă de maximum 3 luni. Notaţi momentul de când începeţi să păstraţi produsul în afara frigiderului. Dupa ce dopul din cauciuc al cartuşului a fost perforat de ac, produsul poate fi păstrat pentru maximum 28 de zile. Scrieţi data primei utilizări a cartuşului pe tabelul de evidenţă a dozelor, aşa cum este arătat în Manualul cu Instrucţiuni al Puregon Pen. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Aruncaţi acele folosite imediat după injecţie. Cartuşele Puregon nu sunt concepute pentru a permite amestecul cu oricare alte medicamente în cartuşe. Cartuşele goale nu trebuie reumplute. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6.Ce conţine Puregon INFORMAŢII SUPLIMENTARE
Cum arată Puregon şi conţinutul ambalajului Puregon soluţie injectabilă este o soluţie limpede şi incoloră. Este furnizat într-un cartuş de sticlă. Este disponibil în cutii cu 1 cartuş. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. PROSPECT: INFORMAŢII PENTRU UTILIZATOR Puregon 900 UI/1,08 ml soluţie injectabilă folitropină beta Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament.
În acest prospect găsiţi:
1. CE ESTE PUREGON ŞI PENTRU CE SE UTILIZEAZĂ Puregon 900 UI/1,08 ml soluţie injectabilă conţine un hormon cunoscut ca hormon foliculostimulant (FSH), la o concentraţie de 833 UI/ml. FSH aparţine grupului gonadotropinelor, care joacă un rol important pentru fertilitatea umanăşi reproducere. Femeile au nevoie de FSH pentru creşterea şi dezvoltarea foliculilor în ovare. Foliculii sunt săculeţi mici şi rotunzi care conţin celulele ou. La bărbaţi FSH este necesar pentru producerea spermei. Puregon este folosit pentru a trata infertilitatea în oricare din următoarele situaţii:
2. ÎNAINTE SĂ UTILIZAŢI PUREGON Nu utilizaţi Puregon
Aveţi grijă deosebită când utilizaţi Puregon Vă rugăm informaţi medicul dvs. dacă aţi avut vreodată o reacţie alergică la neomicinăşi/sau streptomicină (antibiotice). Dacă sunteţi femeie: Este foarte important ca medicul dumneavoastră să vă supravegheze atent. De obicei, se fac în mod regulat ecografii ale ovarelor şi se fac regulat analize de sânge sau urină. Rezultatele acestor teste permit medicului să aleagă corect doza zilnică de Puregon. Acest lucru este foarte important pentru că o doză prea mare de FSH poate duce la complicaţii, rare dar serioase, în care ovarele devin hiperstimulate. Acest lucru este resimţit ca o durere în abdomen. Monitorizarea regulată a răspunsului la tratamentul cu FSH ajută medicul să prevină hiperstimularea ovariană. Ca urmare luaţi imediat legătura cu medicul dumneavoastră dacă simţiţi dureri abdominale importante şi, de asemenea, dacă aceste dureri apar la câteva zile după administrarea ultimei injecţii. Tratamentul cu Puregon (la fel ca şi sarcina) poate creşte riscul de tromboză (formarea de cheaguri de sânge în vasele de sânge, cel mai frecvent în venele de la picioare sau de la plămâni). Vă rugăm să discutaţi cu medicul dumneavoastră, înainte de începerea tratamentului, mai ales dacă:
Dacă sunteţi bărbat: Concentraţiile sanguine crescute ale FSH-ului sunt indicatori de leziune testiculară. Puregon nu este de obicei eficient în astfel de cazuri. Pentru a monitoriza tratamentul, doctorul dumneavoastră vă poate cere să efectuaţi analiza lichidului seminal la 4-6 luni după începerea tratamentului. Utilizarea altor medicamente Dacă Puregon este folosit în asociere cu clomifen citrat poate exista un răspuns folicular crescut. Dacă a fost administrat un agonist GnRH, poate fi nevoie de doze mai mari de Puregon pentru obţinerea unui răspuns. Vă rugăm să spuneţi medicului dumneavoastră sau farmacistului dacă luaţi sau aţi luat recent orice alte medicamente, inclusiv dintre cele eliberate fără prescripţie medicală. Sarcina Nu există dovezi din experienţa clinică sau din studii pe animale că folosirea Puregon în timpul sarcinii ar putea determina anomalii congenitale. Totuşi nu trebuie să folosiţi Puregon dacă sunteţi deja gravidă sau bănuiţi că aţi putea fi gravidă. După tratamentul cu preparate gonadotropinice, există un risc crescut de a avea sarcini multiple. Sarcinile multiple pot creşte riscurile pentru sănătatea mamei şi copiilor ei înainte şi după naştere. Mai mult, sarcinile multiple şi caracteristicile pacienţilor care fac tratament pentru infertilitate (ex. vârsta femeii, caracteristicile spermei), pot fi asociate cu un risc crescut de malformaţii congenitale. Există o uşoară creştere a riscului de sarcină extrauterină la femeile cu afectări ale trompelor uterine. La femeile care primesc tratament pentru infertilitate poate exista o uşoară creştere a riscului de avort. Alăptarea Nu trebuie să folosiţi Puregon dacă alăptaţi. Conducerea vehiculelor şi folosirea utilajelor Nu au fost observate efecte asupra capacităţii de a conduce şi de a folosi utilaje. 3. CUM SĂ UTILIZAŢI PUREGON Utilizaţi întotdeauna Puregon exact aşa cum v-a spus medicul dumneavoastră. Trebuie să discutaţi cu medicul dumneavoastră sau cu farmacistul dacă nu sunteţi sigur. Dozarea la femei Medicul dumneavoastră va hotărî ce doză de Puregon să fie administrată. Această doză poate fi modificată pe măsură ce tratamentul progresează. Alte detalii cu privire la schema de tratament sunt prezentate mai jos. Există diferenţe mari între femei privind răspunsul ovarelor la FSH, ceea ce face imposibilă stabilirea unei scheme de dozare care să fie valabilă pentru toate pacientele. Pentru a găsi doza potrivită, creşterea foliculară este verificată prin ecografii şi prin măsurarea concentraţiei de estradiol (hormon sexual feminin) în sânge sau în urină. • La femeile care nu au ovulaţie Iniţial, doza de început este stabilită de medicul dumneavoastră. Se continuă cu această doză cel puţin 7 zile. Dacă nu există răspuns ovarian, doza zilnică va fi mărită treptat până când creşterea folicularăşi/sau concentraţiile plasmatice de estradiol indică un răspuns adecvat. Doza zilnică este apoi menţinută până când există un folicul de mărime adecvată. De obicei, sunt suficiente 7 până la 14 zile de tratament. Administrarea de Puregon este apoi întreruptăşi ovulaţia poate fi indusă prin administrarea de gonadotropină corionică umană (hCG). • Programele de reproducere asistată medical, de exemplu FVI Doza de început este stabilită de medicul dumneavoastră. Doza este menţinută cel puţin în primele patru zile. După aceasta, doza poate fi modificată în funcţie de pacientă pe baza răspunsului ovarian. Când există un număr suficient de foliculi de mărime adecvată, este indusă faza finală a maturării foliculilor prin administrarea de hCG. Recuperarea ovocitului (a oului) este realizată 34-35 ore mai târziu. Dozarea la bărbaţi Puregon este, de obicei, prescris în doză de 450 UI/săptămînă, de cele mai multe ori în trei doze de 150 UI, în asociere cu un alt hormon (hCG) pentru cel puţin 3 sau 4 luni. Dacă nu răspundeţi la tratament după această perioadă, tratamentul se poate prelungi cu cel puţin 18 luni. Metoda şi calea de administrare Puregon soluţie injectabilă în cartuşe a fost creat pentru a fi folosit împreună cu Puregon Pen. Trebuie urmate cu atenţie instrucţiunile de folosire ale injectorului stilou. Nu folosiţi cartuşul dacă soluţia conţine particule sau nu este limpede. Folosind stiloul, injecţiile imediat sub piele (de exemplu în peretele abdominal), pot fi făcute de către dumneavoastră sau de către partener. Doctorul dumneavoastră vă va spune când şi cum să faceţi asta. Atunci când instrucţiunile sunt urmate atent, Puregon va fi administrat corect şi cu minimum de discomfort. Prima injecţie cu Puregon trebuie administrată sub supraveghere medicală. Dacă utilizaţi mai mult decât trebuie din Puregon Informaţi medicul dumneavoastră. O doză prea mare poate duce la hiperstimularea ovarelor. Vezi punctul despre Reacţii Adverse Posibile de mai jos. Dacă uitaţi să utilizaţi Puregon Nu luaţi o doză dublă pentru a compensa doza uitată. Informaţi medicul dumneavoastră că aţi uitat să luaţi o doză. 4. REACŢII ADVERSE POSIBILE Ca toate medicamentele, Puregon poate provoca reacţii adverse, cu toate că nu apar la toate persoanele. Efectele secundare minore includ vânătaie, durere, înroşire, umflare şi mâncărime la locul injecţiei. Ocazional au fost observate reacţii mai extinse precum erupţia cutanată. Dacă sunteţi femeie: O complicaţie a tratamentului cu FSH este hiperstimularea nedorită a ovarelor. Această situaţie poate deveni foarte gravă, dar riscul poate fi redus prin monitorizarea atentă a dezvoltării folicului în timpul tratamentului. Primele simptome de hiperstimulare ovariană pot fi observate ca dureri în abdomen, stare de rău sau diaree. În cazurile mai severe semnele de hiperstimulare ovariană pot include mărirea ovarelor, acumularea de fluid în abdomen şi/sau piept, creştere în greutate şi apariţia cheagurilor de sânge în circulaţie. Luaţi imediat legătura cu medicul dumneavoastră dacă aveţi vreunul din aceste simptome, de asemenea, dacă ele se manifestă la câteva zile după administrarea ultimei injecţii. Foarte rar, pot să apară cheaguri de sânge fără hiperstimulare ovariană nedorită (vezi de asemenea “Aveţi grijă deosebită când utilizaţi Puregon”). Alte efecte secundare observate în studii clinice includ durere de cap şi greaţă. Dacă sunteţi bărbat: Datorită tratamentului cu hCG pot să apară acnee sau mărirea sânilor. Dacă vreuna dintre reacţiile adverse devine gravă sau dacă observaţi orice reacţie adversă nemenţionată în acest prospect, vă rugăm să spuneţi medicului dumneavoastră sau farmacistului. 5. CUM SE PĂSTREAZĂ PUREGON A nu se lăsa la îndemâna şi vederea copiilor. Nu utilizaţi Puregon după data de expirare înscrisă pe etichetă după ’EXP:’. A se păstra la frigider (2°C – 8°C). A nu se congela. A se ţine cartuşul (cartuşele) în cutie. Pentru uşurinţă în utilizare se poate păstra Puregon la sau sub 25°C (la temperatura camerei), pentru o singură perioadă de maximum 3 luni. Notaţi momentul de când începeţi să păstraţi produsul în afara frigiderului. Dupa ce dopul din cauciuc al cartuşului a fost perforat de ac, produsul poate fi păstrat pentru maximum 28 de zile. Scrieţi data primei utilizări a cartuşului pe tabelul de evidenţă a dozelor, aşa cum este arătat în Manualul cu Instrucţiuni al Puregon Pen. Nu utilizaţi Puregon dacă observaţi că soluţia conţine particule sau nu este limpede. Aruncaţi acele folosite imediat după injecţie. Cartuşele Puregon nu sunt concepute pentru a permite amestecul cu oricare alte medicamente în cartuşe. Cartuşele goale nu trebuie reumplute. Medicamentele nu trebuie aruncate pe calea apei menajere sau a reziduurilor menajere. Întrebaţi farmacistul cum să eliminaţi medicamentele care nu vă mai sunt necesare. Aceste măsuri vor ajuta la protejarea mediului. 6.Ce conţine Puregon INFORMAŢII SUPLIMENTARE
Cum arată Puregon şi conţinutul ambalajului Puregon soluţie injectabilă este o soluţie limpede şi incoloră. Este furnizat într-un cartuş de sticlă. Este disponibil în cutii cu 1 cartuş. Deţinătorul autorizaţiei de punere pe piaţă N.V. Organon, Kloosterstraat 6, Postbus 20, 5340 BH Oss, Olanda Producătorul
Acest prospect a fost aprobat în În corespondenţă vă rugăm să menţionaţi numărul lotului. |
|
当前位置:药品说明书与价格首页 >> 综合药讯 >> 普丽康-(重组促卵泡素β注射液)纯度更高并可获得更高的妊娠率
普丽康-(重组促卵泡素β注射液)纯度更高并可获得更高的妊娠率简介:
普丽康是一种激素,与人类垂体分泌的促卵泡激素(FSH)非常相似,负责使卵巢内的小泡(称卵泡)发育,每个卵泡包含一个卵细胞,一般在月经周期的中期排卵,以接受精子受精。普丽康可促使一个或多个卵泡 ... 关键字:普丽康-(重组促卵泡素β注射液)
责任编辑:admin
|
最新文章更多推荐文章更多热点文章更多
|

