セフテムカプセル100mg/セフテムカプセル200mg
商標名
Seftem
一般的名称:
略号:
化学名:
分子式:
分子量:
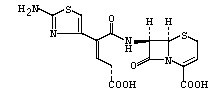
化学構造式:
性状:
融点:
分配係数:
本剤に感性の淋菌,大腸菌,クレブシエラ属,エンテロバクター属,セラチア属,プロテウス属,モルガネラ・モルガニー,プロビデンシア・レットゲリ,インフルエンザ菌 <適応症>
○ 急性気管支炎,慢性呼吸器病変の二次感染 ○ 膀胱炎,腎盂腎炎,前立腺炎(急性に限る) ○ 尿道炎
再審査終了時における安全性評価対象例10818例中,臨床検査値の異常変動を含む副作用は94例(0.87%)に認められた。(副作用の発現頻度は,承認時,再審査終了時の成績及び自発報告等に基づく。)
他のセフェム系抗生物質で,次の副作用が報告されているので,症状(異常)が認められた場合には,投与を中止し,適切な処置を行うこと。
過敏症注1:
過敏症注1:
血液注1:
血液注1:
腎臓注1:
肝臓注2:
肝臓注2:
消化器:
消化器:
菌交代症:
菌交代症:
ビタミン欠乏症:
その他:
(測定法:bioassay)(mean±S.D.)
(測定法:bioassay)
セフチブテン水和物(JAN)[日局]
Ceftibuten Hydrate
Ceftibuten Hydrate
略号:
CETB
化学名:
(6R,7R)-7-[(2Z)-2-(2-Aminothiazol-4-yl)-4-carboxybut-2-enoylamino]-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid dihydrate
分子式:
C15H14N4O6S2・2H2O
分子量:
446.46
化学構造式:

性状:
白色~淡黄白色の結晶性の粉末で,わずかに特異なにおいがある。
N,N-ジメチルホルムアミド又はジメチルスルホキシドに溶けやすく,水,エタノール(95)又はジエチルエーテルにほとんど溶けない。
N,N-ジメチルホルムアミド又はジメチルスルホキシドに溶けやすく,水,エタノール(95)又はジエチルエーテルにほとんど溶けない。
融点:
約235℃(分解)
分配係数:
0.004[pH7,1-オクタノール/緩衝液]
効能又は効果/用法及び用量
効能又は効果
<適応菌種>本剤に感性の淋菌,大腸菌,クレブシエラ属,エンテロバクター属,セラチア属,プロテウス属,モルガネラ・モルガニー,プロビデンシア・レットゲリ,インフルエンザ菌 <適応症>
○ 急性気管支炎,慢性呼吸器病変の二次感染 ○ 膀胱炎,腎盂腎炎,前立腺炎(急性に限る) ○ 尿道炎
用法及び用量
[急性気管支炎,慢性呼吸器病変の二次感染,膀胱炎,腎盂腎炎,前立腺炎(急性に限る)の場合]
通常,成人にはセフチブテン水和物として1回200mg(力価)を1日2回経口投与する。
[尿道炎の場合]
通常,成人にはセフチブテン水和物として1回100mg(力価)を1日3回経口投与する。
なお,年齢及び症状により適宜増減する。
なお,年齢及び症状により適宜増減する。
用法及び用量に関連する使用上の注意
本剤の使用にあたっては,耐性菌の発現等を防ぐため,原則として感受性を確認し,疾病の治療上必要な最小限の期間の投与にとどめること。
使用上の注意
慎重投与
(次の患者には慎重に投与すること)1.
ペニシリン系抗生物質に対し過敏症の既往歴のある患者2.
本人又は両親,兄弟に気管支喘息,発疹,蕁麻疹等のアレルギー症状を起こしやすい体質を有する患者3.
高度の腎障害のある患者[血中濃度が持続するので,投与量を減らすか,投与間隔をあけて使用すること。(「薬物動態」の項参照)]4.
経口摂取の不良な患者又は非経口栄養の患者,全身状態の悪い患者[ビタミンK欠乏症状があらわれることがあるので観察を十分に行うこと。]5.
高齢者[「高齢者への投与」の項参照]重要な基本的注意
ショックがあらわれるおそれがあるので,十分な問診を行うこと。
副作用
副作用等発現状況の概要
承認時における安全性評価対象例2279例中,副作用は54例(2.37%)に認められた。また,臨床検査値の異常変動は,検査を実施した安全性評価対象例1662例中,77例(4.63%)に認められた 1)。再審査終了時における安全性評価対象例10818例中,臨床検査値の異常変動を含む副作用は94例(0.87%)に認められた。(副作用の発現頻度は,承認時,再審査終了時の成績及び自発報告等に基づく。)
重大な副作用
1.
ショック,アナフィラキシー様症状(0.1%未満):ショック,アナフィラキシー様症状(呼吸困難,全身潮紅,浮腫等)を起こすことがあるので,観察を十分に行い,症状があらわれた場合には投与を中止し,適切な処置を行うこと。2.
急性腎不全(0.1%未満):急性腎不全等の重篤な腎障害があらわれることがあるので,定期的に検査を行うなど観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。3.
偽膜性大腸炎(0.1%未満):偽膜性大腸炎等の血便を伴う重篤な大腸炎があらわれることがある。腹痛,頻回の下痢があらわれた場合には,直ちに投与を中止するなど適切な処置を行うこと。重大な副作用(類薬)の情報
1.
溶血性貧血:溶血性貧血があらわれることがある。2.
皮膚粘膜眼症候群(Stevens-Johnson症候群),中毒性表皮壊死症(Lyell症候群):皮膚粘膜眼症候群(Stevens-Johnson症候群),中毒性表皮壊死症(Lyell症候群)があらわれることがあるので,観察を十分に行うこと。3.
間質性肺炎,PIE症候群:発熱,咳嗽,呼吸困難,胸部X線異常,好酸球増多等を伴う間質性肺炎,PIE症候群等があらわれることがあるので,このような症状があらわれた場合には投与を中止し,副腎皮質ホルモン剤の投与等の適切な処置を行うこと。その他の副作用
0.1%未満
発疹,蕁麻疹,そう痒,発熱
頻度不明
紅斑
0.1~1%
好酸球増多
0.1%未満
貧血(赤血球減少,ヘモグロビン減少,ヘマトクリット減少),顆粒球減少
0.1%未満
BUN上昇,クレアチニン上昇
0.1~1%
AST(GOT)上昇,ALT(GPT)上昇
0.1%未満
Al-P上昇,LDH上昇,ビリルビン上昇
0.1~1%
下痢,腹痛,胃痛・胃不快感
0.1%未満
悪心・嘔吐,食欲不振
0.1%未満
口内炎
頻度不明
カンジダ症
頻度不明
ビタミンK欠乏症状(低プロトロンビン血症,出血傾向等),ビタミンB群欠乏症状(舌炎,口内炎,食欲不振,神経炎等)
0.1%未満
頭重感,全身倦怠感,めまい
注1:症状(異常)が認められた場合には投与を中止し,適切な処置を行うこと。
注2:異常が認められた場合には投与を中止するなど適切な処置を行うこと。
高齢者への投与
高齢者には,次の点に注意し,用量並びに投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。
1.
高齢者では生理機能が低下していることが多く副作用が発現しやすい。2.
高齢者ではビタミンK欠乏による出血傾向があらわれることがある。妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には,治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[妊娠中の投与に関する安全性は確立していない。]
小児等への投与
低出生体重児,新生児,乳児,幼児又は小児に対する安全性は確立していない。
臨床検査結果に及ぼす影響
1.
テステープ反応を除くベネディクト試薬,フェーリング試薬,クリニテストによる尿糖検査では偽陽性を呈することがあるので注意すること。2.
直接クームス試験陽性を呈することがあるので注意すること。適用上の注意
薬剤交付時:PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により,硬い鋭角部が食道粘膜へ刺入し,更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
薬物動態
1.
血中濃度
(1)
健康成人
健康成人に100mg(力価)及び200mg(力価)を空腹時単回経口投与したときの血漿中濃度及び薬物動態パラメータを図1・表1に示す。Cmax,AUCはいずれも明瞭な用量比例性が認められた 2)。なお,食事により,Cmaxは低下し,T1/2は延長し,AUCは減少するなど影響を受けることがある 2),3)。
(2)
腎機能障害患者
腎機能障害患者に200mg(力価)を食後単回経口投与したときの血清中濃度及び薬物動態パラメータを図2・表2に示す。
腎機能の低下に伴い,T1/2は延長し,AUCは増加した 4)。
腎機能の低下に伴い,T1/2は延長し,AUCは増加した 4)。
2.
分布
喀痰,前立腺組織への移行は良好であった 5),6)。
なお,乳汁中への移行は認められなかった 7)。
なお,乳汁中への移行は認められなかった 7)。
3.
代謝
セフチブテンの活性代謝物として,7位側鎖の異性化したトランス体が,血漿中には血中濃度の約5%,尿中には投与量の約8%が検出された 2),8),9)。
4.
排泄
排泄は主として腎よりなされ,健康成人に100mg(力価)(n=9)及び200mg(力価)(n=21)を空腹時単回経口投与後の尿中排泄率は,12時間までの累積でそれぞれ71.5及び67.0%であった 2),3),10),11)。
5.
その他
血清蛋白結合率:健康成人での血清蛋白結合率は,血清中濃度0.8~16μg/mLの範囲で平均65.2%とほぼ一定であった 2)。
薬物動態の表
| 記号 | 投与量 〔mg(力価)〕 |
n | Cmax (μg/mL) |
Tmax (hr) |
AUC0-12 (μg・hr/mL) |
T1/2 (hr) |
| ○ | 100 | 6 | 5.6±0.7 | 2.8±0.9 | 23.1±3.1 | 1.5±0.2 |
| ● | 200 | 6 | 11.6±2.0 | 2.6±0.7 | 48.3±5.7 | 1.9±0.3 |
| 腎機能 | No. | Ccr (mL/min) |
Cmax (μg/mL) |
Tmax (hr) |
AUC0-∞ (μg・hr/mL) |
T1/2 (hr) |
| 正常群 | 1 | 131 | 13.76 | 0.76 | 38.70 | 1.93 |
| 正常群 | 2 | 90 | 9.14 | 3.25 | 45.63 | 1.17 |
| 中等度障害群 | 3 | 38.3 | 11.82 | 3.71 | 101.07 | 3.54 |
| 中等度障害群 | 4 | 31.4 | 6.67 | 6.76 | 117.70 | 6.88 |
| 高度障害群 | 5 | <10 | 13.01 | 2.53 | 324.54 | 18.24 |
| 高度障害群 | 6 | 6.8 | 8.37 | 3.70 | 586.14 | 28.88 |
| 高度障害群 | 7 | <10 | 16.93 | 0.89 | 423.84 | 16.12 |
臨床成績
1.
二重盲検比較試験
セファクロルを対照薬とし,慢性気道感染症及び複雑性尿路感染症を対象とした二重盲検比較試験において本剤の有用性が確認された 12),13)。
2.
一般臨床試験
承認時における一般臨床試験での有効性評価対象例は327例であり,有効率は77.1%(252例)であった 14)。
表3 臨床成績参照
臨床成績の表
| 疾患名 | 有効例数/有効性評価対象例数 | 有効率(%) |
| 急性気管支炎 | 11/14 | 78.6 |
| 慢性呼吸器病変の二次感染 | 120/158 | 75.9 |
| 膀胱炎(複雑性を除く) | 4/6 | - |
| 複雑性膀胱炎 | 52/69 | 75.4 |
| 腎盂腎炎 | 24/33 | 72.7 |
| 前立腺炎(急性に限る) | 25/27 | 92.6 |
| 尿道炎 | 16/20 | 80.0 |
薬効薬理
1.
薬理作用
抗菌作用
セフチブテンは,試験管内ではグラム陰性菌の淋菌,大腸菌,クレブシエラ属,プロテウス属,モルガネラ・モルガニー,プロビデンシア・レットゲリ,インフルエンザ菌に抗菌力を示し,エンテロバクター属,セラチア属にも抗菌力を示す。グラム陽性菌のブドウ球菌,腸球菌にはほとんど抗菌力を示さない。バクテロイデス・フラジリスの産生するβ-ラクタマーゼを除き,ペニシリナーゼ型及びセファロスポリナーゼ型のいずれのβ-ラクタマーゼにも安定である。
セフチブテンは,試験管内ではグラム陰性菌の淋菌,大腸菌,クレブシエラ属,プロテウス属,モルガネラ・モルガニー,プロビデンシア・レットゲリ,インフルエンザ菌に抗菌力を示し,エンテロバクター属,セラチア属にも抗菌力を示す。グラム陽性菌のブドウ球菌,腸球菌にはほとんど抗菌力を示さない。バクテロイデス・フラジリスの産生するβ-ラクタマーゼを除き,ペニシリナーゼ型及びセファロスポリナーゼ型のいずれのβ-ラクタマーゼにも安定である。
2.
作用機序
細菌の細胞壁合成を阻害することにより抗菌作用を発揮し,その作用は殺菌的である。
包装
セフテムカプセル100mg:PTP100カプセル(10カプセル×10)
セフテムカプセル200mg:PTP100カプセル(10カプセル×10)