|
【中文品名】头孢唑兰
【通用药名】Cefozopran
【别 名】
【CA 名 称】
Imidazo[1,2-b]pyridazinium, 1-[[(6R,7R)-7-[[(2Z)-(5-amino-1,2,4-thiadiazol-3-yl)(methoxyimino)acetyl]amino]-2-carboxy-8-oxo-5-thia-1-azabicyclo[4,2,0]oct-2-en-3-yl]methyl]-
【CA登记号】[113359-04-9]
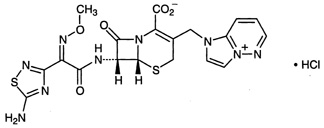
【结 构 式】

【分 子 式】C19H17N9O5S2
【中文品名】头孢唑兰盐酸盐
【通用药名】Cefozopran Hydrochloride
【别 名】
【CA 名 称】
Imidazo[1,2-b]pyridazinium, 1-[[(6R,7R)-7-[[(2Z)-(5-amino-1,2,4-thiadiazol-3-yl)(methoxyimino)acetyl]amino]-2-carboxy-8-oxo-5-thia-1-azabicyclo[4,2,0]oct-2-en-3-yl]methyl]-, monohydrochloride
【CA登记号】[113359-04-9]
【结 构 式】
【分 子 式】C19H17N9O5S2 . HCl
本品是由日本武田公司最先研究开发的第四代头孢菌素。1995年以Firstcin的商品名首次在日本上市,剂型为注射用粉针剂,规格为0.5g和1g。我国尚未进口该品,亦未见国内厂家的相关研究报道。按照《药品注册管理办法》,本品应属化药3(1)。
2、知识产权状况 本品未在中国申请专利,也没有申请行政保护,因此不存在知识产权问题。
3、该药在国外已批准及在临床研究中的适用症
日本厚生省药检局批准的临床适用症为:败血症,外伤创口感染,以及由G+、G-和绿脓杆菌等引起的各种感染。
4、上市剂型及用法用量
注射用粉针为0.5g和1g两种规格,可与生理食盐水或5%的葡萄糖注射液稀释为100ml:1g。
成人用量:一般情况为每天1-2g静脉注射或静脉滴注;重症患者每天最高可达4g,每天2-4次。
儿童(包括婴儿)用药:通常情况下每天20-80mg/kg,每天3-4次;重症患者每天最高可达160mg/kg,每天3-4次。
药理毒理作用及临床评价
头孢唑兰的特征有:
①对青霉素结合蛋白(PBPs)有高度亲和力。
②可通过G-性菌外膜孔道迅速扩散到细菌周质并维持高浓度。
③具较低的β-内酰胺酶亲和性与诱导性,对染色体介导的和部分质粒介导的β-内酰胺酶稳定。因而本品对G+菌、G-菌、厌氧菌显示广谱抗菌活性,与第三代头孢菌素相比,增强了抗G+菌活性,特别对链球菌、肺炎球菌等有很强活性。头孢唑兰对一般头孢菌素不敏感的粪链球菌、弗劳地枸橼酸杆菌、阴沟肠杆菌、绿脓杆菌亦有较强作用。
本品的毒性很低,小鼠LD50:静注>5000mg/kg。大鼠LD50:静注约5000mg/kg。生殖试验未见异常。
临床评价:在本品治疗的1604例各类感染中,治疗总有效率85.4%(1364/1604),其中对G+感染菌的清除率为88.8%,对G-菌的清除率为89.4%,对复合感染菌的清除率为79.0%。表明本品有良好的临床应用价值。
【原产地英文商品名】Firstcin 1g/vial 10vials/box
【原产地英文药品名】Cefozopran Hydrochloride
【中文参考商品译名】
注:以下产品不同规格和不同价格,购买时请以电话咨询为准!
·Firstcin 0.5克/瓶 10瓶/盒
·Firstcin 1克/瓶 10瓶/盒
【中文参考药品译名】盐酸头孢唑兰
【生产厂家中文参考译名】日本武田制药
【生产厂家英文名】Takeda (Japan)
Indications:
Bronchopulmonary Aspergillosis;Cord Blood Transplant Therapy;Infection Prophylaxis。
Side Effects:
Acute Graft Versus Host Disease In Skin;Alanine Aminotransferase Increased;Aspartate Aminotransferase Increased;Cerebral Haemorrhage;Engraftment Syndrome Hypertriglyceridaemia;Liver Disorder;Renal Disorder;Thrombotic Microangiopathy Trichosporon Infection; Urinary Sediment Abnormal
ファーストシン静注用0.5g/ファーストシン静注用1g/ファーストシン静注用1gバッグS/ファーストシン静注用1gバッグG
作成又は改訂年月
**2009年7月改訂(第12版)
*2006年12月改訂
日本標準商品分類番号
876132
日本標準商品分類番号等
再審査結果公表年月(最新)
2005年1月
再評価結果公表年月(最新)
2004年9月
効能又は効果追加承認年月(最新)
1998年12月
薬効分類名
セフェム系抗生物質製剤
承認等
販売名
ファーストシン静注用0.5g
販売名コード
6132426F1020
承認・許可番号
承認番号
20700AMZ00544
商標名
FIRSTCIN INTRAVENOUS 0.5Gm.
薬価基準収載年月
1995年8月
販売開始年月
1995年8月
貯法・使用期限等
貯法
室温保存。開封後も光を遮り保存すること。
使用期限
外箱に表示の使用期限内に使用すること。
(使用期限内であっても開封後はなるべく速やかに使用すること。)
基準名
*日本薬局方
注射用セフォゾプラン塩酸塩
規制区分
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
*1バイアル中の有効成分
セフォゾプラン塩酸塩 0.5g(力価)
添加物
無水炭酸ナトリウム103mg、塩化ナトリウム60mg
性状
性状
白色~淡黄色の粉末又は塊
pH
7.5~9.0(10mL注射用水にて溶解時)
浸透圧比(生理食塩液に対する比)
約2(10mL注射用水にて溶解時)
販売名
ファーストシン静注用1g
販売名コード
6132426F2026
承認・許可番号
承認番号
20700AMZ00545
商標名
FIRSTCIN INTRAVENOUS 1Gm.
薬価基準収載年月
1995年8月
販売開始年月
1995年8月
貯法・使用期限等
貯法
室温保存。開封後も光を遮り保存すること。
使用期限
外箱に表示の使用期限内に使用すること。
(使用期限内であっても開封後はなるべく速やかに使用すること。)
基準名
*日本薬局方
注射用セフォゾプラン塩酸塩
規制区分
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
*1バイアル中の有効成分
セフォゾプラン塩酸塩 1g(力価)
添加物
無水炭酸ナトリウム206mg、塩化ナトリウム120mg
性状
性状
白色~淡黄色の粉末又は塊
pH
7.5~9.0(20mL注射用水にて溶解時)
浸透圧比(生理食塩液に対する比)
約2(20mL注射用水にて溶解時)
販売名
ファーストシン静注用1gバッグS
販売名コード
6132426G3028
承認・許可番号
承認番号
21200AMZ00523
商標名
FIRSTCIN INTRAVENOUS 1Gm.BAG S
薬価基準収載年月
2000年11月
販売開始年月
2001年1月
貯法・使用期限等
貯法
室温保存。開封後も光を遮り保存すること。
使用期限
外箱に表示の使用期限内に使用すること。
(使用期限内であっても開封後はなるべく速やかに使用すること。)
基準名
*日本薬局方
注射用セフォゾプラン塩酸塩
規制区分
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
*1容器中の有効成分(用時溶解)
セフォゾプラン塩酸塩 1g(力価)
溶解液
生理食塩液100mL
添加物
無水炭酸ナトリウム206mg、塩化ナトリウム120mg
性状
性状
白色~淡黄色の粉末
pH
7.5~9.0(100mL生理食塩液にて溶解時)
浸透圧比(生理食塩液に対する比)
約1(100mL生理食塩液にて溶解時)
販売名
ファーストシン静注用1gバッグG
販売名コード
6132426G4024
承認・許可番号
承認番号
21200AMZ00522
商標名
FIRSTCIN INTRAVENOUS 1Gm.BAG G
薬価基準収載年月
2000年11月
販売開始年月
2001年1月
貯法・使用期限等
貯法
室温保存。開封後も光を遮り保存すること。
使用期限
外箱に表示の使用期限内に使用すること。
(使用期限内であっても開封後はなるべく速やかに使用すること。)
基準名
*日本薬局方
注射用セフォゾプラン塩酸塩
規制区分
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
*1容器中の有効成分(用時溶解)
セフォゾプラン塩酸塩 1g(力価)
溶解液
5%ブドウ糖注射液100mL
添加物
無水炭酸ナトリウム206mg、塩化ナトリウム120mg
性状
性状
白色~淡黄色の粉末
pH
7.5~9.0(100mL 5%ブドウ糖注射液にて溶解時)
浸透圧比(生理食塩液に対する比)
約2(100mL 5%ブドウ糖注射液にて溶解時)
禁忌
(次の患者には投与しないこと)
1.
本剤の成分によるショックの既往歴のある患者
2.
低張性脱水症の患者(5%ブドウ糖注射液添付のバッグGの場合)
[電解質を含まない糖液を投与すると脱水が増悪することがある。]
|
原則禁忌
(次の患者には投与しないことを原則とするが、特に必要とする場合には慎重に投与すること)
本剤の成分又はセフェム系抗生物質に対し過敏症の既往歴のある患者
|
効能又は効果
<適応菌種>
セフォゾプランに感性のブドウ球菌属、レンサ球菌属、肺炎球菌、腸球菌属、モラクセラ(ブランハメラ)・カタラーリス、大腸菌、シトロバクター属、クレブシエラ属、エンテロバクター属、セラチア属、プロテウス属、モルガネラ・モルガニー、プロビデンシア属、インフルエンザ菌、シュードモナス属、緑膿菌、バークホルデリア・セパシア、ステノトロホモナス(ザントモナス)・マルトフィリア、アシネトバクター属、ペプトストレプトコッカス属、バクテロイデス属、プレボテラ属
<適応症>
敗血症
外傷・熱傷及び手術創等の二次感染
咽頭・喉頭炎、扁桃炎(扁桃周囲膿瘍を含む)、肺炎、
肺膿瘍、膿胸、慢性呼吸器病変の二次感染
複雑性膀胱炎、腎盂腎炎、前立腺炎(急性症、慢性症)
腹膜炎、腹腔内膿瘍
胆嚢炎、胆管炎、肝膿瘍
子宮内感染、子宮付属器炎、子宮旁結合織炎
化膿性髄膜炎
眼窩感染、角膜炎(角膜潰瘍を含む)、眼内炎(全眼球炎を含む)
中耳炎、副鼻腔炎、化膿性唾液腺炎
用法及び用量
本剤の使用に際しては、投与開始後3日をめやすとしてさらに継続投与が必要か判定し、投与中止又はより適切な他剤に切り替えるべきか検討を行うこと。さらに、本剤の投与期間は、原則として14日以内とすること。
成人
通常、成人にはセフォゾプラン塩酸塩として1日1~2g(力価)を2回に分けて静脈内注射又は点滴静脈内注射する。
なお、年齢、症状に応じて適宜増減するが、難治性又は重症感染症には1日4g(力価)まで増量し、2~4回に分けて投与する。
小児
通常、小児には1日40~80mg(力価)/kgを3~4回に分けて静脈内注射又は点滴静脈内注射する。
なお、難治性又は重症感染症には1日160mg(力価)/kgまで増量し、3~4回に分けて投与する。化膿性髄膜炎には1日200mg(力価)/kgまで増量できる。ただし、成人における1日最大用量4g(力価)を超えないこととする。
新生児(低出生体重児を含む)
通常、新生児(低出生体重児を含む)には1回20mg(力価)/kgを0日齢(生後24時間未満)は1日1~2回、1(生後24時間以降)~7日齢は1日2~3回、8日齢以降は1日3~4回静脈内注射又は点滴静脈内注射する。
なお、重症又は難治性感染症には1回40mg(力価)/kgまで増量できる。
<静脈内注射の場合>
日局「注射用水」、日局「生理食塩液」又は日局「ブドウ糖注射液」に溶解して、緩徐に静脈内に注射する。
<点滴静脈内注射の場合>
糖液、電解質液又はアミノ酸製剤などの輸液に加えて、30分~2時間かけて静脈内に点滴注射する。
<バッグの場合>
バッグSは生理食塩液側を、バッグGは5%ブドウ糖注射液側をそれぞれ手で圧し、隔壁を開通させ、セフォゾプラン塩酸塩を溶解した後、30分~2時間かけて静脈内に点滴注射する。
用法及び用量に関する説明
<注射液の調製法>
◇バイアル品における調製法
静脈内注射に際しては静注用0.5gは通常10mLに、静注用1gは通常20mLに希釈して投与する。点滴静脈内注射を行う場合、注射用水を用いると溶液が低張となるため用いないこと。
◇バッグS及びバッグGにおける調製法
1)
溶解液部分を手で圧し、隔壁を開通させ、抗生剤部分と溶解液部分を交互に押して抗生剤を完全に溶解する。  2)
溶解を確認する。 
用法及び用量に関連する使用上の注意
1.
高度の腎障害(例えばクレアチニンクリアランス値:30mL/分以下等)のある患者には、投与量・投与間隔の適切な調節をするなど慎重に投与すること。(【薬物動態】の項参照)
2.
本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最少限の期間の投与にとどめること。
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
全製剤共通
(1)
ペニシリン系抗生物質に対し過敏症の既往歴のある患者
(2)
本人又は両親、兄弟に気管支喘息、発疹、蕁麻疹等のアレルギー症状を起こしやすい体質を有する患者
(3)
高度の腎障害のある患者
[本剤は主として腎臓から排泄されるため、高度の腎機能障害(例えばクレアチニンクリアランス値:30mL/分以下等)のある患者では高い血中濃度が持続することがある。](【薬物動態】の項参照)
(4)
高度の肝障害のある患者
[肝障害が悪化することがある。]
(5)
高齢者(「高齢者への投与」の項参照)
(6)
経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者
[ビタミンK欠乏症状があらわれることがあるので観察を十分に行うこと。]
5%ブドウ糖注射液添付のバッグGの場合
(1)
カリウム欠乏傾向のある患者
[ブドウ糖がカリウムと共に細胞内に取り込まれ、カリウム欠乏傾向を助長することがある。]
(2)
糖尿病の患者
[静脈内へのブドウ糖の投与により血糖値が急速に上昇する可能性がある。]
(3)
尿崩症の患者
[電解質を含まない糖液の投与により水分のみが負荷される。]
(4)
腎不全の患者
[電解質を含まない糖液の投与により水分のみが負荷される。]
生理食塩液添付のバッグSの場合
(1)
心臓、循環器系機能障害のある患者
[ナトリウムの負荷により障害が悪化することがある。]
(2)
腎障害のある患者
[ナトリウムの貯留を助長することがある。]
重要な基本的注意
1.
本剤によるショック、アナフィラキシー様症状の発生を確実に予知できる方法がないので、次の措置をとること。1)
(1)
事前に既往歴等について十分な問診を行うこと。なお、抗生物質等によるアレルギー歴は必ず確認すること。
(2)
投与に際しては、必ずショック等に対する救急処置のとれる準備をしておくこと。
(3)
投与開始から投与終了後まで、患者を安静の状態に保たせ、十分な観察を行うこと。特に、投与開始直後は注意深く観察すること。
2.
本剤投与前に感受性の確認が行えなかった場合、本剤投与開始後3日をめやすとして本剤に対する感受性を確認し、本剤投与が適正であるか判断すること。なお、本剤に感受性が認められない場合、速やかに他の薬剤に変更すること。
3.
患者の状態などから判断して、7日以上にわたって本剤を投与する場合には、その理由を常時明確にし、発疹の出現や肝機能異常等の副作用に留意し、漫然とした継続投与は行わないこと。
4.
新生児(低出生体重児を含む)に投与する場合は、日齢に応じた1日投与回数にすること。
相互作用
併用注意
(併用に注意すること)
薬剤名等
利尿剤 フロセミド 等
臨床症状・措置方法
他のセフェム系抗生物質で併用による腎障害増強作用が報告されているので、併用する場合には腎機能に注意すること。
機序・危険因子
機序は不明であるが、利尿時の脱水による血中濃度の上昇等が考えられている。
副作用
副作用等発現状況の概要
承認時までの調査では、2,548例中447例(17.5%)に、市販後の使用成績調査(再審査終了時点)では、8,779例中738例(8.4%)に臨床検査値の異常を含む副作用が認められている。
以下の副作用は上記の調査あるいは自発報告等で認められたものである。
重大な副作用
1.
ショック、アナフィラキシー様症状(0.1%未満)を起こすことがあるので、観察を十分に行い、不快感、口内異常感、眩暈、便意、耳鳴、発汗、喘鳴、呼吸困難、血管浮腫、全身の潮紅・蕁麻疹等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
2.
急性腎不全等の重篤な腎障害(0.1%未満)があらわれることがあるので、定期的に検査を行うなど観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
3.
汎血球減少、無顆粒球症(0.1%未満)、また、顆粒球減少(0.1~5%未満)があらわれることがあり、また、他のセフェム系抗生物質で溶血性貧血があらわれることが報告されているので、観察を十分に行い、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
4.
偽膜性大腸炎等の血便を伴う重篤な大腸炎(0.1%未満)があらわれることがある。腹痛、頻回の下痢があらわれた場合には直ちに投与を中止するなど適切な処置を行うこと。
5.
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎、PIE症候群(0.1%未満)等があらわれることがあるので、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
6.
皮膚粘膜眼症候群(Stevens-Johnson症候群)、中毒性表皮壊死症(Lyell症候群)(0.1%未満)があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
7.
痙攣(頻度不明)等の中枢神経症状があらわれることがある。特に、腎不全患者にあらわれやすい。(<用法・用量に関連する使用上の注意>の項参照)
8.
DIC(0.1%未満)があらわれることがある。
9.
AST(GOT)、ALT(GPT)の著しい上昇等を伴う肝炎、肝機能障害、黄疸(0.1%未満)があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
その他の副作用
過敏症注2)
0.1~5%未満
発疹、蕁麻疹、紅斑、そう痒、発熱
過敏症注2)
0.1%未満
リンパ腺腫脹、関節痛
血液
0.1~5%未満
貧血、好酸球増多、血小板減少、血小板増多
肝臓
5%以上
AST(GOT)、ALT(GPT)の上昇
肝臓
0.1~5%未満
AL-P、LDH、γ-GTPの上昇
消化器
0.1~5%未満
悪心、嘔吐、食欲不振、腹痛、腹部膨満感、下痢
菌交代症
0.1%未満
口内炎、カンジダ症
ビタミン欠乏症
0.1%未満
ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等)
その他
0.1~5%未満
高カリウム血症、血清アミラーゼ上昇
その他
0.1%未満
頭痛、けん怠感
その他の副作用の注意
注2)このような場合には投与を中止し適切な処置を行うこと。
高齢者への投与
次の点に注意し、高度の腎機能障害(例えばクレアチニンクリアランス値:30mL/分以下等)のある患者では、投与回数を1日1回に減ずるなど投与間隔等に留意し、患者の状態を観察しながら慎重に投与すること。
(1)
高齢者では生理機能が低下していることが多く副作用が発現しやすい。
(2)
高齢者では腎機能が低下していることが多く、本剤は主として腎臓から排泄されるため、高度の腎機能障害(例えばクレアチニンクリアランス値:30mL/分以下等)のある患者では高い血中濃度が持続することがある。
(3)
高齢者ではビタミンK欠乏による出血傾向があらわれることがある。
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には治療上の有益性が危険性を上まわると判断される場合にのみ投与すること。
[妊娠中の投与に関する安全性は確立していない。]
小児等への投与
新生児(低出生体重児を含む)、特に0日齢では腎機能が未熟なため血中濃度の半減期が延長し、高い血中濃度が長時間持続するおそれがあるので日齢に応じた1日投与回数にすること。
臨床検査結果に及ぼす影響
1.
テステープ反応を除くベネディクト試薬、フェーリング試薬、クリニテストによる尿糖検査では偽陽性を呈することがあるので注意すること。
2.
直接クームス試験陽性を呈することがあるので注意すること。
適用上の注意
1.
投与経路
本剤は静脈内注射にのみ使用すること。
2.
投与方法
静脈内大量投与により、まれに血管痛、血栓性静脈炎を起こすことがあるので、これを予防するために注射液の調製、注射部位、注射方法等について十分注意し、その注射速度はできるだけ遅くすること。
3.
溶解後
溶解後は速やかに使用すること。なお、やむを得ず保存を必要とする場合でも12時間以内に使用すること。
4.
配合変化
本剤はブロムヘキシン塩酸塩製剤と配合すると配合直後に混濁が起こることがあり、ジフェンヒドラミン塩酸塩・臭化カルシウム製剤と配合すると1時間以内に混濁が起こることがあるので、これらの製剤との配合は避けること。また、フルオロウラシル製剤と配合すると2時間以内に、クリニタミン注と配合すると6時間以内に残存力価が90%以下になることがあるので、配合後は速やかに使用すること。
なお、本剤と他剤とを配合使用したとき、一般にpHが8以上では、力価の低下が促進されることがあるので、使用に際しては注意すること。
5.
バッグS及びバッグGは、分割投与しないこと。
その他の注意
ときに尿やおむつが着色(赤色~濃青色)することがある(代謝物による)。
薬物動態
1.
血中濃度2~5)
腎機能正常の成人及び小児に静注あるいは点滴静注して得られた血中濃度は図1~4のとおりであり、用量依存性を示す。 また、腎機能正常の1日齢以降の低出生体重児を含む新生児に静注して得られた血中濃度は図5のとおりであり用量依存性を示す。なお、1回20mg/kgでの静注と30分点滴静注との血中薬物動態について比較した結果、血中濃度推移、血中濃度半減期共にほとんど差は認められていない。   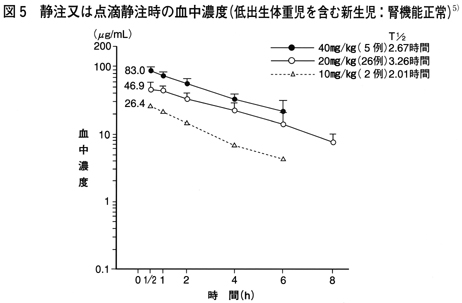 2.
排泄2~5)
主として腎より排泄され、成人(腎機能正常者)に1回0.5、1、2g静注あるいは点滴静注後6時間までの尿中排泄率は72~85%である。また、1gを静注後の尿中濃度は0~2時間で約4,200μg/mL、2~4時間で約1,800μg/mL、4~6時間で約750μg/mLである。
また、小児(腎機能正常者)に1回10、20、40mg/kg静注後6時間までの尿中排泄率は69~85%であり、1日齢以降の低出生体重児を含む新生児(腎機能正常者)に1回10、20、40mg/kg静注後6時間までの尿中排泄率は28~62%である。
3.
体液・組織内移行
肺組織6)、喀痰7)、胆汁8)、胆嚢組織9)、腹腔内滲出液10)、腹壁腹膜10)、創部滲出液11)、膿汁10)、前立腺12)、女性性器組織13)、扁桃14)、耳漏15)、鼻汁16)等の耳鼻咽喉組織、涙液17)及び髄液3)等への移行が認められている。なお、乳汁中13)へもわずかに移行する。
4.
代謝2,18~20)
血中及び尿中には抗菌活性代謝物質は認められていない。
健康成人の2g単回静注後の尿について、カラムクロマトグラフィーによる着色物質の検索を行った結果、尿着色(赤色)物質は極微量であり、単離同定には至らなかったが、本剤に由来する微量の代謝物(分解物)であると考えられる。
なお、ラット及びイヌに1,000mg/kg/日、サルに300mg/kg/日を反復静脈内投与した際の尿を薄層クロマトグラフィーで分析したところ、ラット尿中には濃青色成分が、イヌ尿中には赤色成分が、サルには両成分が認められている。
5.
腎機能障害時の血中濃度、尿中排泄21)
腎機能の低下に伴い、血中濃度の上昇、血中濃度半減期の延長及び尿中排泄率の低下が認められる(図6)。従って、腎機能障害者に本剤を投与する場合には、投与量、投与間隔の適切な調節が必要である。  臨床成績
1.
成人感染症
市販後の使用成績調査4,917例についての成績概要は表1のとおりである。
2.
小児・新生児感染症
市販後の使用成績調査782例についての成績概要は表2のとおりである。
表1 疾患別臨床効果(成人)
| 感染症 |
有効率(有効以上)
例数 |
有効率(有効以上)
% |
| 敗血症 |
159/249 |
63.9 |
| 外傷・熱傷及び手術創等の二次感染 |
327/428 |
76.4 |
| 咽頭・喉頭炎 |
4/6 |
- |
| 扁桃炎(扁桃周囲膿瘍を含む) |
195/203 |
96.1 |
| 肺炎 |
1,301/1,703 |
76.4 |
| 肺膿瘍 |
10/19 |
52.6 |
| 膿胸 |
15/29 |
51.7 |
| 慢性呼吸器病変の二次感染 |
355/461 |
77.0 |
| 複雑性膀胱炎 |
152/184 |
82.6 |
| 腎盂腎炎 |
443/491 |
90.2 |
| 前立腺炎(急性症、慢性症) |
106/118 |
89.8 |
| 腹膜炎 |
225/274 |
82.1 |
| 腹腔内膿瘍 |
5/8 |
- |
| 胆嚢炎 |
93/115 |
80.9 |
| 胆管炎 |
71/106 |
67.0 |
| 肝膿瘍 |
6/12 |
50.0 |
| 子宮内感染 |
75/94 |
79.8 |
| 子宮付属器炎 |
53/55 |
96.4 |
| 子宮旁結合織炎 |
44/55 |
80.0 |
| 化膿性髄膜炎 |
49/60 |
81.7 |
| 眼窩感染 |
34/35 |
97.1 |
| 角膜炎(角膜潰瘍を含む) |
62/74 |
83.8 |
| 眼内炎(全眼球炎を含む) |
27/38 |
71.1 |
| 中耳炎 |
23/24 |
95.8 |
| 副鼻腔炎 |
44/54 |
81.5 |
| 化膿性唾液腺炎 |
20/22 |
90.9 |
| 計 |
3,898/4,917 |
79.3 |
表2 疾患別臨床効果(小児・新生児)
| 感染症 |
有効率(有効以上)
例数 |
有効率(有効以上)
% |
| 敗血症 |
47/64 |
73.4 |
| 外傷・熱傷及び手術創等の二次感染 |
10/10 |
100 |
| 咽頭・喉頭炎 |
1/1 |
- |
| 扁桃炎(扁桃周囲膿瘍を含む) |
64/66 |
97.0 |
| 肺炎 |
433/490 |
88.4 |
| 肺膿瘍 |
0/1 |
- |
| 慢性呼吸器病変の二次感染 |
27/32 |
84.4 |
| 複雑性膀胱炎 |
1/2 |
- |
| 腎盂腎炎 |
39/39 |
100 |
| 腹膜炎 |
4/6 |
- |
| 胆管炎 |
1/1 |
- |
| 肝膿瘍 |
1/1 |
- |
| 化膿性髄膜炎 |
17/20 |
85.0 |
| 眼窩感染 |
1/1 |
- |
| 中耳炎 |
39/40 |
97.5 |
| 副鼻腔炎 |
2/3 |
- |
| 化膿性唾液腺炎 |
5/5 |
- |
| 計 |
692/782 |
88.5 |
薬効薬理
1. 抗菌作用 22~26)
(1)
グラム陽性菌及びグラム陰性菌に広い抗菌作用を示し、特にブドウ球菌属、レンサ球菌属、腸内細菌科の各種細菌、インフルエンザ菌に強い抗菌力を示す。
また、多くのセフェム系抗生物質に耐性を示す腸球菌、緑膿菌に対しても比較的強い抗菌力を示す。
(2)
抗菌作用は殺菌的で、最小発育阻止濃度で殺菌作用を示す。
2. 作用機序 26~28)
細菌の細胞壁の合成を阻害する。本剤がグラム陽性菌及び陰性菌に対して強い抗菌力を示すのは、β-ラクタマーゼに対して安定であり、黄色ブドウ球菌ではペニシリン結合蛋白質1及び2に、大腸菌及び緑膿菌ではペニシリン結合蛋白質3に対する親和性が高いため細胞壁peptidoglycan架橋形成阻害作用が強いことによると考えられる。
有効成分に関する理化学的知見
化学構造式
*一般名
セフォゾプラン塩酸塩(Cefozopran Hydrochloride)[JAN]
略号
CZOP
*化学名
(6R,7R)-7-[(Z)-2-(5-Amino-1,2,4-thiadiazol-3-yl)-2-(methoxyimino)acetylamino]-3-(1H-imidazo[1,2-b]pyridazin-4-ium-1-ylmethyl)-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate monohydrochloride
分子式
C19H17N9O5S2・HCl
分子量
551.99
融点(分解)
温度の上昇と共に褐変し、180℃付近で発泡し、200℃付近で炭化するため、明確な融点及び分解点を示さない。
性状
セフォゾプラン塩酸塩は白色~微黄色の結晶又は結晶性の粉末である。ジメチルスルホキシド又はホルムアミドに溶けやすく、水、メタノール又はエタノール(95)に溶けにくく、アセトニトリル又はジエチルエーテルにほとんど溶けない。
*力価
セフォゾプラン(C19H17N9O5S2)としての重量(力価)で示す。セフォゾプラン塩酸塩標準品の1mgは0.934mg(力価)に対応する。
取扱い上の注意
【注意】
バッグS及びバッグGの場合
(1)
製品の品質を保持するため、本品を包んでいる外袋は使用時まで開封しないこと。
(2)
次の場合には使用しないこと。
1)
外袋が破損しているときや溶解液が漏出しているとき。
2)
隔壁の開通前に抗生物質が溶解しているとき。
3)
抗生物質が変色しているときや溶解液が着色しているとき。
(3)
容器の液目盛りはおよその目安として使用すること。
0.5g(力価): 10バイアル
1g(力価): 10バイアル
1gバッグS(生理食塩液添付): 10キット
1gバッグG(5%ブドウ糖注射液添付): 10キット
製造販売元
武田薬品工業株式会社 |