|
STERITALC® consists of talcum which is mined in France and is specifically processed for medical use (talcum pleurodesis).
STERITALC® is suited for all indications of pleurodesis. It is non-soluble and induces permanent pleurodesis. Compared with tetracyclines, talcum is more effective and less painful.
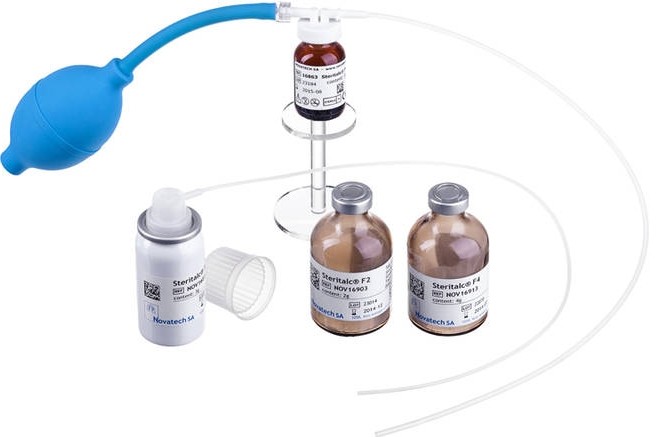
As a rule, for malignant indications 3 to 5 g are used, for treatment of spontaneous pneumothorax 2 g are sufficient in most cases.
A critical side effect of talcum pleurodesis can be ARDS (Acute Respiratory Distress Syndrome). A possible cause of ARDS may be the systemic dissemination of talcum. In some cases, after application in the pleural cavity, talcum was found in other organs (kidneys, spleen, liver), too. The literature assumes that there is a relation between the talcum particle size and the systemic dissemination of talcum: smaller talcum particles appear to disseminate more than larger ones (1). The clinical picture also shows the effect of different particle sizes: talcum with a mean particle size below 15 µm induced stronger systemic and pulmonary inflammation reactions than talcum with a mean particle size of 25 µm (2).
STERITALC®, produced by Novatech, is specifically calibrated to a mean particle size of 25 µm in order to avoid systemic dissemination. Animal (3) and clinical studies (2) show the lesser systemic dissemination.
A multi-center study showed that STERITALC® with its calibrated particle size can be safely used for pleurodesis of malignant pleural effusions. None of more than 550 patients developed ARDS (4). The authors recommend to use no other talcum.
Another cause of ARDS may be a sepsis due to unsterile talcum, or talcum containing endotoxines (5). This, too, can be excluded when STERITALC® is used, because STERITALC® is free of endotoxines and comes sterile.
ユニタルク胸膜腔内注入用懸濁剤4g
一般的名称
タルク胸膜腔内注入用
警告
本剤の投与により急性呼吸窮迫症候群があらわれ、死亡に至った例も報告されている。急速に進行する呼吸困難等の臨床症状に注意するとともに、胸部X線検査の実施等、観察を十分に行い、異常が認められた場合には適切な処置を行うこと。〔「慎重投与」、「重要な基本的注意」、「重大な副作用」の項参照〕
禁忌
(次の患者には投与しないこと)
本剤又はタルクに対し過敏症の既往歴のある患
効能又は効果
悪性胸水の再貯留抑制
効能又は効果に関連する使用上の注意
本剤は悪性胸水の再貯留抑制のために使用し、腹水の減少を目的として本剤を使用しないこと。
用法及び用量
通常、成人には、本剤(4g/バイアル)を日局生理食塩液50mLで懸濁して、胸膜腔内に注入する。
用法及び用量に関連する使用上の注意
1. 両側悪性胸水に対して、両側肺の胸膜腔内に本剤を同時投与した場合の有効性及び安全性は確立していない。また、片側胸膜腔内に本剤を投与した後、本剤を対側胸膜腔内に投与した場合の有効性及び安全性は確立していない。
2. 同側肺の胸膜腔内に本剤を追加投与(ドレナージチューブ抜管前)又は再投与した場合の有効性及び安全性は確立していない。
3. 本剤と他の胸膜癒着剤との併用投与に関する有効性及び安全性は確立していない。
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
肺機能障害のある患者又は心機能障害のある患者〔呼吸不全等が発現するおそれがある。〕
重要な基本的注意
胸膜生検と同時又は直後に本剤を胸膜腔内に注入することは避けること。〔呼吸不全等が発現するおそれがある。〕
副作用
悪性胸水が貯留した患者を対象とした国内第II相試験において安全性を評価した30例中、副作用(臨床検査値異常を含む)発現症例は27例(90.0%)で、主な副作用は、CRP増加24例(80.0%)、発熱16例(53.3%)、ALT(GPT)増加5例(16.7%)、AST(GOT)増加4例(13.3%)、LDH増加4例(13.3%)、Al-P増加4例(13.3%)、便秘4例(13.3%)、倦怠感4例(13.3%)、頭痛3例(10.0%)、アルブミン減少3例(10.0%)、カリウム増加3例(10.0%)であった。(承認時)
重大な副作用
急性呼吸窮迫症候群 急性呼吸窮迫症候群(頻度不明注1)があらわれることがあるので、観察を十分に行い、急速に進行する呼吸困難、低酸素症、両側性びまん性肺浸潤影等の胸部X線異常等が認められた場合には適切な処置を行うこと。
その他の副作用
次のような副作用があらわれた場合には、症状に応じて適切な処置を行うこと。
分類/頻度 10%以上 3~10%未満 頻度不明注1
感染症 肺炎、皮膚感染 創傷感染、敗血症
新生物 癌疼痛
代謝・栄養 食欲減退
精神・神経 頭痛 錯乱状態
心・血管 潮紅、低血圧 うっ血性心不全、徐脈性不整脈
呼吸器 呼吸困難、口腔咽頭痛 呼吸不全、呼吸抑制、肺水腫、膿胸、肺塞栓症、気胸
消化器 便秘 悪心、嘔吐、下痢、痔核
皮膚・皮下組織 そう痒症、皮下気腫
筋骨格 背部痛、筋骨格硬直
全身・投与局所 発熱、倦怠感 胸部不快感、胸痛、熱感、疼痛、体重減少
臨床検査 ALT(GPT)増加、AST(GOT)増加、アルブミン減少、カリウム増加、LDH増加、CRP増加、Al-P増加 カリウム減少、BUN増加、Ht減少、Hb減少、白血球数増加、血小板数増加
注1:国内外の公表論文に基づく副作用については頻度不明とした。
妊婦、産婦、授乳婦等への投与
1. 妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。〔妊娠中の投与に関する安全性は確立していない。〕
2. 授乳中の婦人に投与する場合には授乳を中止させること。〔授乳中の投与に関する安全性は確立していない。〕
小児等への投与
小児等に対する安全性は確立していない。〔使用経験がない。〕
過量投与
1. 症状 10gを超えるタルクを投与した場合に、急性呼吸不全(急性呼吸窮迫症候群等)の発現率が高くなることが報告されている1)。
2. 処置 過剰に投与された本剤は日局生理食塩液による洗浄によって部分的に除去することが可能である。
適用上の注意
1. 投与(注入)経路 本剤は胸膜腔内注入のみに使用し、他のいかなる注射経路(静脈内、筋肉内、皮下、皮内等)にも投与しないこと。また、本剤を懸濁液としないで直接胸膜腔内に噴霧する方法では、使用しないこと。
2. 調製方法 本剤の使用にあたっては、「取扱い方法」を熟読すること。
3. 投与(注入)方法 懸濁液の吸引及び注入には、添付の採液針及びシリンジを用いること。
(1) 注入前・十分な胸水のドレナージを行い、十分な肺の再膨張を認めた後に本剤を胸膜腔内に注入すること。
・胸水のドレナージには、薬液注入用の側管付き胸部排液用カテーテルを用いること。
(2) 注入時・本剤の懸濁液は、注入直前によく振とうし、本剤の粒子を分散させること。
・懸濁液を胸膜腔内に緩徐に注入すること。
(3) 注入後・カテーテルの薬液注入用の側管より、懸濁液注入と同じ注入速度で、日局生理食塩液50mLを用いてフラッシュし、カテーテルをクランプすること。
・クランプ後、懸濁液を胸膜腔内に行き渡らせるように、可能な姿勢の範囲で15分毎に、クランプを外すまで患者の体位を変換することが望ましい。
・注入2時間後にクランプを開放し、低圧持続吸引器を用いて陰圧(目安:-10cmH2O)で胸水を持続吸引し、1日の排液量が150mL以下(目安)になったら抜管すること。
・バイアルは1回限りの使用とし、使用後は廃棄すること。
その他の注意
コルチコステロイドを全身投与されている患者では、胸膜癒着が起こりにくいことが報告されている2)。
薬物動態
ヒトでの本剤の薬物動態は不明である。
(参考)ラットに本剤を400mg/kg左側胸膜腔内に投与したとき、投与後1及び7日にタルク粒子の大部分は胸膜腔内に残留し、胸腔内臓器(投与側及び反対側の肺及び胸壁、心臓並びに横隔膜)への分布が認められた。タルク粒子は脳、肝臓、脾臓、腎臓、膵臓及び血液中には認められず、また尿及び糞中への排泄は認められなかった3)。
イヌに本剤を200及び800mg/kg左側胸膜腔内に投与したとき、投与後28日にタルク粒子の大部分は胸膜腔内に残留し、投与側及び反対側の肺に分布が認められた。投与後28日の肝臓、腎臓及び投与後1日の血液中にはタルク粒子は認められなかった4)。
臨床成績
国内第II相試験 悪性胸水が貯留した患者30例を対象として、胸水を排液した後、本剤4gの懸濁液を胸膜腔内に注入した。本剤注入後30日(又は中止時)に30例中25例(83.3%)で悪性胸水の再貯留の抑制が認められた5)。
薬効薬理
1. 胸膜癒着作用 ラット、ウサギ及びイヌの胸膜腔内にタルクを投与することにより、胸膜癒着作用が認められた6~8)。
2. 作用機序 タルクが胸膜癒着を惹起する作用機序は十分に解明されていないが、タルク投与による胸膜腔内の炎症状態が誘因となり、胸水中にTGF-β、TNF-α、IL-1、IL-8等が分泌され、コラーゲン線維が形成されることにより臓側胸膜と壁側胸膜の癒着が起こると考えられている9~11)。
有効成分に関する理化学的知見
一般名タルク、Talc
性状 タルクは粉砕、選別した天然含水ケイ酸マグネシウムである。純粋なタルクは、Mg3Si4O10(OH)2(分子量:379.27)である。タルクは白色~灰白色の微細な結晶性の粉末で、なめらかな触感があり、皮膚につきやすい。水又はエタノール(99.5)にほとんど溶けない。
包装
ユニタルク胸膜腔内注入用懸濁剤4g:1バイアル
〔添付:採液針注21個及びシリンジ注31個〕
注2:ツートック(医療機器届出番号:27B1X00045000021)
注3:ニプロシリンジ(医療機器届出番号:27B1X00045000033)
生产厂家:
Nobel Pharma Co., Ltd.
完整资料附件[供使用者阅读]:http://www.info.pmda.go.jp/go/pack/4299405D1022_1_01/4299405D1022_1_01?view=body |



