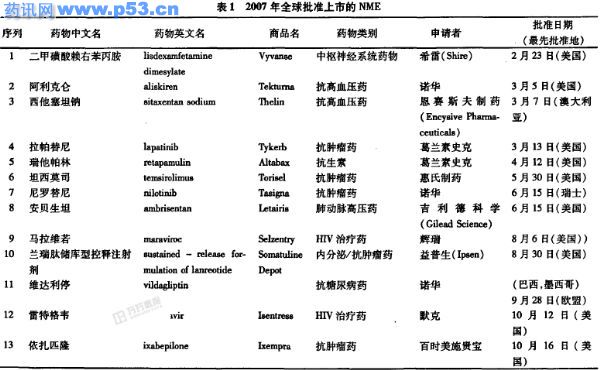
2007年,全球批准上市的新分子实体(New Molecular Entity , NME )13个(见表1)和新生物药品(New Biologic)6个(见表2),共19个。其中,抗肿瘤药7个,抗感染药3个,抗高血压药3个,影响血液及造血系统的药物2个,中枢神经系统药物1个,抗糖尿病药1个,内分泌类药1个和抗禽流感药1个。美国FDA网页上的“CDER New Molecular Entity (NME) Drug and New Biologic Approvals in Calendar Year2007”表中列出的罗替高停(rotigotine,商品名:Neupro)和多利培南(doripenem,商品名:Doribax)两药普通制剂分别己在2006年3月(欧洲)和2005年7月(日本)上市,故不列入本文表1。值得注意的是,2003年5月20日我国授予法国博福益普生制药有限公司的醋酸兰瑞肽( Lanreotide Acetate)注射用粉针(Somatuline Powder for Injection)药品行政保护,而上述美国FDA网页所列的表将兰瑞肽储库型控释注射剂(商品名: Somatuline Depot)列为NME,本文也将其列入表1。
 1 1

抗肿瘤药
1. 1、拉帕替尼(lapatinib)片
葛兰素史克公司的拉帕替尼片(商品名:Tykerb)与卡培他滨(capecitabine,商品名:Xeloda)联合用药治疗过度表达HER2的肿瘤和先前用蒽环霉素(anthracycline )、紫杉碱和曲妥珠单抗(trastuzumab)等药物治疗过的晚期或转移性乳腺癌患者。本品是首个一日1次靶向治疗这类疾病的药品。剂量规格:拉帕替尼250 mg/片。
用拉帕替尼治疗晚期HER2 ( ErbB2)阳性乳房癌女性患者是一重大突破。研究数据表明,此小分子靶向治疗口服药品与卡培他滨合用可治疗肿瘤恶化和先前用蒽环霉素、紫杉碱和曲妥珠单抗等药物治疗过的女性患者。
本品是研究人员16年之久的辛勤研究成果,这其中包括50多项的临床研究以及众多协同开发的结晶。在肿瘤学上,已验证拉帕替尼靶向抑制与癌症细胞增殖和肿瘤生长相关的EGFR ( ErbB1)和HER2( ErbB2)受体。作为靶向治疗,拉帕替尼设计用于干扰肿瘤细胞分裂变化的过程或肿瘤恶化的机制。
拉帕替尼系一NME,通过多种靶向途径抑制肿瘤生长。较大蛋白质分子单克隆抗体曲妥珠单抗靶向作用于肿瘤细胞外HER2蛋白,而小分子拉帕替尼可进人肿瘤细胞内阻断它和其它蛋白质的功能。由于两药的作用机制不同,故联合用药治疗HER2乳腺癌是“最佳拍档”。
据预测,拉帕替尼的销售峰值可超过30亿美元。
本品获准上市是基于对399例患者关键的Ⅲ期临床研究结果:拉帕替尼与卡培他滨合用治疗先前以曲妥珠单抗和其它抗癌药治疗过的晚期或转移性 HER2( ErbB2)阳性乳房癌女性患者平均存活时间为27.1 wk,而单一以卡培他滨治疗为18.6 wk。风险比(Hazard ration)为0. 57,即联合用药可减少43%患者肿瘤恶化的危险。
1.2、尼罗替尼(nilotinib)片
瑞士在全世界范围内率先批准诺华公司的强效和新型的靶向治疗药尼罗替尼口服片剂(商品名:Tasigna)上市,用于治疗对甲磺酸伊马替尼(商品名:Glivec)治疗无效或不能耐受威胁生命的血癌慢性粒细胞白血病(CML)。剂量规格:尼罗替尼300 mg/片,400 mg/片。
尼罗替尼是新一代口服酪氨酸激酶抑制药,一日2次,通过靶向作用于Bcr-Ab1蛋白抑制含有异常染色体癌细胞的产生。含有异常费城染色体的细胞产生Bcr-Ab1蛋白,被认为是造成CML患者体内过度产生形成癌症白细胞的关键因素。
1.3、坦西莫司(temsirolimus)注射剂
惠氏公司惠氏制药子公司的坦西莫司注射剂(商品名:Torisel ),用于治疗晚期肾细胞癌。剂量规格:坦西莫司25mg/瓶。坦西莫司注射剂是首个雷帕霉素哺乳动物靶(mammalian target of rapamycin ,mTOR)蛋白抑制剂靶向治疗肾癌的药品,临床证明在增加平均总成活率方面比α干扰素更显著。
肾细胞癌约占肾癌的85 %。美国癌症协会估计2008年将新诊断出51190例肾癌,这些患者中有40%以上初次诊断己是晚期症状。坦西莫司是已上市的唯一可特异性抑制mTOR激酶(细胞内调节细胞增生、细胞生长和细胞存活的关键蛋白质)的药品。
在对626例先前未接受过全身性治疗、预后差的晚期肾细胞癌患者进行的Ⅲ期临床研究结果显示,坦西莫司较α干扰素显著(49%)增加平均总成活率(10.9个月对7.3个月,P=0.0078 }。坦西莫司还在统计学上较α干扰素显著改善无疾病加重存活的第二终点指标(5. 5个月对3. 1个月,p=0.0001}。将坦西莫司和α干扰素联合用药与单独使用α干扰素相比并不显著增加总存活率。坦西莫司作为肿瘤学治疗新途径的mTOR抑制剂,展现了惠氏公司开发创新肿瘤药物新的里程碑。该公司现还正在进行坦西莫司治疗其它5种肿瘤的临床研究。
1. 4、基因纳米粒注射剂
伊佩尤斯生物技术(Epeius Biotechnologies})公司的载专利突变细胞周期控制基因(即抗癌基因)纳米粒注射剂(商品名:Rexin-G),静脉输注可安全有效地针对肿瘤靶向给药广谱治疗顽固的癌症。开发作为主动寻找并摧毁转移性癌症的肿瘤靶向抗癌药,Rexin-G对包括靶向生物剂在内的其它药品治疗失败的患者呈现单药空前有效。然而,Rexin-G临床典型病例证明其安全,实际消除了常规化疗毒性,因而提高了患者的生活质量。本品是全世界范围内首个获准上市的载基因药品(2003年美国FDA批准其为治疗胰腺癌的罕用药物)、对人体实际有效的靶向基因释药系统。
以纳米粒释放致命部件是“趋病理”的,即它特异地靶向疾病组织。趋病理靶向让Rexin-G寻找和摧毁在人体任何部位的肿瘤,因而减少肿瘤对人体的危害,延长患者存活期,改善患者的生活质量。
目前,Rexin-G已供菲律宾医生及其患者使用,并还将向欧洲和日本申请上市,下一步扩展到东盟(ASEAN)国家。伊佩尤斯生物技术公司竭力在今后几年内通过安全性研究后注册上市,该公司正在圣马力诺、圣莫尼卡和加利福尼亚三地对耐化疗药物的胰腺癌、乳腺癌和肉瘤进行3项Ⅰ/Ⅱ期临床研究。根据本品单一药物空前有效和总的安全性,美国FDA新近批准其治疗包括儿童和青少年在内的骨肉瘤患者Ⅱ期临床研究。
1 .5、宫颈癌疫苗
葛兰素史克公司的癌症疫苗Cervarix,用于防治10-45岁女性人乳头瘤病毒引起的宫颈癌和癌症前期的损伤。
Cervarix在澳大利亚获准上市是朝着根除宫颈癌迈进的一个重要里程碑,也是葛兰素史克公司的宫颈癌疫苗在第一个大市场获准上市。尤其是它作用明确且适用于世界各地有关年龄段妇女的首个宫颈癌疫苗。此疫苗预示着在预防宫颈癌上的一个重大科学突破,显示葛兰素史克公司已跨入新型疫苗研发的行列。此疫苗成为驱动葛兰素史克公司“未来发展”的动力。
Cervarix以称为AS04新型的专利佐剂系统(设计增强免疫反应和延长防护的持续时间)制成制剂。已报道的数据显示,此佐剂制剂与普通单独使用氢氧化铝佐剂相似疫苗处方相比较,免疫反应更强,持续作用时间更长。
Cervarix已在全球90个地方进行了治疗宫颈癌关键的Ⅲ期临床研究,瞄向两种类型造成70%患宫颈癌的人乳头瘤病毒—— HPV-16和HPV-18。该疫苗采用Corixa公司最强效免疫刺激剂之一的细菌内毒素衍生物单磷脂酰脂A佐剂,使体内产生很高的抗体浓度。对1113例15-25岁女性进行的研究显示,本品抗偶发感染的有效率为91.6%,抗HPV-16和HPV-16/18持续感染的有效率达100%。
据预测,该疫苗上市后有可能成为年销售额达10亿美元的畅销药品。
1.6、脑癌疫苗
瑞士批准西北生物治疗(Northwest Biotherapeutics)公司的世界首个治疗脑癌疫苗上市,商品名为DCVax-Brain。
脑癌可能发生在人的各个年龄段,是20岁以下儿童癌症死亡的主要原因。.脑癌是致死最快的癌症:治疗受限,即使新诊断出的患者平均存活期也仅14.6个月。在临床研究中,新诊断出和复发的脑癌患者用DCVax-Brain脑癌疫苗治疗后的存活期(新诊断出的患者超过33个月,因仍存活着尚未获得中位数数据)是未采用DCVax-Brain脑癌疫苗治疗患者的2倍。此外,采用DCVax-Brain脑癌疫苗治疗与化疗不同:不产生任何使患者衰弱的不良反应。
西北生物治疗公司的DCVax是一个可望应用于大多数癌症的技术平台。DCVax通过调动所有免疫反应(先天的和后天的),而不是仅单一抗体或单一T细胞的单种免疫剂。DCVax以自然途径调动患者的免疫系统,使其功能恢复至正常,这从两方面来提高疗效而无毒性问题。与普通抗癌药不同,DCVax不造成任何使患者衰弱的不良反应。
DCVax药品是一种个性化用药,由从患者自身肿瘤获得或显示的癌症标记结合患者自己的主免疫细胞(树状细胞)制成。通过血液抽提获得在患者血液中循环的主免疫细胞的前体。此主免疫细胞通过一系列专利技术步骤使其成熟和激活,随后通过接触患者肿瘤生物标记“教育”后通过臂或大腿皮下简单注射几滴即可再返回患者体内产生治疗作用。
与许多正在开发的个性化治疗不同,DCVax低本高效(cost-effective)。西北生物治疗公司历经10年的开发,采用批量生产工艺(单批生产至少可供特定患者治疗3年的疫苗)专利是低本高效的关键。药品单剂瓶装冷冻储存,易于使用。此种储存方式高度可靠且成本低。
2抗感染药
2.1、马拉维若(maraviroc)片
辉瑞公司的马拉维若片(商品名:Selzentry)是10余年来首个新一类口服HIV治疗药。剂量规格:马拉维若150mg/片,300mg/片。Selzentry在治疗曾用其它药物治疗过的特异类型HIV感染患者时,可遏止病毒进人白细胞,显著减少病毒携带量和增加T细胞计数。
马拉维若是称作CCR5拮抗剂类药的第一个,阻断病毒进人T细胞的主要途径是CCR5共同受体。本品在R5病毒进人T细胞前将其阻止在细胞外表面,而不像其它所有已上市的HIV口服药作用于细胞内的病毒。
美国FDA加速批准了马拉维若与其它抗逆转录病毒治疗药合用治疗成人仅可检测出的CCR5-tropic HIV-1病毒(也称为R5病毒)的感染,患者体内出现病毒复制和有耐多种抗逆转录病毒治疗药的HIV-1株。可通过诊断测试来确定患者是否感染CCR5-tropic HIV-1病毒。CCR5系一某种类型免疫细胞表面的蛋白质。在先前接受HIV药物治疗的患者中,50%-60%的人血中带有CCR5-tropic HIV-1病毒。此新药对其它药物治疗无效的许多HIV病毒感染者非常重要,为其提供了治疗的新方法。
美国FDA批准马拉维若片上市是基于双盲安慰剂对照临床研究的安全性和有效性结果。选择了1076例患者临床研究,尽管患者先前采用其它HIV药物治疗过,但他们血中仍带有HIV病毒。
2.2、雷特格韦(raltegravir)片
默克公司的雷特格韦片(商品名:Isentress)与其它抗逆转录病毒药物联合应用可治疗人免疫缺陷病毒(HIV)-1感染。剂量规格:雷特格韦400mg/片。本品是药理学上首个HIV整合酶链转移抑制剂(integrase strand transfer inhibitors,通常简称为整合酶抑制剂)的抗逆转录病毒药物。它通过抑制病毒复制所需的HIV整合酶减缓HIV-1感染的发生。当雷特格韦与其它抗HIV药物合用时可减少血中HIV的数量,而增加称为CD4+(T)细胞的白细胞数量,有助于抗其它感染。
美国FDA批准本品上市是基于雷特格韦两项安慰剂双盲对照临床研究的疗效和安全性数据,治疗对象为699例用其它抗逆转录病毒药物治疗过的HIV-1感染的成人患者(至少对3类药物中的一种药物产生耐药性)。462例患者采用雷特格韦400mg一日2次的推荐剂量与目前市售的HIV治疗药合用;237例患者服用安慰剂与市售的HIV治疗药合用。结果显示,雷特格韦400mg一日2次组血浆中HIV-1 RNA自基础值平均变化为-1.85log10拷贝/mL,对照组为-0.84log10拷贝/mL。雷特格韦400mg一日2次组CD4+细胞计数较基础值平均增加较大(89个细胞/mm3),对照组为35个细胞/mm3。
2.3、瑞他帕林(retapamulin)软膏
葛兰素史克公司的1%瑞他帕林软膏(商品名:Altab-ax),用于局部治疗金黄色葡萄球菌或化脓链球菌感染的脓胞病。
瑞他帕林是称为截短侧耳素(pleuromutilins)的新一类抗菌药,与细菌核糖体50S亚基部位结合,通过截短侧耳素类药物独特地与细菌核糖体相互作用来抑制蛋白质合成。体外研究显示,Altabax的活性成分对其它类型抗菌药无交叉耐药性。
瑞他帕林软膏代表了近20年来美国FDA批准的新一类抗菌药局部处方制剂。Altabax适用于≥9个月患者,一日2次用药,疗程5d。而以往使用的其它局部处方抗菌制剂需一日3次,用药长达12d。
3心血管药物
3.1、阿利克仑(aliskiren)片
诺华公司的阿利克仑片(商品名:Tekturna)用于治疗高血压。剂量规格:阿利克仑150mg/片,300mg/片。
阿利克仑系一新分子实体,是美国FDA批准的首个直接抑制引起血压升高肾脏酶肾素的高血压治疗药。据预测,至2015年阿利克仑销售额将达21亿美元。
在6项8wk对2000多例轻至中度高血压患者的安慰剂对照临床研究中,证明了阿利克仑降血压的疗效。Tekturna对所有人口统计学亚群均有效,但对非洲裔美国人患者的降压作用较高加索人和亚洲人小。本品与利尿药氢氯噻嗪联合应用可进一步降低血压。
对6460多例患者评价了阿利克仑的安全性,其中1740例长达6个月的治疗,1250多例用药超过1年。
3.2、西他塞坦钠( sitaxentan sodium)片
澳大利亚治疗品管理局(Australian Therapeutic Goods Administration ,TGA)批准恩赛斯夫制药( Encysive Pharmaceuticals)公司的内皮素A受体拮抗剂西他塞坦钠片(商品名:Thelin)上市,一日1次口服治疗肺动脉高压。剂量规格:西他塞坦钠100mg/片。本品对原发性肺动脉高压和由结缔组织疾病引起的肺动脉高压有效。西他塞坦钠是首个选择性内皮素A受体拮抗剂。
西他塞坦钠系一可阻滞内皮素作用的小分子内皮素A受体拮抗剂、血管收缩和血管平滑肌生长的强效调节剂。内皮素受体拮抗剂可提高治疗各种血管收缩疾病的疗效。西他塞坦钠靶向作用于内皮素A受体的选择性是对内皮素B受体的6500倍。高度选择性内皮素A受体拮抗剂在临床药理学研究中显示可增加血流量和逆转血管收缩。
恩赛斯夫制药公司进行的两项关键的多中心随机安慰剂对照Ⅲ期临床研究结果支持了该药品在全世界注册。在研究中,西他塞坦钠100mg显著改善了包括结缔组织疾患在内的患者运动能力:增加了6min行走距离。本品还显示减轻患者肺动脉高压症状和改善肺动脉高压血液动力学状态。所有患者1年的存活率为96%,结缔组织疾病继发肺动脉高压患者为98%。
3.3、安贝生坦(ambrisentan)片
吉利德科学(Gilead Science)公司的内皮素A型(ETA)受体抑制剂安贝生坦片(商品名:Letairis),用于治疗肺动脉高压。
内皮素-1(ET-1)是一强效自分泌和旁分泌肽。内皮素A型(ETA)和内皮素B型(ETB)两种亚型受体调节血管平滑肌和内皮素的ET-1作用。ETA主要作用是收缩血管和细胞增生,而ETB主要作用则是舒张血管、抗内皮增生和清除ET-1。安贝生坦是ETA受体高度亲和性(Ki=0.011nM)的拮抗剂,且对ETA的选择性是对ETB选择性的4000倍以上。对393例肺动脉高压患者进行了12wk随机双盲安慰剂对照多中心临床研究,证明了安贝生坦片安全有效。
4、影响血液及造血系统的药物
4.1、艾库组单抗(eculizumab)注射液
亚力兄制药(Alexion Pharmaceuticals)公司的艾库组单抗注射液(商品名:Soliris),是首个用于治疗阵发性夜间血红蛋白尿(PNH)的制剂。剂量规格:艾库组单抗300mg/瓶(10mg/mL,30mL/瓶)。
4.2甲氧基聚乙二醇促红细胞生成素-β注射剂罗氏公司的甲氧基聚乙二醇促红细胞生成素-β注射剂(商品名:Mircera),一月1次治疗慢性肾病(CKD)引起的贫血。注射液剂量规格:甲氧基聚乙二醇促红细胞生成素-β 50μg/mL,100μg/mL,200μg/mL,300μg/mL,400μg/mL,600μg/mL,1000μg/mL(1mL/瓶);预填充注射剂每支:甲氧基聚乙二醇促红细胞生成素-β50μg/0.3mL,75μg/0.3mL,100μg/0.3mL,150μg/0.3mL,200μg/0.3mL,250μg/0.3mL,400μg/0.6mL,600μg/0.6mL,800μg/0.6mL。
Mircera系一持续促红细胞生成素受体激动剂,在受体水平具有不同的活性,包括更接近模拟人体生理过程的刺激红细胞形成。一月1次给药达到可预测的和稳定的血红蛋白浓度。
Mircera是欧盟首次批准的红血球生成素(ESA),二周1次的给药方案对先前未治疗过的患者的贫血可以有效纠正。本品也是首个可以安全替代其它ESA类药且仅需一月给药1次。Mircera其它适应证的安全性和有效性尚未确定。
一月1次的Mircera可使医务专业人员节省更多的护理时间从而有精力去关注CKD患者的其它护理需求。研究数据显示,将需要频繁使用的其它ESA类药换成一月1次的Mircera后透析中心每年用于治疗贫血的时间几乎可减少一半。Mircera的批准是基于对29个国家2700例CKD患者的全球10个临床研究中心的有效性和安全性的结果。安全性数据获自2737例CKD患者的临床研究,其中789例采用Mircera治疗,948例使用其它ESA类药治疗。约6%使用Mircera治疗的患者出现不良反应,主要是高血压。
5降血糖药及其辅助治疗药
维达利停(vildagliptin)片:诺华公司的二肽酰肽酶IV(DDP-IV)抑制药维达利停口服片(商品名:Galvus),一日1次治疗2型糖尿病。本品是迄今唯一适应证广且可与其它抗糖尿病药合用的药物。剂量规格:维达利停50mg/片,100mg/片。
维达利停片获准上市的重要性在于它是DDP-IV抑制药类的新成员,可满足医生对新药与现有药物合用的需求。欧盟已批准维达利停与一些最常处方用药的口服抗糖尿病药(如二甲双胍、磺酰脲类药和唑烷二酮类药)联合应用。
维达利停通过新型的作用机制发挥作用:靶向造成2型糖尿病患者血糖浓度升高的胰小岛功能障碍。胰小岛功能障碍与抗胰岛素作用是造成2型糖尿病的主要因素。维达利停降低高血糖而不增加体重且低血糖发生率低,这两种不良反应是服用磺酰脲类药和哇烷二酮类药最常发生的。当维达利停与最常使用的口服抗糖尿病药合用治疗各种2型糖尿病患者时可显著降血糖,包括各少数民族人群、老人和未控制血糖浓度的患者。
6、中枢神经系统药物
二甲磺酸赖右苯丙胺(lisdexamfetamine dimesylate)胶囊:希雷(Shire)公司与新河制药(New Rive Pharmaceuticals)公司合作开发的苯丙胺衍生物二甲磺酸赖右苯丙胺(原称为NRP104)胶囊(商品名:Vyvanse),用于治疗儿童注意力不集中伴多动症(ADHD)。剂量规格:二甲磺酸赖右苯丙胺30mg/粒,50mg/粒,70mg/粒。
二甲磺酸赖右苯丙胺为无活性的前体药物,口服后在胃肠道内被迅速吸收转化成右苯丙胺才发挥作用。新河制药公司设计了二甲磺酸赖右苯丙胺ADHD治疗新药:将右苯丙胺以共价键连接在L-赖氨酸分子上。早上口服本品后,较安慰剂显著有效,且可整日(至下午6点)保持疗效。在两项口服和静脉注射给药的药物依赖性临床研究中,患者对Vyvanse产生的药物喜欢作用(drug liking effects ,DLE)记分较相同剂量的右苯丙胺小。
7呼吸系统药物
人禽流感H5N1疫苗:美国首个人禽流感H5N1疫苗(Vaccine for Humans Against the Avian Influenza Virus H5N1),用于H5N1禽流感病毒流行时防止在人群中扩散,避免造成此疾病在全球迅速传播。预防流感大流行是目前全球面临的最严重的公共保健问题之一。此疫苗的批准是对抗流感大流行迈出的重要一步。
此疫苗获自人体内病毒株,对18-64岁可能感染H5N1流感病毒的人进行免疫接种,肌肉注射一月1次全疗程共2次。生产厂商赛诺菲帕斯特(Sanofi Pasteur)公司不对外销售此疫苗,而是由美国联邦政府购买后按需分发。
对此疫苗进行了临床研究以收集安全性数据和接种者免疫反应的数据,并确定适宜的疫苗剂量。总共103例健康成人志愿者注射疫苗90μg,28d后再注射90μg。此外约300例健康成人接种此疫苗的剂量<90μg,总共48例注射安慰剂。
8、内分泌与代谢疾病治疗药
兰瑞肽储库型控释注射剂:2007年8月31日,美国FDA批准法国益普生(Ipsen)公司的兰瑞肽(lanreotide)储库型控释注射剂(商品名:Somatuline Depot)作为NME上市,用于长期治疗不宜手术和(或)放疗的肢端肥大症患者。本品为预填充注射器,不需复溶,因而可非常方便地用于患者。剂量规格:兰瑞肽60mg/支,90mg/支,120mg/支。
Somatuline Depot(在美国外的商品名为Somatuline Autogel)为含有抑制生长激素释放的生长激素释放抑制因子同系物兰瑞肽。本品初始开发且目前继续主要用于治疗肢端肥大症(由垂体前叶良性肿瘤引起生长激素或泌乳素产生过度造成的疾病)。此药品正在欧洲开发用于治疗神经内分泌瘤(尤其是类癌型)引起的症状。益普生公司认为Somatuline Autogel拥有的技术代表了重大技术发展。
9、展望
据IMS公司预测:全球2008年药品销售额将增长5%-6%(达7350亿美元左右),较2007年的增长率(6%-7%)略低,主要原因是畅销药物专利到期的数量增多;2008年将上市29个新药,2007年美国FDA已发出可批准函的部分新药如下:
9.1抗感染药
9.1.1、替拉泛星(telavancin)注射剂
治疗先锋(Theravance)公司开发的替拉泛星系一新型的半合成脂糖肽类抗生素,通过抑制肽聚糖合成和破坏细菌细胞膜双重作用模式来发挥抗菌作用。在体外,本品对各种革兰阳性菌有很强的抗菌活性。临床上用于治疗复杂性皮肤和皮肤软组织感染和耐甲氧西林肺炎链球菌引起的院内感染的肺炎等。通常,患者对本品耐受性好,不良反应较小。
9.1.2、盐酸达巴泛星(dalbavancin HCl)冻干粉针
辉瑞公司研发的盐酸达巴泛星系一糖肽类抗生素。一周1次治疗耐甲氧西林金黄色葡萄球菌引起的成人复杂性皮肤和皮肤软组织感染。
9.2、心血管药物
9.2.1、方达帕铵钠(fondaparinium sodium)注射剂
葛兰素史克公司的一日1次抗凝血药方达帕铵钠注射剂,用于治疗患者的不稳定心绞痛或非ST段升高的心肌梗死(UA/NSTEMI)、ST段升高的心肌梗死(STEMI),UA/NSTEMI和STEMI是急性冠状动脉综合征(ACS)的类型。
9.3、中枢神经系统药物
9.3.1、去甲文拉法辛(desvenlafaxine succinate)口服缓释片
惠氏公司制药子公司的5-羟色胺-去甲肾上腺素再摄取抑制剂(SNRI)琥珀酸去甲文拉法辛,用于治疗成人严重的抑郁性障碍(MDD)。
9.3.2、印地扑朗(Indiplon)胶囊
神经内分泌生物科学(Neurocrine Biosciences)的印地扑朗胶囊5mg和10mg用于治疗失眠。
印地扑朗系一独特的非苯二氮卓类药物,专一作用于GABA-A受体。本品还显示特异地作用于促进脑内睡眠的GABA-A受体亚型。
9.3.3、胍法新(guanfacine)控释片
胍法新原用于治疗中度至重度高血压。2007年6月底,美国FDA向希雷(Shire)公司发出用于治疗注意力不集中伴多动症(ADHD)的胍法新控释片可批准函。胍法新与其它一些ADHD治疗药不同,为非兴奋药。胍法新是首个选择性靶向作用于处理行为功能任务的额叶前部皮质内的α-2A受体。胍法新不是神经系统控制药品,尚不知其潜在滥用和依赖性的机制。
9.4、骨质疏松治疗药
巴多昔芬(bazedoxifene)口服制剂:惠氏公司的巴多昔芬是第三代选择性雌激素受体调节剂(SERM),用于预防妇女绝经后的骨质疏松。
|



 1
1
