Sutent® (sunitinib) ble godkjent i Norge 27. juli 2006. Fra 15. september '06 var det tilgjengelig i Norge.
Sutent® har indikasjon for behandling av avansert og/eller metastatisk nyrecellekarsinom (MRCC) (2).
Sutent® har indikasjon for behandling av ikke-opererabel og/eller metastatisk malign gastrointestinal stromal tumor (GIST) etter at behandling med imatinibmesilat har sviktet på grunn av resistens eller intoleranse. (2)
Sutent® er det første kreftlegemidlet som har fått godkjent to indikasjoner samtidig (2).
Hva er Sutent®?
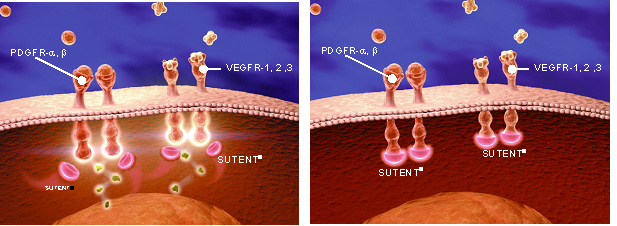
Sutent® er et kreftlegemiddel som målrettet angriper og hemmer reseptorer for vekstfaktorer, som sitter på overflaten av blant annet kreftceller (fig.1). Vekstfaktorene stimulerer blant annet til nydannelse av blodårer (angiogenese). Sutent® vil, gjennom dette, hemme angiogenesen og dermed redusere bla tilførselen av næring til kreftcellene (3).
Sutent® er et helt nytt legemiddel til behandling av lokal avansert og metastatisk nyrekreft. Det har i tillegg indikasjonen behandling av GIST etter at tidligere imatinib behandling har sviktet.
Det kliniske studieprogrammet med Sutent har vist følgende:
· 31% av pasientene med nyrekreft hadde objektiv respons (fullstendig eller delvis tilbakegang av tumoren) under behandling med Sutent® (4)
·
Progresjonsfri overlevelse varte i median 11 måneder (4)
Hvordan virker Sutent®?
Sutent® er en multi- tyrosinkinase hemmer som:
· Binder seg til og hemmer den intracellulære tyrosinkinase delen av vekstfaktor reseptorer (3)
· Hemmer nydannelse av blodårer til tumor via påvirkning av flere signalveier (3).
Sutent® hemmer tyrosinkinase reseptorer som bl.a.:
· VEGFR
· PDGFR
Figur 1 er en forenklet, skjematisk fremstilling av hvordan Sutent® hemmer reseptorene på det intracellulære tyrosinkinase setet. Og på den måten hemmer signaloverføringen inn i cellen.
Tyrosinkinase hemming (fig. 1)
Hvilken effekt gir Sutent®?
Sutent® er blant annet godkjent for behandling av avansert og/eller metastatisk nyrecellekarsinom (mRCC).
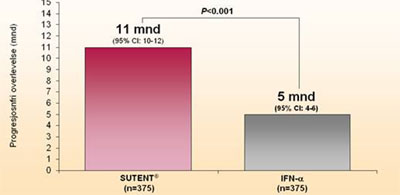
Figur 2 og 3 viser resultat fra en studie med Sutent® ved metastatisk nyrekreft.(4)
I denne studien fant man at hele 31% av pasientene (n=375) (evaluert av uavhengige kilder) hadde en objektiv respons (fullstendig eller delvis tilbakegang av tumoren) under behandling med Sutent®.
Progresjonsfri overlevelse varte i 11 måneder for pasientene som fikk behandling med Sutent®.
Figur 2:
Andel pasienter med mRCC som fikk objektiv respons eller stabil sykdom med Sutent®. (4)

Sutent® ga 5 ganger høyere responsrate enn IFN-a som 1. linje behandling ved mRCC.
Varighet av progresjonsfri overlevelse på Sutent®. (4)

Sutent® mer enn dobler median PFS sammenlignet med IFN-a som 1. linje behandling ved mRCC.
Hvordan brukes Sutent®?
- Sutent® doseres som en kapsel en gang daglig.
- Sutent® kan tas med eller uten mat.
Anbefalt dose Sutent® er en 50 mg dose oralt, tatt daglig i 4 påfølgende uker, etterfulgt av en 2 ukers hvileperiode (4/2-kur) som utgjør en fullstendig syklus på 6 uker.
Basert på individuell sikkerhet og toleranse kan dosen modifiseres trinnvis med 12,5 mg om gangen. Daglig dose skal ikke være under 37,5 mg eller overstige 87,5 mg. (1)
Sutent® har en enkel og forutsigbar farmakokinetikk (1)
§ Absorpsjon og distribusjon
- Mat har ingen effekt på biotilgjengeligheten av Sutent®.
- Maksimal konsentrasjon i serum ses vanligvis fra 6 til 12 timer etter dosering.
- Binding av Sutent® og de primære aktive metabolitter til humant plasmaprotein var henholdsvis 95 % og 90 %, og ser ikke ut til å være konsentrasjonsavhengig.
- Tilsynelatende distribusjonsvolum for Sutent® er stort, 2230 liter, dette indikerer fordeling i vev
§ Metabolisme og utskillelse
- Sutent® verken hemmer eller induserer viktige CYP-enzymer, inklusive CYP3A4.
- Utskillelse i hovedsak via fæces (61 %), renal eliminering av legemiddel og metabolitter utgjør 16 % av administrert dose.
- Total oral clearance var 34 – 62 liter/time.
- Steady state konsentrasjoner av sunitinib og metabolitten oppnås innen 10 til 14 dager.
- Gjennomsnittlig halveringstid for sunitinib og dets primære aktive desylat-metabolitt henholdsvis omtrent 40 – 60 timer, og 80 – 110 timer
Bivirkninger (1)
§ Bivirkningene var vanligvis moderate i intensitet (1, 4).
§ De viktigste og alvorligste behandlingsrelaterte bivirkningene forbundet med Sutent® -behandling hospasienter med solide svulster var lungeemboli (1 %), trombocytopeni (1 %), tumorblødning (0,9 %),febril nøytropeni (0,4 %) og hypertensjon (0,4 %).
§ Andelen pasienter som avsluttet behandlingen med Sutent® på grunn av bivirkninger var 11% (4)
Sutent® og refusjon
Sutent® er ikke oppført på preparatlisten for legemidler som refunderes over Folketrygdlovens § 5-14, § 9 (Blåreseptordningen). Pasienten har likevel muligheter til å få refundert sine utgifter til Sutent®. (5)
Bidrag til utgifter via § 10.a (5)
Refusjon for preparater som ikke er oppført i preparatlisten
Arbeids- og velferdsdirektoratet kan når særlige grunner taler for det, godkjenne at det ytes stønad til et legemiddel som ikke er oppført i preparatlisten ved en av de sykdommer som er nevnt i § 9.
Vedtak om refusjon etter første ledd for bestemte legemidler kan ikke påberopes overfor folketrygden, dersom finansieringsansvaret for legemidlene er overført til regionale helseforeta



![驱虫斑鸠菊注射液[与维阿敏白灵组合治疗]](/uploadfile/picture/uploadfile/200710/20071014112428638.gif)
![维阿敏白灵[维药口服经典方]](/uploadfile/picture/uploadfile/200710/20071014112154962.gif)
