随着生活方式的转变和老龄化的加剧,2型糖尿病(T2DM)成为人类社会越来越沉重的负担,发病人数已超过2.46亿并仍在迅速增加,与其相关的并发症已成为人类排名第五位的死亡原因。严峻的现实促使我们深刻反思T2DM治疗领域中长期存在的若干基本矛盾。
谁来延缓T2DM进展的脚步?
T2DM是一种慢性进展性疾病,胰岛β细胞功能衰竭和内源性胰岛素分泌减少是疾病进展过程的主线。英国前瞻性糖尿病研究(UKPDS)表明,尽管初诊患者在疾病早期就接受了积极治疗以使血糖水平尽可能达标,但多数患者在10年的干预期内血糖指标仍逐渐恶化,并最终进入胰岛素依赖阶段。糖尿病终点进展试验(ADOPT)显示,新诊断的T2DM患者采用磺脲类、二甲双胍或噻唑烷二酮(TZD)类药物治疗,3~5年后均无法实现血糖达标并须改变治疗方案。
上述研究提示,虽然血糖升高可能是加重β细胞负担并导致其功能衰竭的原因之一,但维持血糖达标状态并不足以遏制T2DM进展,患者每隔数年即须更换方案并加大治疗强度,最终β细胞功能完全丧失,不得不依赖胰岛素进行降糖治疗。这意味着β细胞功能的衰退有其内在原因,我们迫切需要一类在降糖同时能够保护β细胞功能的药物。
降糖达标与低血糖反应的矛盾为何日益突出?
降糖达标是减少糖尿病相关并发症和死亡风险的根本要求。长期高血糖状态会导致有害的糖基化终末产物生成并引发氧化应激,增加大血管和微血管并发症的发生风险。
随着T2DM病程的延长和病情的进展,维持血糖达标的治疗难度逐步提高,患者需要联合使用更多、更强的降糖药物。然而,多种降糖药物有不同程度的致低血糖作用。并且,患者用药剂量和时机不当、饮酒、生活规律变化等均可能引发低血糖事件。
正常人血糖<5 mmol/L会出现胰高血糖素分泌增多等生理性反射以升高血糖,T2DM患者对低血糖反应的反射性保护机制受损,患者血糖低至3 mmol/L后方可通过肾上腺素分泌增加升高血糖,而逐渐强化的降糖治疗又使T2DM患者的低血糖风险进一步增加。
低血糖发生率与T2DM患者的死亡和心血管风险呈正相关。一次严重低血糖引发的心血管事件,可能会抵消终生维持血糖在正常水平的益处。在控制糖尿病心血管危险行动(ACCORD)研究中,强化降糖组虽然获得了更低的糖化血红蛋白(HbA1c)水平,但患者的死亡率反而上升,较高的低血糖发生率可能是其重要原因之一。另外,对低血糖的恐惧会降低患者的治疗依从性,为降糖达标带来更多的困难。
基于以上原因,低血糖事件构成了T2DM治疗的障碍,随着患者病程的延长,血糖指标日益恶化,降糖治疗强度逐渐增加,降糖达标和低血糖风险成为T2DM治疗过程中越来越突出的一对矛盾。
胰岛素分泌不足与胰岛素抵抗能否同时改善?
胰岛素分泌不足与胰岛素抵抗是T2DM发病的两种基本病理生理学改变。对于肥胖T2DM患者,胰岛素抵抗造成胰岛素相对不足,反馈性增加β细胞的胰岛素分泌从而加重其负荷,久而久之,造成β细胞功能衰退。对于非肥胖T2DM患者,胰岛素分泌绝对不足则很可能是发病的始动因素。
在目前的降糖药物中,二甲双胍和TZD类药物可以改善胰岛素抵抗,但对于胰岛素的分泌无明显促进作用,胰岛素促泌剂(如磺脲类和格列奈类)和外源性胰岛素虽可补充内源性胰岛素分泌的不足,但对胰岛素抵抗没有明显的改善。
对于大多数T2DM,胰岛素抵抗和缺乏往往同时存在,由于缺少能同时改善这两种病理因素的药物,T2DM患者经常需要联合治疗方能实现降糖达标,大大增加了治疗的难度和复杂性。
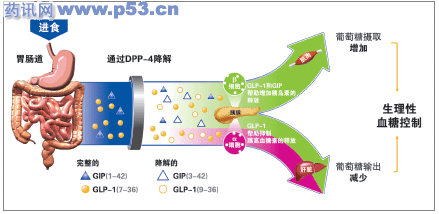
图 肠促胰岛激素(GLP-1和GIP)在血糖控制中的作用机制
肠促胰岛激素与DPP-4抑制剂:T2DM治疗的新曙光
寻找能保护β细胞且基本不发生低血糖,同时可改善胰岛素分泌不足和胰岛素抵抗的降糖药物,成为内分泌学界多年来的追求目标。
早在上个世纪60年代,生理学研究发现口服葡萄糖可较静脉输注引发更多的胰岛素释放,提示某些内源性物质可在进食葡萄糖后促进胰岛素分泌。后续研究发现,这种呈葡萄糖依赖式促进胰岛素释放的物质是小肠内分泌细胞产生的一类多肽激素,内分泌学界将其命名为肠促胰岛激素。
人体内发挥主要生理作用的肠促胰岛激素包括胰高血糖素样肽1(GLP-1)和葡萄糖依赖的促胰岛素多肽(GIP),在它们作用下分泌的胰岛素占餐后总分泌量的60%以上。两种肠促胰岛激素可与胰岛β细胞和多种其他细胞表面的特异性受体结合,发挥降糖作用。
肠促胰岛激素与其他胰岛素促泌剂最大的不同是,仅在高葡萄糖水平下增加胰岛素分泌。在低葡萄糖水平下,肠促胰岛激素与β细胞表面的特异性受体结合后,仅引发钙离子的少量内流和胰岛素的微量释放。而在高葡萄糖水平下,β细胞内三磷酸腺苷(ATP)水平升高,使ATP依赖的钾通道开放,细胞复极化延迟,肠促胰岛激素与受体结合后钙离子内流时程延长,胰岛素释放量显著增加。
进一步研究显示,肠促胰岛激素具有改善胰岛β细胞功能和减轻胰岛素抵抗的潜在作用。T2DM患者接受肠促胰岛激素输注6周后,再接受葡萄糖负荷时,C肽水平可显著升高,且胰岛素敏感性显著升高77%,表明患者的胰岛素分泌功能和胰岛素抵抗状态均有显著改善。
在动物实验和体外研究中,肠促胰岛激素还能促进β细胞再生,维护β细胞的形态,并抑制β细胞的凋亡。
此外,肠促胰岛激素还具有广泛的胰外作用。GLP-1可延缓胃排空,长期输注后还可作用于下丘脑的摄食中枢增加饱胀感,从而使患者减少进食。这些效应对于控制T2DM患者的体重和热量摄入也有积极作用。
上述生理作用使肠促胰岛激素成为一种很有吸引力的治疗物质。可以设想,能有效提高体内肠促胰岛激素水平的药物很可能具有以下特性:仅在高血糖时促进胰岛素分泌,基本不会引起低血糖,在改善胰岛素分泌的同时可减轻胰岛素抵抗,并能通过保护β细胞延缓T2DM的进展。这些作用很可能有助于解决T2DM治疗领域中长期存在的若干矛盾。
然而,天然的肠促胰岛激素仅能通过注射给药,而且会被组织中的二肽基肽酶4(DPP-4)快速降解,在体内的半衰期不超过数分钟,必须持续输注才能起到控制血糖的作用,对于T2DM这种慢性疾病而言,这样的给药方式无疑会大大降低治疗的可行性和依从性。
糖尿病药物研究者找到的出路之一是研发抑制DPP-4的药物,通过延缓内源性肠促胰岛激素的分解而提高其水平。
西格列汀(sitagliptin,商品名Januvia)是全球首个被批准用于T2DM治疗的口服DPP-4抑制剂。在多项临床研究中,西格列汀显示出确切的降糖疗效且基本没有低血糖风险,对于胰岛β细胞功能也起到了显著的改善作用,印证了先前对DPP-4抑制剂特性的设想。
目前尚有大量临床研究正在继续验证西格列汀的降糖疗效、安全性及终点事件的获益。
可以预见,以西格列汀为代表的DPP-4抑制剂很有可能在未来的T2DM治疗领域发挥重大作用。

