|
拉泊芬钠(talaporfin) 商品名 Laserphyrin 开发与上市厂商 他拉泊芬(talaporfin)由日本明治制果公司研制, 2004年6月在日本首次上市。 适应证 本品适用于不能接受手术等根除性治疗或有必要保留肺功能而不能接受其他治疗方法的早期肺癌。 药理作用 本品在激光照射下产生单线态氧 (1O2),单线态氧可直接杀伤肿瘤细胞或者损伤肿瘤血管,由此显示抗肿瘤效果。 9例癌症患者静脉内注射本品 40mg/m2,4~6小时后血药浓度达 20gg/mL,t1/2α为(14.6±2.96)小时, t1/2β为(138±21.4)小时,整体清除率为(19.0±3.8)mL/(h·m2),稳态时的平均分布容积为(3.26±0.51) L/m2。通过超滤法体外测定本品5和 1 OOμg/mL浓度时的血浆蛋白结合率约为100%。本品在人体内几乎不被代谢。 临床评价 使用半导体激光装置照射(照射能量密度为1 OOJ/cm2)的临床研究结果显示,本品对早期肺癌的不同病变治疗的显效率为85.7(显效病例36 例/总病例42例),有效率为95.2% (有效病例40例/总病例42例);对早期肺癌的不同病例治疗的显效率为 84.2%(显效病例32例/总病例38 例),有效率为94.7%(有效病例36例/总病例38例)。 在光照射疗法实施1年后的跟踪随访中(参与临床研究的所有患者), 34例病变中2例复发,1年内的复发率为5.9%0总病例中(39例)6例确认复发,跟踪期间(跟踪36例患者;时间457~2012天)的总局部复发率为 15.4%(6例/39例)。 不良反应 临床研究中,本品的不良反应总发生率为69.4%(34例/49例),包括临床检查值异常在内的不良反应共 105例,主要有咳嗽、咯痰增加40.8% (20例)、血痰30.6%(15例)、咳嗽 26.5%(13例)、咽喉痛14.3%(7例)、 C反应蛋白(CRP)升高26.1%(13例)、发热12.2%(6例)和谷丙转氨酶(ALT) 升高12.2%(6例)等。发生率在0.1% 5%的不良反应还有皮肤瘙痒、血尿素氮(BUN)升高、蛋白尿、腹泻、咽痛、倦怠感、胸部不适、低钙血症、心电图异常等。严重不良反应为激光照射后,肉芽生成导致呼吸道变窄引发呼吸困难。 注意事项 联用引发光过敏症的药物者,激光照射后易生成肉芽而导致呼吸道狭窄引发呼吸困难,应慎用。呼吸道癌症患者,肝功能不全者慎用。老年和婴幼儿患者慎用。 妊娠期或可能妊娠的妇女,使用本品时应判断其效益与危险性。哺乳期妇女使用本品时应停止授乳。 使用本品2周后,应避免日光直接照射,室内光照应控制在500Lx以下。反复使用本品时,必须停药1个月以上,且确认不会引发光过敏反应。 用法与用量 每安瓿中加入4mL生理盐水,充分溶解,避光并尽快使用。 静脉内注射,每次40mg/m2,注射4~6小时后用激光照射病灶部位。 制剂 冻干粉针剂,每安瓿含本品 100mg。 Title: Talaporfin 注意:该药品储存于2-8度 Light Sciences今日宣布,其先导化合物LS11(在日本称为Laserphyrin)的授权公司——Meiji Seika获得了日本厚生省Pharmaceutical Affairs and Food Sanitation Council的批准推荐。该药物将获准用于早期支气管癌的光动力疗法。 日本政府对全球第二大保健市场决策的出台,是缘于Light Sciences成功地完成了其先导化合产品Litx(TM)用于实体癌晚期患者的第一和第二阶段研究。Litx System关键成分之 Light Sciences的总裁兼首席执行官Albert Luderer博士表示:“我们的先导药物在日本获得批准推荐之时,正值我们的肿瘤学项目第二阶段在全球启动之际。LS11杰出的安全性使我们深受鼓舞。我们相信这一里程碑式的政府决策将为Litx下一阶段的评估树立积极的基调。” Light Sciences在2000年初从日本石化公司(Nippon Petrochemicals)和日本明治制果株式会社(Meiji Seika Kaisha)获得了LS11的授权,同时获得了开发、制造和出售该化合物,用于日本以外世界其他地区的光力学治疗的多种疗法应用的专有权。 Litx以新一代光活性药物为基础,这种药物在治疗场所由微小且成本低廉的发光二极管为其制造并传输光能。Litx主要用于治疗局部疾病,并初步用于对手术、放疗或化疗等疗法均告失败的实体瘤患者的研究。 美国癌症学会(American Cancer Society)预测,今年将有超过550,000名病情已到达这种程度的癌症患者死亡,即每天死亡1,500多人。Litx还被作为针对心血管疾病的介入疗法正在进行前临床实验,而针对眼疾的第一阶段研究也正在进行中。 英文:LASERPHYRIN 100mg FOR INJECTION 注射用レザフィリン100mg 注射用レザフィリン100mg欧文商標名
LASERPHYRIN 100mg FOR INJECTION
有効成分に関する理化学的知見
性 状
タラポルフィンナトリウムは暗青緑色の粉末である。 本品は水に溶けやすく、酢酸(100)にやや溶けやすく、メタノールにやや溶けにくく、エタノール(99.5)に極めて溶けにくく、アセトニトリルにほとんど溶けない。 旋光度[α]20546:約+1000°(脱水物に換算したもの0.02g、水、500mL、100mm)。 本品は吸湿性である。 一般名 タラポルフィンナトリウム Talaporfin Sodium 化学名 (+)-tetrasodium(2S,3S)-18-carboxylato-20-[N-(S)-1,2-dicarboxylatoethyl]carbamoylmethyl-13-ethyl-3,7,12,17-tetramethyl-8-vinylchlorin-2-propanoate 分子式 C38H37N5Na4O9 分子量 799.69 構造式 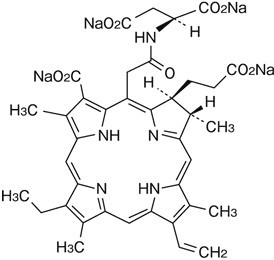 融 点 約150℃(分解点) 分配係数 (log10 1-オクタノール層/水層) (下表参照)
承認条件1.
承認から3年間は可能な限り全投与症例を市販後調査の対象とし、本薬による光線力学的療法施行後の再発、生存期間等、長期的な予後について検討すること。調査結果について、手術等の他の治療法における成績と比較した結果をとりまとめて提出すること。
2.
本薬による光線力学的療法についての講習を受け、当該療法に関する十分な知識・経験のある医師のみによって用いられるよう、必要な措置をとること。
包装
1バイアル中 100mg含有 1バイアル
|
他拉泊芬钠注射剂(Laserphyrin,Talaporfin Na)简介:
拉泊芬钠(talaporfin)
商品名
Laserphyrin
开发与上市厂商
他拉泊芬(talaporfin)由日本明治制果公司研制, 2004年6月在日本首次上市。
适应证
本品适用于不能接受手术等根除性治疗或有必要 ... 关键字:拉泊芬钠注射剂
责任编辑:admin |
最新文章更多
推荐文章更多
热点文章更多 |