速効型インスリン分泌促進薬
承認等
販売名
グルファスト錠5mg
販売名コード
3969008F1029
承認・許可番号
承認番号
21600AMZ00035000
商標名
GLUFAST Tab. 5mg
薬価基準収載年月
2004年4月
販売開始年月
2004年5月
貯法・使用期限等
貯法
気密容器,室温保存
使用期限
3年(外装容器に表示)
規制区分
処方せん医薬品注)
注) 注意-医師等の処方せんにより使用すること。
組成
販売名
グルファスト錠5mg
有効成分(1錠中含量)
ミチグリニドカルシウム水和物(5mg)
添加物
タルク,トウモロコシデンプン,ヒドロキシプロピルセルロース,ステアリン酸カルシウム,結晶セルロース,乳糖水和物,その他1成分
性状
販売名
グルファスト錠5mg
含量
5mg
外形:表面
外形:裏面
外形:側面
直径
6.0mm
厚さ
2.0mm
重量
75mg
識別コード
@GF5

色・剤形
白色
素錠
販売名
グルファスト錠10mg
販売名コード
3969008F2025
承認・許可番号
承認番号
21600AMZ00036000
商標名
GLUFAST Tab. 10mg
薬価基準収載年月
2004年4月
販売開始年月
2004年5月
貯法・使用期限等
貯法
気密容器,室温保存
使用期限
3年(外装容器に表示)
規制区分
処方せん医薬品注)
注) 注意-医師等の処方せんにより使用すること。
組成
販売名
グルファスト錠10mg
有効成分(1錠中含量)
ミチグリニドカルシウム水和物(10mg)
添加物
タルク,トウモロコシデンプン,ヒドロキシプロピルセルロース,ステアリン酸カルシウム,結晶セルロース,乳糖水和物,その他1成分
性状
販売名
グルファスト錠10mg
含量
10mg
外形:表面
外形:裏面
外形:側面
長径
10.0mm
短径
5.0mm
厚さ
3.0mm
重量
150mg
識別コード
@GF10

色・剤形
白色
素錠
割線入り
一般的名称
ミチグリニドカルシウム水和物錠
禁忌
(次の患者には投与しないこと)
1.
重症ケトーシス,糖尿病性昏睡又は前昏睡,1型糖尿病の患者[輸液及びインスリンによる速やかな高血糖の是正が必須となるので本剤の投与は適さない。]
2.
重症感染症,手術前後,重篤な外傷のある患者[インスリンによる血糖管理が望まれるので本剤の投与は適さない。]
3.
本剤の成分に対し過敏症の既往歴のある患者
4.
妊婦又は妊娠している可能性のある婦人(「妊婦,産婦,授乳婦等への投与」の項参照)
|
効能又は効果
効能又は効果/用法及び用量
2型糖尿病における食後血糖推移の改善
ただし,下記のいずれかの治療で十分な効果が得られない場合に限る。
(1)
食事療法・運動療法のみ
(2)
食事療法・運動療法に加えてα-グルコシダーゼ阻害剤を使用
(3)
*食事療法・運動療法に加えてチアゾリジン系薬剤を使用
効能又は効果に関連する使用上の注意
1.
糖尿病の診断が確立した患者に対してのみ適用を考慮すること。糖尿病以外にも耐糖能異常・尿糖陽性等,糖尿病類似の症状(腎性糖尿,老人性糖代謝異常,甲状腺機能異常等)を有する疾患があることに留意すること。
2.
*糖尿病治療の基本である食事療法・運動療法を行っている患者,食事療法・運動療法に加えてα-グルコシダーゼ阻害剤又はチアゾリジン系薬剤を使用している患者では,投与の際の空腹時血糖が126mg/dL以上,又は食後血糖1又は2時間値が200mg/dL以上を示す場合に限る。
用法及び用量
通常,成人にはミチグリニドカルシウム水和物として1回10mgを1日3回毎食直前に経口投与する。なお,症状により適宜増減する。
用法及び用量に関連する使用上の注意
本剤は,食後投与では速やかな吸収が得られず効果が減弱する。効果的に食後の血糖上昇を抑制するため,本剤の投与は毎食直前(5分以内)とすること。また,本剤は投与後速やかに薬効を発現するため,食前30分投与では食前15分に血中インスリン値が上昇し食事開始時の血糖値が低下することが報告されており,食事開始前に低血糖を誘発する可能性がある。
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
1.
肝機能障害のある患者[肝臓は本剤の主代謝臓器の1つであるため,低血糖を起こすおそれがある。また,肝機能障害のある患者においては肝機能障害を悪化させるおそれがある。]
2.
腎機能障害のある患者[慢性腎不全患者において,血漿中薬物未変化体濃度の消失半減期の延長が報告されていることから,低血糖を起こすおそれがある。(「薬物動態」の項参照)]
3.
次に掲げる患者又は状態
(1)
虚血性心疾患のある患者[心筋梗塞を発症した患者が報告されている。(「副作用」の項参照)]
(2)
脳下垂体機能不全又は副腎機能不全のある患者[低血糖を起こすおそれがある。]
(3)
下痢,嘔吐等の胃腸障害のある患者[低血糖を起こすおそれがある。]
(4)
栄養不良状態,飢餓状態,食事摂取量の不足又は衰弱状態[低血糖を起こすおそれがある。]
(5)
激しい筋肉運動[低血糖を起こすおそれがある。]
(6)
過度のアルコール摂取者[低血糖を起こすおそれがある。]
(7)
高齢者[一般に高齢者では生理機能が低下している。(「高齢者への投与」の項参照)]
重要な基本的注意
1.
本剤は,ときに低血糖症状を起こすことがあるので,高所作業,自動車の運転等に従事している患者に投与するときには注意すること。低血糖症状が認められた場合にはショ糖,ブドウ糖,又は十分量のブドウ糖を含む清涼飲料水等を摂取すること。ただし,α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合には,α-グルコシダーゼ阻害剤がニ糖類の消化・吸収を遅延するので,ショ糖ではなく,ブドウ糖を投与するなど適切な処置を行うこと。なお,患者に対し低血糖症状及びその対処方法について十分説明すること。
2.
本剤投与中は,血糖を定期的に検査するとともに,経過を十分に観察し,本剤を2~3ヵ月投与しても効果が不十分な場合には,より適切と考えられる治療への変更を考慮すること。
3.
投与の継続中に,投与の必要がなくなる場合や,減量する必要がある場合があり,また患者の不養生,感染症の合併等により効果がなくなったり,不十分となる場合があるので,食事摂取量,血糖値,感染症の有無等に留意のうえ,常に投与継続の可否,投与量,薬剤の選択等に注意すること。
4.
本剤は,速やかなインスリン分泌促進作用を有する。その作用点はスルホニル尿素系製剤と同じであり,スルホニル尿素系製剤との相加・相乗の臨床効果及び安全性が確認されていないので,スルホニル尿素系製剤とは併用しないこと。(「薬効薬理」の項参照)
5.
*ピオグリタゾン塩酸塩1日45mgとの併用における安全性は確立されていない(使用経験はほとんどない)。
6.
*ビグアナイド系薬剤との併用における有効性及び安全性は確立されていない。
相互作用
相互作用の概略
本剤は主として,UGT1A9及び1A3によるグルクロン酸抱合化により代謝される。(「薬物動態」の項参照)
併用注意
(併用に注意すること)
薬剤名等
インスリン製剤
臨床症状・措置方法
*低血糖症状(空腹感,あくび,悪心,無気力,だるさ等の初期症状から血圧上昇,発汗,ふるえ,顔面蒼白等の症状を経て意識消失,けいれん,昏睡にいたる),血糖降下作用が増強されることがあるので,血糖値モニターその他患者の状態を十分に観察し,必要であれば減量する。
α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはショ糖ではなくブドウ糖を投与すること。
チアゾリジン系薬剤との併用時には,特に浮腫の発現に注意すること。(※)
機序・危険因子
作用機序が異なる薬理作用の相加作用による血糖降下作用の増強による。
薬剤名等
ビグアナイド系薬剤
メトホルミン塩酸塩等
臨床症状・措置方法
*低血糖症状(空腹感,あくび,悪心,無気力,だるさ等の初期症状から血圧上昇,発汗,ふるえ,顔面蒼白等の症状を経て意識消失,けいれん,昏睡にいたる),血糖降下作用が増強されることがあるので,血糖値モニターその他患者の状態を十分に観察し,必要であれば減量する。
α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはショ糖ではなくブドウ糖を投与すること。
チアゾリジン系薬剤との併用時には,特に浮腫の発現に注意すること。(※)
機序・危険因子
作用機序が異なる薬理作用の相加作用による血糖降下作用の増強による。
薬剤名等
α‐グルコシダーゼ阻害剤
ボグリボース等
臨床症状・措置方法
*低血糖症状(空腹感,あくび,悪心,無気力,だるさ等の初期症状から血圧上昇,発汗,ふるえ,顔面蒼白等の症状を経て意識消失,けいれん,昏睡にいたる),血糖降下作用が増強されることがあるので,血糖値モニターその他患者の状態を十分に観察し,必要であれば減量する。
α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはショ糖ではなくブドウ糖を投与すること。
チアゾリジン系薬剤との併用時には,特に浮腫の発現に注意すること。(※)
機序・危険因子
作用機序が異なる薬理作用の相加作用による血糖降下作用の増強による。
薬剤名等
*チアゾリジン系薬剤
ピオグリタゾン塩酸塩
臨床症状・措置方法
*低血糖症状(空腹感,あくび,悪心,無気力,だるさ等の初期症状から血圧上昇,発汗,ふるえ,顔面蒼白等の症状を経て意識消失,けいれん,昏睡にいたる),血糖降下作用が増強されることがあるので,血糖値モニターその他患者の状態を十分に観察し,必要であれば減量する。
α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはショ糖ではなくブドウ糖を投与すること。
チアゾリジン系薬剤との併用時には,特に浮腫の発現に注意すること。(※)
機序・危険因子
*作用機序が異なる薬理作用の相加作用による血糖降下作用の増強による。
機序不明(※)
薬剤名等
サリチル酸製剤(アスピリン等)
臨床症状・措置方法
*低血糖症状(空腹感,あくび,悪心,無気力,だるさ等の初期症状から血圧上昇,発汗,ふるえ,顔面蒼白等の症状を経て意識消失,けいれん,昏睡にいたる),血糖降下作用が増強されることがあるので,血糖値モニターその他患者の状態を十分に観察し,必要であれば減量する。
α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはショ糖ではなくブドウ糖を投与すること。
チアゾリジン系薬剤との併用時には,特に浮腫の発現に注意すること。(※)
機序・危険因子
血中蛋白との結合抑制及び抱合代謝阻害による。ただし,アスピリンとして1回量1500mgの併用時に影響する可能性があるが,低用量(アスピリンとして1回量300mg)では影響しない。
薬剤名等
クロフィブラート等
臨床症状・措置方法
*低血糖症状(空腹感,あくび,悪心,無気力,だるさ等の初期症状から血圧上昇,発汗,ふるえ,顔面蒼白等の症状を経て意識消失,けいれん,昏睡にいたる),血糖降下作用が増強されることがあるので,血糖値モニターその他患者の状態を十分に観察し,必要であれば減量する。
α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはショ糖ではなくブドウ糖を投与すること。
チアゾリジン系薬剤との併用時には,特に浮腫の発現に注意すること。(※)
機序・危険因子
血中蛋白との結合抑制及び代謝阻害による。
薬剤名等
サルファ剤
スルファメトキサゾール等
臨床症状・措置方法
*低血糖症状(空腹感,あくび,悪心,無気力,だるさ等の初期症状から血圧上昇,発汗,ふるえ,顔面蒼白等の症状を経て意識消失,けいれん,昏睡にいたる),血糖降下作用が増強されることがあるので,血糖値モニターその他患者の状態を十分に観察し,必要であれば減量する。
α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはショ糖ではなくブドウ糖を投与すること。
チアゾリジン系薬剤との併用時には,特に浮腫の発現に注意すること。(※)
機序・危険因子
血中蛋白との結合抑制及び代謝阻害による。
薬剤名等
β‐遮断剤
プロプラノロール塩酸塩等
臨床症状・措置方法
*低血糖症状(空腹感,あくび,悪心,無気力,だるさ等の初期症状から血圧上昇,発汗,ふるえ,顔面蒼白等の症状を経て意識消失,けいれん,昏睡にいたる),血糖降下作用が増強されることがあるので,血糖値モニターその他患者の状態を十分に観察し,必要であれば減量する。
α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはショ糖ではなくブドウ糖を投与すること。
チアゾリジン系薬剤との併用時には,特に浮腫の発現に注意すること。(※)
機序・危険因子
肝臓における糖新生の抑制及び末梢におけるインスリン感受性の増強により血糖が低下する。
薬剤名等
モノアミン酸化酵素阻害剤
臨床症状・措置方法
*低血糖症状(空腹感,あくび,悪心,無気力,だるさ等の初期症状から血圧上昇,発汗,ふるえ,顔面蒼白等の症状を経て意識消失,けいれん,昏睡にいたる),血糖降下作用が増強されることがあるので,血糖値モニターその他患者の状態を十分に観察し,必要であれば減量する。
α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはショ糖ではなくブドウ糖を投与すること。
チアゾリジン系薬剤との併用時には,特に浮腫の発現に注意すること。(※)
機序・危険因子
肝臓における糖新生の抑制及び末梢におけるインスリン感受性の増強により血糖が低下する。
薬剤名等
タンパク同化ホルモン剤
メスタノロン等
臨床症状・措置方法
*低血糖症状(空腹感,あくび,悪心,無気力,だるさ等の初期症状から血圧上昇,発汗,ふるえ,顔面蒼白等の症状を経て意識消失,けいれん,昏睡にいたる),血糖降下作用が増強されることがあるので,血糖値モニターその他患者の状態を十分に観察し,必要であれば減量する。
α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはショ糖ではなくブドウ糖を投与すること。
チアゾリジン系薬剤との併用時には,特に浮腫の発現に注意すること。(※)
機序・危険因子
タンパク同化ホルモン剤が糖尿病患者のみに起こる血糖降下作用に加えて代謝抑制・排泄遅延説がある。
薬剤名等
テトラサイクリン系抗生物質
テトラサイクリン塩酸塩
ミノサイクリン塩酸塩等
臨床症状・措置方法
*低血糖症状(空腹感,あくび,悪心,無気力,だるさ等の初期症状から血圧上昇,発汗,ふるえ,顔面蒼白等の症状を経て意識消失,けいれん,昏睡にいたる),血糖降下作用が増強されることがあるので,血糖値モニターその他患者の状態を十分に観察し,必要であれば減量する。
α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはショ糖ではなくブドウ糖を投与すること。
チアゾリジン系薬剤との併用時には,特に浮腫の発現に注意すること。(※)
機序・危険因子
インスリン感受性促進による。
薬剤名等
エピネフリン
臨床症状・措置方法
経口血糖降下剤の効果を減弱させ,血糖値が上昇してコントロール不良になることがある。
食後の血糖上昇が加わることによる影響に十分注意すること。
併用時は血糖値コントロールに注意し頻回に血糖値を測定し,必要に応じ投与量を調節する。
機序・危険因子
末梢でのグルコースの取り込み抑制及び肝臓での糖新生の促進により,血糖値を上昇させる。
薬剤名等
副腎皮質ホルモン
メチルプレドニゾロン等
臨床症状・措置方法
経口血糖降下剤の効果を減弱させ,血糖値が上昇してコントロール不良になることがある。
食後の血糖上昇が加わることによる影響に十分注意すること。
併用時は血糖値コントロールに注意し頻回に血糖値を測定し,必要に応じ投与量を調節する。
機序・危険因子
肝臓での糖新生促進,末梢組織でのインスリン感受性低下による。
薬剤名等
卵胞ホルモン
エチニルエストラジオール等
臨床症状・措置方法
経口血糖降下剤の効果を減弱させ,血糖値が上昇してコントロール不良になることがある。
食後の血糖上昇が加わることによる影響に十分注意すること。
併用時は血糖値コントロールに注意し頻回に血糖値を測定し,必要に応じ投与量を調節する。
機序・危険因子
機序不明
コルチゾール分泌変化,組織での糖利用変化,成長ホルモンの過剰産生,肝機能の変化等が考えられる。
薬剤名等
ニコチン酸
臨床症状・措置方法
経口血糖降下剤の効果を減弱させ,血糖値が上昇してコントロール不良になることがある。
食後の血糖上昇が加わることによる影響に十分注意すること。
併用時は血糖値コントロールに注意し頻回に血糖値を測定し,必要に応じ投与量を調節する。
機序・危険因子
肝臓でのブドウ糖の同化抑制による。
薬剤名等
イソニアジド
臨床症状・措置方法
経口血糖降下剤の効果を減弱させ,血糖値が上昇してコントロール不良になることがある。
食後の血糖上昇が加わることによる影響に十分注意すること。
併用時は血糖値コントロールに注意し頻回に血糖値を測定し,必要に応じ投与量を調節する。
機序・危険因子
糖質代謝の障害による血糖値上昇及び耐糖能異常による。
薬剤名等
ピラジナミド
臨床症状・措置方法
経口血糖降下剤の効果を減弱させ,血糖値が上昇してコントロール不良になることがある。
食後の血糖上昇が加わることによる影響に十分注意すること。
併用時は血糖値コントロールに注意し頻回に血糖値を測定し,必要に応じ投与量を調節する。
機序・危険因子
機序不明
血糖値のコントロールがむずかしいとの報告がある。
薬剤名等
フェノチアジン系薬剤
クロルプロマジン等
臨床症状・措置方法
経口血糖降下剤の効果を減弱させ,血糖値が上昇してコントロール不良になることがある。
食後の血糖上昇が加わることによる影響に十分注意すること。
併用時は血糖値コントロールに注意し頻回に血糖値を測定し,必要に応じ投与量を調節する。
機序・危険因子
インスリン遊離抑制,副腎からのエピネフリン遊離による。
薬剤名等
利尿剤
チアジド系
クロルタリドン
エタクリン酸等
臨床症状・措置方法
経口血糖降下剤の効果を減弱させ,血糖値が上昇してコントロール不良になることがある。
食後の血糖上昇が加わることによる影響に十分注意すること。
併用時は血糖値コントロールに注意し頻回に血糖値を測定し,必要に応じ投与量を調節する。
機序・危険因子
血清カリウムの低下,インスリンの分泌障害,組織におけるインスリンの感受性低下による。
薬剤名等
フェニトイン
臨床症状・措置方法
経口血糖降下剤の効果を減弱させ,血糖値が上昇してコントロール不良になることがある。
食後の血糖上昇が加わることによる影響に十分注意すること。
併用時は血糖値コントロールに注意し頻回に血糖値を測定し,必要に応じ投与量を調節する。
機序・危険因子
インスリン分泌を直接抑制する。
薬剤名等
甲状腺ホルモン
乾燥甲状腺等
臨床症状・措置方法
血糖値その他患者の状態を十分観察しながら投与する。
機序・危険因子
血糖コントロール条件が変わることがある。
薬剤名等
グアネチジン硫酸塩
臨床症状・措置方法
血糖値その他患者の状態を十分観察しながら投与する。
機序・危険因子
投与初期で交感神経終末ノルアドレナリン遊離のため,β刺激作用の糖新生,グリコーゲン分解促進で高血糖になるが,以降カテコールアミン枯渇のため低血糖となる。
副作用
副作用等発現状況の概要
*総症例1,567例中,副作用が報告されたのは358例(22.8%)であった。その主なものは,低血糖症状(6.1%:「臨床成績」の項参照)の他,体重増加(2.0%),浮腫(1.8%),腹部膨満(1.3%),便秘(1.3%)等であった。また,臨床検査値の異常変動は,総症例1,559例中344例(22.1%)に認められた。その主なものは,BNPの上昇(10.5%),ピルビン酸の上昇(6.4%),γ-GTPの上昇(3.2%),CK(CPK)の上昇(3.1%),乳酸の上昇(2.9%),ALT(GPT)の上昇(2.3%)等であった。(効能追加承認時)
重大な副作用
その他
0.1~5%未満
*けん怠感,脱力感,冷汗,ほてり,浮腫,脱毛,眼のしょぼしょぼ感,胸部不快感,胸痛,右季肋部痛,四肢痛,体重増加,乳酸上昇,遊離脂肪酸上昇,総コレステロール上昇,LDL-コレステロール上昇,トリグリセリド上昇,尿酸上昇,CK(CPK)上昇,カリウム上昇
高齢者への投与
一般に高齢者では生理機能が低下しているので,状況に応じて低用量(1回量5mg)から投与を開始するなど,血糖値に留意して,経過を十分に観察しながら慎重に投与すること。
妊婦、産婦、授乳婦等への投与
1.
妊婦又は妊娠している可能性のある婦人には投与しないこと。[本剤は動物実験(ラット)で胎盤通過が認められている。また,動物実験(ラット)で周産期に薬理作用に基づく低血糖によると推定される母動物死亡が認められている。]
2.
授乳中の婦人には授乳を避けさせること。[本剤は動物実験(ラット)で母乳への移行が認められている。]
小児等への投与
小児等に対する安全性は確立していない(使用経験がない)。
適用上の注意
薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。[PTPシートの誤飲により,硬い鋭角部が食道粘膜へ刺入し,更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている。]
薬物動態
1.
*
血漿中濃度
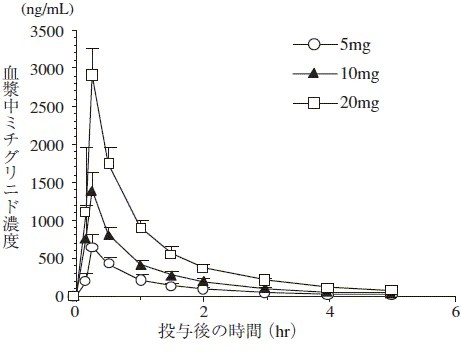
健康成人男子に本剤5,10及び20mgを食直前に単回経口投与したとき,投与後0.23~0.28時間で最高血漿中濃度(Cmax)に達し,半減期(t1/2)は約1.2時間であった1)。
図 健康成人男子における食直前投与の用量別血漿中ミチグリニド濃度(平均値±標準偏差)
一方,健康成人男子に本剤5mgを食後に経口投与すると,食直前に比し最高血漿中濃度(Cmax)の低下及び最高血漿中濃度到達時間(Tmax)の遅延が認められた2)。
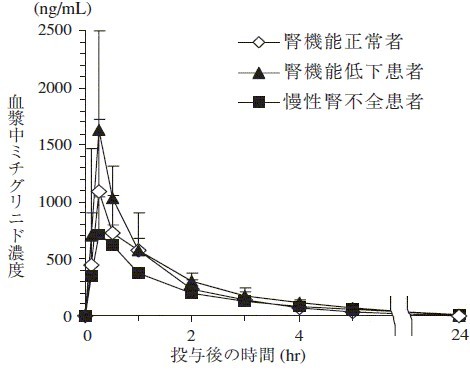
成人腎機能正常者,腎機能低下患者及び慢性腎不全患者(本剤投与前日の平均クレアチニンクリアランス値はそれぞれ113.75,37.01及び3.431mL/min)に本剤10mgを食直前に単回経口投与したとき,クレアチニンクリアランスの低下に伴い半減期(t1/2)は延長したが,その他の主要パラメータ(Cmax,AUC0‐inf及びCLtot/F)とクレアチニンクリアランスとの間に,有意な相関は認められなかった3)。
図 腎機能正常者,腎機能低下患者及び慢性腎不全患者における血漿中ミチグリニド濃度(平均値±標準偏差)
また,ボグリボース(α-グルコシダーゼ阻害剤)で血糖コントロールが不十分な2型糖尿病患者を対象に,食直前に本剤10mgをボグリボースと単回併用投与したとき,投与後0.28時間でCmax(1395.8ng/mL)に達し,t1/2は1.29時間であり,併用投与による薬物動態の変化はなかった4)。
さらに,健康成人男性を対象に,食直前に本剤10mgとピオグリタゾン(チアゾリジン系薬剤)30mgを併用投与したとき,投与後0.38時間でCmax(1147.6ng/mL)に達し,t1/2は1.20時間であり,併用投与による薬物動態の変化はなかった。また,ピオグリタゾンの薬物動態に対する本剤の影響は認められなかった5)。
2.
代謝,排泄
健康成人男子に本剤5,10及び20mgを食直前に単回経口投与したとき,24時間までに投与量の約54~74%が尿中に排泄され,そのほとんどがグルクロン酸抱合体代謝物であり,ミチグリニドは1%未満であった1)。
健康成人男子(外国人)に[14C]標識ミチグリニドカルシウム水和物11mg溶液を食直前に単回経口投与したとき,投与0.5及び4時間後の血漿中放射能は主にミチグリニド由来であり,ミチグリニドのグルクロン酸抱合体はミチグリニドの約1/3から1/6量が存在し,ヒドロキシ体代謝物はさらに少なかった6)。また,投与した放射能の約93%は尿中に,約6%は糞中に排泄された7)。
ミチグリニドカルシウム水和物は,ヒトにおいて肝臓及び腎臓で代謝され,グルクロン酸抱合体は主に薬物代謝酵素のUGT1A9及び1A3により,ヒドロキシ体は主にCYP2C9により生成されることがin vitro試験により確認されている8,9)。
薬物動態の表
健康成人男子における食直前投与の薬物動態パラメータ
投与量
(mg) |
Cmax
(ng/mL) |
Tmax
(hr) |
t1/2
(hr) |
| 5(n=8) |
650.3 |
0.28 |
1.24 |
| 10(n=8) |
1390.7 |
0.23 |
1.19 |
| 20(n=7) |
2903.2 |
0.25 |
1.22 |
健康成人男子における食直前及び食後投与時の薬物動態パラメータ
| 投与時期 |
Cmax
(ng/mL) |
Tmax
(hr) |
t1/2
(hr) |
AUC0‐24hr
(ng・hr/mL) |
| 食直前(n=6) |
384.9 |
0.29 |
1.42 |
472 |
| 食後(n=6) |
143.5 |
2.08 |
1.26 |
444 |
腎機能正常者,腎機能低下患者及び慢性腎不全患者における薬物動態パラメータ
| |
Cmax
(ng/mL) |
Tmax
(hr) |
t1/2
(hr) |
AUC0‐inf
(ng・hr/mL) |
CLtot/F
(mL/min/kg) |
Vdss/F
(L/kg) |
腎機能正常者(n=8)
Ccrが91mL/min以上 |
1275.3 |
0.69 |
1.48 |
1517 |
1.64 |
0.16 |
腎機能低下患者(n=7)
Ccrが31~50mL/min |
1643.9 |
0.29 |
3.22 |
2132 |
1.37 |
0.20 |
慢性腎不全患者(n=8)
Ccrが30mL/min以下で透析を実施中 |
764.7 |
0.41 |
11.7 |
1741 |
1.70 |
0.86 |
臨床成績
1.
単独療法
(1)
第II相二重盲検比較試験10)
食事療法のみでは十分な血糖コントロールが得られない190例の2型糖尿病患者(糖尿病薬物治療歴なしの症例44.4%,投与開始時のHbA1C値平均値8.03%)を対象に,1回5mg,10mg及び20mgを1日3回毎食直前12週間経口投与した。10mg群では投与8週後から有意なHbA1Cの低下が認められ,最終評価時のHbA1C変化量は,プラセボ群+0.49%に対し,本剤群ではそれぞれ-0.22%,-0.35%及び-0.38%であり,いずれの用量もプラセボに比較して有意な低下が認められた(p<0.025,Shirley-Williams検定)。また,低血糖症状の発現頻度は,プラセボ群の6.5%に対し,それぞれ6.7%,2.2%及び6.3%であった。
(2)
第III相二重盲検比較試験11)
食事療法のみでは十分な血糖コントロールが得られない314例の2型糖尿病患者(糖尿病薬物治療歴なしの症例79.4%,投与開始時のHbA1C値平均値7.47%)を対象に,1回10mgを1日3回毎食直前12週間経口投与した。最終評価時のHbA1Cの変化量は,プラセボ群+0.21%に対し,本剤10mg群では-0.44%であり,有意な差が認められた(p<0.001,t検定)。また,低血糖症状の発現頻度は,プラセボ群の2.9%に対し,本剤10mg群では2.0%であった。
(3)
長期投与試験12)
長期投与試験では,1回10mg投与により,351例中218例でHbA1Cが低下し,その後も安定した血糖コントロールが持続した。また,1回10mgで効果が得られず,投与開始16週後に20mgに増量することで,37例にHbA1Cの改善が認められた。
2.
α-グルコシダーゼ阻害剤併用療法
(1)
第II/III相二重盲検比較試験13)
食事療法に加えてボグリボース(1回0.2mg)単剤による薬物療法により十分な血糖コントロールが得られていない385例の2型糖尿病患者(併用投与開始時のHbA1C値平均値7.10%)を対象に,ボグリボース0.2mgに本剤1回5mg又は10mgを上乗せして1日3回毎食直前12週間経口投与した。最終評価時のHbA1Cの変化量は,ボグリボース単独群-0.02%に対し,本剤10mg併用群で-0.64%,5mg併用群で-0.44%と共に有意に低下した(いずれもp<0.001,分散分析)。低血糖症状の発現頻度は,ボグリボース単独群の1.1%に対し,本剤10mg併用群で6.9%,本剤5mg併用群で3.3%であった。
(2)
長期併用投与試験14)
2型糖尿病患者161例に,ボグリボースと本剤を長期併用投与したところ,安定したHbA1Cの改善が確認された。
3.
*
チアゾリジン系薬剤併用療法
(1)
*
第II/III相二重盲検比較試験15)
*食事療法に加えてピオグリタゾン単独療法のみで十分な血糖コントロールが得られていない381例の2型糖尿病患者(併用投与開始時のHbA1C値平均値7.51%)を対象に,ピオグリタゾン15mg又は30mgに本剤1回5mg,10mg又はプラセボを上乗せして1日3回毎食直前16週間経口投与した。最終評価時のHbA1Cの変化量は,ピオグリタゾン単独群-0.02%に対し,本剤10mg併用群で-0.67%,5mg併用群で-0.45%と共に有意に低下した(いずれもp<0.001,分散分析)。低血糖症状の発現頻度は,ピオグリタゾン単独群の2.4%に対し,本剤10mg併用群で3.9%,本剤5mg併用群で2.4%であった。
(2)
*
長期併用投与試験16)
*2型糖尿病患者171例に,ピオグリタゾンと本剤を長期併用投与したところ,安定したHbA1Cの改善が確認された。
薬効薬理
1.
血糖上昇抑制作用
(1)
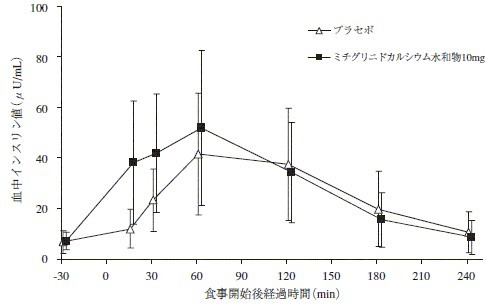
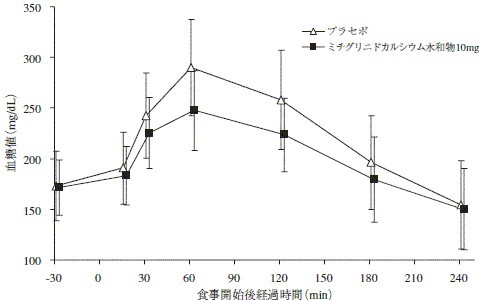
2型糖尿病患者20名において,二重盲検クロスオーバー法を用いて,単回投与試験を行った。本剤10mg投与により食後早期のインスリン追加分泌が促進され,血糖上昇が抑制された17)。
図 2型糖尿病患者における血中インスリン値(平均値±標準偏差)
図 2型糖尿病患者における血糖値(平均値±標準偏差)
(2)
ストレプトゾトシン誘発糖尿病モデルラットにミチグリニドカルシウム水和物を経口投与すると,速効性のインスリン分泌促進作用により,液体飼料経口負荷後の血糖上昇が抑制され,負荷後の血漿中グルコース濃度-時間曲線下面積値は低下した(in vivo)18,19)。
2.
作用機序
ミチグリニドカルシウム水和物は,膵β細胞のスルホニル尿素受容体への結合を介して,ATP感受性K+チャネル(KATPチャネル)電流を阻害することにより,インスリンの分泌を促進する(in vitro)20,21,22)。
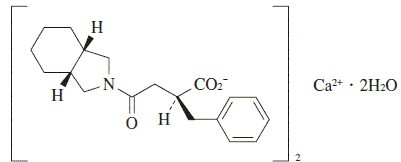
有効成分に関する理化学的知見
一般名
ミチグリニドカルシウム水和物(Mitiglinide Calcium Hydrate) (JAN)
化学名
(+)-Monocalcium bis[(2S,3a,7a-cis)-α-benzylhexahydro-γ-oxo-2-isoindolinebutyrate]dihydrate
分子式
C38H48CaN2O6・2H2O
分子量
704.91
構造式
性状
白色の粉末である。メタノール又はエタノール(99.5)に溶けやすく,水に溶けにくく,アセトニトリルに極めて溶けにくい。
包装
グルファスト錠5mg:100錠(PTP)
グルファスト錠5mg:210錠(PTP)
グルファスト錠10mg:100錠(PTP)
グルファスト錠10mg:210錠(PTP)
グルファスト錠10mg:500錠(PTP)
グルファスト錠10mg:1050錠(PTP)
グルファスト錠10mg:500錠(バラ)
主要文献及び文献請求先
主要文献
1)
健康成人を対象とした臨床薬理試験 (社内資料)
2)
健康成人を対象とした第 I 相臨床試験 (社内資料)
3)
腎機能低下者を対象とした臨床薬理試験 (社内資料)
4)
陶易王ほか:薬理と治療, 35(suppl.1), 39, 2007.
5)
*健康成人男性を対象とした臨床薬理試験(社内資料)
6)
健康成人を対象とした海外臨床薬理試験 (社内資料)
7)
健康成人を対象とした海外臨床薬理試験 (社内資料)
8)
ミチグリニド代謝に関与するUGT分子種 (社内資料)
9)
ミチグリニド代謝に関与するチトクロームP450分子種 (社内資料)
10)
田中俊一ほか:薬理と治療, 35(suppl.1), 5, 2007.
11)
2型糖尿病患者を対象とした第 III 相臨床試験 (社内資料)
12)
田中俊一ほか:薬理と治療, 35(suppl.1), 23, 2007.
13)
加来浩平ほか:薬理と治療, 35(suppl.1), 51, 2007.
14)
加来浩平ほか:薬理と治療, 35(suppl.1), 73, 2007.
15)
*2型糖尿病患者を対象とした第II/III相臨床試験(社内資料)
16)
*2型糖尿病患者を対象とした長期併用投与試験(社内資料)
17)
2型糖尿病患者を対象とした第 II 相臨床試験 (社内資料)
18)
Ichikawa, K. et al.:Clin. Exp. Pharmacol. Physiol., 29(5-6), 423, 2002.
19)
生島一真ほか:薬理と治療, 32(2), 73,2004.
20)
Ohnota, H. et al.:J. Pharmacol. Exp. Ther., 269(2), 489, 1994.
21)
Ichikawa, K. et al.:Arzneim.-Forsch./Drug Res., 52(8), 605, 2002.
22)
Sunaga, Y. et al.:Eur. J. Pharmacol., 431(1), 119, 2001.
文献請求先
主要文献に記載の社内資料につきましても下記にご請求ください。
*武田薬品工業株式会社 医薬学術部 くすり相談室
〒103-8668 東京都中央区日本橋二丁目12番10号
フリーダイヤル 0120-566-587
受付時間 9:00~17:30 (土日祝日・弊社休業日を除く)
キッセイ薬品工業株式会社 製品情報部
〒103-0022 東京都中央区日本橋室町1丁目8番9号
TEL. 03-3279-2304
製造販売業者等の氏名又は名称及び住所
製造販売元
キッセイ薬品工業株式会社
松本市芳野19番48号
販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号