乐伐替尼胶囊|LENVIMA(Lenvatinib Mesilate capsules)レンビマカプセル4mg/レンビマカプセル10mg ダウンロード
--------------------------------------------------------------------------------
作成又は改訂年月
2015年3月作成(第1版)
日本標準商品分類番号
874291
日本標準商品分類番号等
- 国際誕生年月
2015年2月
薬効分類名
抗悪性腫瘍剤
承認等
- 販売名
レンビマカプセル4mg

販売名コード
42910A3M1026
承認・許可番号
- 承認番号
22700AMX00640000
- 商標名
LENVIMA

薬価基準収載年月
薬価基準未収載
貯法・使用期限等
- 貯 法
室温保存
- 使用期限
外箱又はラベルに表示の使用期限内に使用すること。
規制区分
- 劇薬
- 処方箋医薬品
注意-医師等の処方箋により使用すること
組成
カプセル4mg:本剤は、1カプセル中にレンバチニブメシル酸塩4.90mg(レンバチニブとして4mg)を含有する上半分は黄赤色不透明、下半分は黄赤色不透明な硬カプセル剤である。
添加物として結晶セルロース、タルク、沈降炭酸カルシウム、低置換度ヒドロキシプロピルセルロース、ヒドロキシプロピルセルロース、ヒプロメロース、D-マンニトール、ラウリル硫酸ナトリウムを含有する。
性状
- 剤形
硬カプセル
- 識別コード
 LENV 4mg LENV 4mg
- 外形
- 全長
14.3mm
- 質量
137mg
- 号数
4
- 性状
カプセル
上半分:黄赤色不透明
下半分:黄赤色不透明
内容物
白色の顆粒
- 販売名
レンビマカプセル10mg

販売名コード
42910A3M2022
承認・許可番号
- 承認番号
- 22700AMX00641000
- 商標名
LENVIMA

薬価基準収載年月
薬価基準未収載
貯法・使用期限等
- 貯 法
室温保存
- 使用期限
外箱又はラベルに表示の使用期限内に使用すること。
規制区分
- 劇薬
- 処方箋医薬品
注意-医師等の処方箋により使用すること
組成
カプセル10mg:本剤は、1カプセル中にレンバチニブメシル酸塩12.25mg(レンバチニブとして10mg)を含有する上半分は黄赤色不透明、下半分は黄色不透明な硬カプセル剤である。
添加物として結晶セルロース、タルク、沈降炭酸カルシウム、低置換度ヒドロキシプロピルセルロース、ヒドロキシプロピルセルロース、ヒプロメロース、D-マンニトール、ラウリル硫酸ナトリウムを含有する。
性状
- 剤形
硬カプセル
- 識別コード
 LENV 10mg LENV 10mg
- 外形

- 全長
14.3mm
- 質量
137mg
- 号数
4
- 性状
カプセル
上半分:黄赤色不透明
下半分:黄色不透明
内容物
白色の顆粒
一般的名称
レンバチニブメシル酸塩製剤
警告
本剤は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本剤の使用が適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に本剤の有効性及び危険性を十分説明し、同意を得てから投与すること。
|
禁忌
(次の患者には投与しないこと) - 1. 本剤の成分に対し過敏症の既往歴のある患者
- 2. 妊婦又は妊娠している可能性のある婦人
〔「妊婦、産婦、授乳婦等への投与」の項参照〕
|
効能又は効果
根治切除不能な甲状腺癌
効能又は効果に関連する使用上の注意
- 1. 放射性ヨウ素による治療歴のない分化型甲状腺癌患者に対する本剤の有効性及び安全性は確立していない。
- 2. 臨床試験に組み入れられた患者の病理組織型等について、「臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分理解した上で、適応患者の選択を行うこと。
〔「臨床成績」の項参照〕
用法及び用量
通常、成人にはレンバチニブとして1日1回24mgを経口投与する。なお、患者の状態により適宜減量する。
用法及び用量に関連する使用上の注意
- 1. 副作用があらわれた場合は、症状、重症度等に応じて以下の基準を考慮して、本剤を減量、休薬又は中止すること。減量して投与を継続する場合には、1日1回20mg、14mg、10mg、8mg又は4mgに減量すること。
- 休薬、減量及び中止基準
- 副作用
-
高血圧
- 程度
収縮期血圧140mmHg以上又は拡張期血圧90mmHg以上のとき
- 処置
本剤の投与を継続し、降圧剤の投与を行う。
- 程度
降圧治療にも係らず、収縮期血圧160mmHg以上又は拡張期血圧100mmHg以上のとき
- 処置
収縮期血圧150mmHg以下及び拡張期血圧95mmHg以下になるまで本剤を休薬し、降圧剤による治療を行う。
本剤の投与を再開する場合、投与量を1段階減量する。
- 程度
Grade 4の副作用が発現した場合
- 処置
本剤の投与を中止する。
- 副作用
その他の副作用
- 程度
忍容性がないGrade 2又はGrade 3の副作用が発現した場合
- 処置
本剤の投与開始前の状態又はGrade 1以下に回復するまで休薬する(悪心・嘔吐・下痢に対しては休薬の前に適切な処置を行い、コントロールできない場合に本剤を休薬すること)。
本剤の投与を再開する場合、1段階減量する。
- 程度
Grade 4の副作用が発現した場合
(生命を脅かさない臨床検査値異常の場合は、Grade 3の副作用と同じ処置とする)
- 処置
本剤の投与を中止する。
GradeはCTCAE(Common Terminology Criteria for Adverse Events)version 4.0に準じる。
- 2. 本剤と他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
- 3. 重度の肝機能障害患者では、本剤の血中濃度が上昇するとの報告があるため、減量を考慮するとともに、患者の状態をより慎重に観察し、有害事象の発現に十分注意すること。
〔「慎重投与」及び「薬物動態」の項参照〕
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
- 1. 高血圧症の患者
〔高血圧が悪化するおそれがある。「用法・用量に関連する使用上の注意」、「重要な基本的注意」及び「重大な副作用」の項参照〕 - 2. 重度の肝機能障害のある患者
〔血中濃度が上昇するおそれがある。「用法・用量に関連する使用上の注意」及び「薬物動態」の項参照〕 - 3. 脳転移のある患者
〔転移部位からの出血があらわれるおそれがある。「重大な副作用」の項参照〕 - 4. 血栓塞栓症又はその既往歴のある患者
〔血栓塞栓症が悪化又は再発するおそれがある。「重大な副作用」の項参照〕 - 5. 外科的処置後、創傷が治癒していない患者
〔創傷治癒遅延があらわれることがある。「重要な基本的注意」及び「重大な副作用」の項参照〕
重要な基本的注意
- 1. 血圧の上昇が認められることがあるので、本剤の投与開始前及び投与期間中は定期的に血圧測定を行い、必要に応じて降圧剤の投与を行うなど、適切な処置を行うこと。重症、持続性あるいは通常の降圧治療でコントロールできない高血圧があらわれた場合には、減量、休薬又は投与を中止すること。
〔「重大な副作用」の項参照〕 - 2. 蛋白尿があらわれることがあるので、本剤の投与開始前及び投与期間中は定期的に尿蛋白を観察し、異常が認められた場合には適切な処置を行うこと。
〔「重大な副作用」の項参照〕 - 3. 骨髄抑制があらわれることがあるので、定期的に血液学的検査を行うなど、患者の状態を十分に観察し、感染症、出血傾向等の発現に留意すること。
〔「重大な副作用」の項参照〕 - 4. AST(GOT)、ALT(GPT)等の上昇を伴う肝障害があらわれることがあるので、本剤の投与期間中は定期的に肝機能検査を行うなど、患者の状態を十分に観察し、異常が認められた場合には、減量、休薬等の適切な処置を行うこと。
〔「重大な副作用」の項参照〕 - 5. 心機能不全があらわれることがあるので、本剤の投与開始前及び投与期間中は定期的に心エコー等の心機能検査を行うなど、患者の状態を十分に観察し、異常が認められた場合には適切な処置を行うこと。
〔「重大な副作用」の項参照〕 - 6. 創傷治癒を遅らせる可能性があるので、外科的処置が予定されている場合には、外科的処置の前に本剤の投与を中断すること。外科的処置後の投与再開は、患者の状態に応じて判断すること。
〔「重大な副作用」の項参照〕 - 7. 疲労、無力症、めまい、筋痙縮等があらわれることがあるので、自動車の運転等、危険を伴う機械の操作に従事する際には注意するよう患者に十分に説明すること。
〔「その他の副作用」の項参照〕 - 8. 本剤を投与する際は、定期的に血清カルシウム濃度を測定すること。
〔「重大な副作用」の項参照〕 - 9. 本剤を投与する際は、定期的に甲状腺刺激ホルモン濃度を測定すること。
〔「その他の副作用」の項参照〕
相互作用
本剤はP糖蛋白(P-gp)及びCYP3Aの基質となる。
〔「薬物動態」の項参照〕
併用注意
(併用に注意すること)
- 1. 薬剤名等
P-gp阻害剤
ケトコナゾール
イトラコナゾール
リファンピシン
アミオダロン
クラリスロマイシン
シクロスポリン
キニジン
ベラパミル等 - 臨床症状・措置方法
P-gp阻害剤との併用により、本剤の血中濃度が上昇する可能性がある。
- 機序・危険因子
これらの薬剤が消化管のP-gp活性を阻害することにより、本剤の血中濃度が上昇する可能性がある。
- 2. 薬剤名等
CYP3A/P-gp誘導剤
リファンピシン
フェニトイン
カルバマゼピン
セイヨウオトギリソウ(St. John’s Wort、セント・ジョーンズ・ワート)含有食品等 - 臨床症状・措置方法
CYP3A及びP-gp誘導剤との併用により、本剤の血中濃度が低下する可能性がある。
- 機序・危険因子
これらの薬剤がCYP3A及びP-gp等を誘導することにより、本剤の血中濃度が低下する可能性がある。
副作用
副作用等発現状況の概要
放射性ヨウ素治療抵抗性・難治性の分化型甲状腺癌患者を対象にした国際共同第III相試験(無作為化期)において本剤が投与された261例(日本人30例を含む)において、副作用が254例(97.3%)に認められた。
主な副作用は、高血圧177例(67.8%)、下痢159例(60.9%)、食欲減退135例(51.7%)、体重減少123例(47.1%)、悪心107例(41.0%)、疲労104例(39.8%)、口内炎96例(36.8%)、蛋白尿85例(32.6%)、手掌・足底発赤知覚不全症候群83例(31.8%)等であった。(承認時)
重大な副作用及びその他の副作用の頻度については、放射性ヨウ素治療抵抗性・難治性の分化型甲状腺癌患者を対象にした国際共同第III相試験(無作為化期)の集計に基づき記載した。なお、この臨床試験以外からの報告は頻度不明とした。
重大な副作用
- 1. 高血圧
高血圧(67.8%)、血圧上昇(3.8%)、高血圧クリーゼ(頻度不明)等があらわれることがある。観察を十分に行い、異常が認められた場合には適切な処置を行うこと。なお、コントロールできない高血圧が認められた場合には減量・休薬すること。また、高血圧クリーゼがあらわれた場合には投与を中止し、適切な処置を行うこと。
- 2. 出血
鼻出血(8.8%)、血尿(5.0%)、喀血(2.3%)、歯肉出血(1.9%)、肺出血(1.5%)、直腸出血(1.5%)、頭蓋内腫瘍出血(0.4%)、動脈出血(頻度不明)、くも膜下出血(頻度不明)、脳出血(頻度不明)、胃腸出血(頻度不明)等の出血があらわれることがある。観察を十分に行い、異常が認められた場合には、減量や休薬等の適切な処置を行うこと。重篤な出血があらわれた場合には、投与を中止し、適切な処置を行うこと。
- 3. 動脈血栓塞栓症
一過性脳虚血発作(0.8%)、急性心筋梗塞(0.4%)、脳血管発作(0.4%)、脾臓梗塞(0.8%)、脳虚血(0.4%)、出血性卒中(0.4%)、虚血性脳卒中(0.4%)等の動脈血栓塞栓症があらわれることがある。観察を十分に行い、異常が認められた場合には、減量、休薬又は中止等の適切な処置を行うこと。
- 4. 静脈血栓塞栓症
肺塞栓症(2.7%)、深部静脈血栓症(0.4%)、骨盤静脈血栓症(0.4%)、網膜静脈血栓症(0.4%)等の静脈血栓塞栓症があらわれることがある。観察を十分に行い、異常が認められた場合には、減量、休薬又は中止等の適切な処置を行うこと。
- 5. 肝障害
アルブミン低下(7.3%)、ALT増加(6.5%)、AST増加(5.4%)、血中アルカリホスファターゼ上昇(4.2%)、肝機能異常(0.8%)、血中ビリルビン増加(1.5%)、γ-グルタミルトランスフェラーゼ増加(1.5%)、胆汁うっ滞性肝損傷(0.4%)、肝不全(頻度不明)等があらわれることがある。観察を十分に行い、異常が認められた場合には、減量、休薬又は中止等の適切な処置を行うこと。
- 6. 腎障害
蛋白尿(32.6%)、尿中蛋白陽性(0.4%)、急性腎不全(0.8%)、腎不全(0.8%)、慢性腎不全(0.4%)、急性腎前性腎不全(0.4%)、腎機能障害(1.5%)、血中クレアチニン上昇(4.2%)、血中尿素増加(2.3%)、腎尿細管壊死(0.4%)、腎虚血(0.4%)、ネフローゼ症候群(0.4%)、腎クレアチニン・クリアランス減少(頻度不明)、糸球体濾過率減少(頻度不明)、尿量減少(頻度不明)等があらわれることがある。観察を十分に行い、異常が認められた場合には、減量、休薬又は中止等の適切な処置を行うこと。
- 7. 消化管穿孔、瘻孔形成
胆嚢穿孔(0.4%)、腸管穿孔(頻度不明)、痔瘻(0.4%)、腸膀胱瘻(0.4%)、腸管膿瘍(0.4%)、直腸膿瘍(0.4%)、会陰膿瘍(0.4%)等があらわれることがある。観察を十分に行い、異常が認められた場合には、中止等の適切な処置を行うこと。
- 8. 可逆性後白質脳症症候群
可逆性後白質脳症症候群(0.4%)があらわれることがあるので、痙攣、頭痛、錯乱、視覚障害、皮質盲等が認められた場合には投与を中止し、血圧のコントロールを含め、適切な処置を行うこと。
- 9. 心障害
駆出率減少(5.0%)、心不全(0.8%)、うっ血性心筋症(0.4%)、左室肥大(0.4%)、心室壁運動低下(0.4%)、心電図QT延長(8.0%)、頻脈(2.7%)、徐脈(1.5%)、心房細動・粗動(0.8%)等があらわれることがある。十二誘導心電図検査の実施等、観察を十分に行い、異常が認められた場合には、減量、休薬又は中止等の適切な処置を行うこと。
- 10. 手足症候群
手掌・足底発赤知覚不全症候群(31.8%)、手掌紅斑(1.1%)、紅斑性皮疹(0.4%)、皮膚反応(0.4%)等があらわれることがある。観察を十分に行い、異常が認められた場合には、減量、休薬又は中止等の適切な処置を行うこと。
- 11. 感染症
気道感染(4.2%)、肺炎(2.7%)、尿路感染(2.7%)、敗血症(1.1%)等があらわれることがある。観察を十分に行い、異常が認められた場合には、減量、休薬又は中止等の適切な処置を行うこと。
- 12. 骨髄抑制
血小板減少(13.8%)、白血球減少(7.3%)、リンパ球減少(6.9%)、貧血(6.1%)、好中球減少(3.8%)等があらわれることがある。定期的に血液検査を行うなど患者の状態を十分に観察し、異常が認められた場合には、減量、休薬又は中止等の適切な処置を行うこと。
- 13. 低カルシウム血症
低カルシウム血症(7.3%)があらわれることがあり、副甲状腺機能低下症の既往歴がある患者で高発現したことが報告されている。観察を十分に行い、異常が認められた場合には、血清カルシウム濃度を確認し、カルシウム剤やビタミンD製剤の投与等の適切な処置を行うこと。また必要に応じて、減量、休薬又は中止を考慮すること。
- 14. 創傷治癒遅延
治癒不良(0.8%)、創離開(0.4%)があらわれることがある。創傷治癒遅延があらわれた場合には、創傷が治癒するまで本剤の投与を中止すること。
その他の副作用
- 1. 消化器
30%以上
下痢、悪心、口内炎
- 2. 消化器
10~30%未満
口腔内乾燥、口腔咽頭痛、腹痛、嘔吐、便秘
- 3. 消化器
5~10%未満
消化不良、嚥下障害、舌痛
- 4. 全身症状
30%以上
疲労
- 5. 全身症状
10~30%未満
浮腫、無力症
- 6. 全身症状
5~10%未満
創傷
- 7. 精神神経系
10~30%未満
めまい、味覚異常、発声障害、頭痛
- 8. 精神神経系
5~10%未満
睡眠障害
- 9. 代謝
30%以上
食欲減退
- 10. 代謝
5~10%未満
血中カリウムの低下、血中コレステロールの上昇、脱水
- 11. 筋骨格系
10~30%未満
筋肉痛、関節痛
- 12. 筋骨格系
5~10%未満
四肢痛、筋痙縮、背部痛
- 13. 呼吸器
10~30%未満
咳嗽
- 14. 皮膚
10~30%未満
皮膚乾燥、発疹、脱毛症
- 15. 皮膚
5~10%未満
過角化、皮膚炎、皮膚病変
- 16. その他
30%以上
体重減少
- 17. その他
5~10%未満
甲状腺機能低下
高齢者への投与
本剤の臨床試験成績から、高齢者に対する用量調節の必要性を示唆する所見はみられていない。しかし、一般に高齢者では生理機能が低下していることが多く、副作用があらわれやすいので、患者の状態を十分に観察し、慎重に投与すること。
妊婦、産婦、授乳婦等への投与
- 1. 妊婦又は妊娠している可能性のある婦人には、投与しないこと。また妊娠可能な婦人に対しては、適切な避妊を行うよう指導すること。
〔外国臨床試験において、本剤の投与終了後に妊娠が判明し、自然流産となったことが報告されている。ラット及びウサギにおいて胚毒性・催奇形性が報告されている。なお、ラットでは臨床曝露量以下で認められた。〕 - 2. 授乳中の婦人に投与する場合には、授乳を中止させること。
〔ラットにおいて乳汁中へ移行することが報告されている。〕
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない(使用経験がない)。
幼若ラットを用いた反復投与毒性試験において、切歯の異形成及び骨の短小など成長を阻害する影響が認められ、成熟ラットに比較し、致死量での死亡がより早期にみられた。
過量投与
- 1. 徴候、症状
放射性ヨウ素治療抵抗性・難治性の分化型甲状腺癌患者を対象にした国際共同第III相試験において、過量投与により手掌・足底発赤知覚不全症候群の悪化、口腔乾燥及び口内炎が認められた。
- 2. 処置
本剤の過量投与に対する解毒剤は知られていない。過量投与が行われた場合には、休薬し観察を十分に行い、異常が認められた場合には、対症療法や本剤の投与中止等の適切な処置を行うこと。
適用上の注意
- 薬剤交付時
- 1. PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている)
- 2. 本剤は湿気に不安定なため、服用直前にPTPシートから取り出すよう指導すること。
その他の注意
- 1. 反復投与毒性試験(ラット、イヌ及びサル)の病理組織学的検査において、精巣(精上皮細胞の減少)及び卵巣(卵胞閉鎖)の変化が認められており、生殖機能に障害を及ぼす可能性が示唆されている。
- 2. 反復投与毒性試験において、ラット及びサル(成長板が残存する場合)に骨端軟骨成長板の肥厚が認められた。
- 3. ラット及びイヌを用いた反復投与毒性試験において、副腎の出血(イヌ)及び副腎皮質壊死(ラット)が認められた。
薬物動態
- 1. 血中濃度
- (1) 単回投与及び1日1回の反復投与(日本人における成績)
日本人固形がん患者9例に本剤20又は24mgを1日1回経口投与したときの、初回投与時の血漿中レンバチニブ濃度推移を以下の図に示した。初回投与時及び1日1回反復投与した15日目の薬物動態パラメータを表に示した。レンバチニブのCmax及びAUC(0-24h)には用量比例性が認められた。反復投与15日後の薬物動態は、単回投与の結果から推測可能であり、Cmax及びAUC(0-24h)の累積係数の平均値は、20mg投与群で1.27及び1.44、24mg投与群で1.42及び1.32であった。1)

本剤経口投与時の血漿中レンバチニブ濃度(1日目)
(平均値±標準偏差)
- (2) 食事の影響(外国人における成績)
健康成人16例に本剤10mgをクロスオーバー法により、空腹時又は食後(高脂肪食)に単回経口投与した。空腹時と比較して、食後投与のCmax及びAUC(0-inf)の臨床的に意味のある変化は認められなかった。2)
- 2. 代謝(外国人における成績)
本剤は主にアルデヒドオキシダーゼ、CYP3Aにより代謝され、グルタチオンが非酵素的に結合する(in vitro試験)。3)
外国人固形がん患者6例に14C標識-レンバチニブ24mgを単回経口投与した結果、血漿中の放射能の大部分は未変化体であった。4)
- 3. 分布
レンバチニブの蛋白結合率は97.9~98.6%(in vitro試験)、96.6~98.2%(日本人固形がん患者)であった。主な結合蛋白はアルブミンであった。5)6)
- 4. 排泄(外国人における成績)
外国人固形がん患者6例に14C標識-レンバチニブ24mgを単回経口投与したとき、投与10日後までに投与した総放射能の25%が尿中に、64%が糞中に回収された。また、尿及び糞中に排泄された未変化体は投与量のそれぞれ0.38%及び2.5%であった。未変化体の血漿中消失半減期は、約35.4時間であった。4)
- 5. 肝機能障害患者(外国人における成績)
本剤10mgを肝機能が正常な被験者(n=8)、軽度(Child-Pugh分類A)及び中等度(Child-Pugh分類B)の肝機能障害を有する被験者(各6例)に単回投与した。また、本剤5mgを重度(Child-Pugh分類C)の肝機能障害を有する被験者(6例)に単回投与した。
軽度、中等度及び重度の肝機能障害を有する被験者における投与量補正したCmaxは健康被験者のそれぞれ0.97、0.79及び1.1倍であり、投与量補正したAUC(0-inf)は健康被験者のそれぞれ1.2、1.1及び1.8倍であった。7)
- 6. 腎機能障害患者(外国人における成績)
レンバチニブ24mgを腎機能が正常な被験者(クレアチニンクリアランス[CLcr]:≧90mL/min、n=8)、軽度(CLcr:60~89mL/min)、中等度(CLcr:30~59mL/min)及び重度(CLcr:15~29mL/min)の腎機能障害を有する被験者(各6例)に単回投与した。
軽度、中等度及び重度の腎機能障害を有する被験者におけるCmaxは健康被験者のそれぞれ1.0、0.61及び0.87倍であり、AUC(0-inf)は、健康被験者のそれぞれ1.0、0.90及び1.2倍であった。8)
- 7. 薬物相互作用(外国人における成績)
外国人健康成人16例に、レンバチニブをケトコナゾールと併用投与した際のCmax及びAUC(0-inf)は、レンバチニブをプラセボと併用した場合と比べてそれぞれ19%及び15%上昇した。9)
外国人健康成人15例に、レンバチニブをリファンピシンと単回同時併用投与した際のCmax及びAUC(0-inf)は、レンバチニブを単独投与した場合と比べてそれぞれ33%及び31%上昇した。リファンピシンの反復投与後に、レンバチニブをリファンピシンと同時併用投与した際のCmax及びAUC(0-inf)は、レンバチニブをリファンピシンと単回同時併用投与した場合と比べてそれぞれ24%及び37%減少した。10)
In vitroにおいて、レンバチニブは、乳癌耐性蛋白(BCRP)の基質となること、及びUGT1A1を阻害すること(IC50値:10.6μmol/L)が示されている。3)11)
-
薬物動態パラメータ
| |
|
Cmax
(ng/mL) |
AUC(0-24h)
(ng・h/mL) |
tmaxc
(h) |
| 20mg/日 |
1日目
(n=3) |
309±60.1 |
2500±647 |
2(2-2) |
| 20mg/日 |
15日目
(n=3) |
415±267 |
3690±1790 |
2(2-2) |
| 24mg/日 |
1日目
(n=6) |
418±167 |
3150±352a |
2(2-4) |
| 24mg/日 |
15日目
(n=6) |
518±209 |
4140±1350b |
2(2-4) |
平均値±標準偏差
a:n=4、b:n=5、c:中央値(最小値-最大値)
注)本剤の承認された用量は、24mg/日である。
臨床成績
- 1. 国際共同第III相試験
放射性ヨウ素治療抵抗性・難治性(ヨウ素の取込みが認められない、放射性ヨウ素治療後12ヵ月以内に病勢の進行が認められた、又は累積線量が600mCi[22GBq]を超える放射性ヨウ素治療を受けている)の分化型甲状腺癌患者(乳頭癌、濾胞癌、Hurthle細胞癌、及び低分化癌)392例(本剤群261例[日本人患者30例]、プラセボ群131例[日本人患者10例])において、プラセボを比較対照として本剤24mgを1日1回投与した場合の有効性と安全性を評価した。
なお、心不全の既往、心血管系疾患の既往、不整脈、出血性疾患、血栓性疾患又は活動性の喀血がある患者、抗凝固剤を投与されている患者、3週間以内に大手術を受けた患者、及びQTc間隔が480ms超の患者は除外された。主要評価項目を無増悪生存期間(PFS)とした。
PFSの中央値は本剤投与群で18.3ヵ月、プラセボ群で3.6ヵ月であり、本剤はプラセボ群に対してPFSを有意に延長した。12)

- 2. 国内第II相試験
甲状腺癌(放射性ヨウ素治療抵抗性・難治性の分化型甲状腺癌[ヨウ素の取込みが認められない、放射性ヨウ素治療後12ヵ月以内に病勢の進行が認められた、又は累積線量が600mCi[22GBq]を超える放射性ヨウ素治療を受けている]、切除不能の甲状腺髄様癌及び切除不能の甲状腺未分化癌)43例に対し、本剤24mgを1日1回投与した場合の安全性と有効性を評価した。主要評価項目を安全性とし、副次評価項目として有効性を評価した。有効性解析対象例はそれぞれ23例、8例及び11例であった。13)
-
| n(%) |
分化型甲状腺癌
(N=23) |
甲状腺髄様癌
(N=8) |
甲状腺未分化癌
(N=11) |
| 完全奏効(CR) |
0 |
0 |
0 |
| 部分奏効(PR) |
16(69.6) |
1(12.5) |
3(27.3) |
| 安定(SD) |
7(30.4) |
7(87.5) |
7(63.6) |
| 病勢進行(PD) |
0 |
0 |
1(9.1) |
薬効薬理
- 1. 作用機序
レンバチニブは、腫瘍血管新生等に関与する、血管内皮増殖因子(VEGF)受容体(VEGFR1-3)、線維芽細胞増殖因子受容体(FGFR1-4)、血小板由来増殖因子受容体(PDGFR)α、幹細胞因子受容体(KIT)、Rearranged During Transfectionがん原遺伝子(RET)等の受容体チロシンキナーゼを阻害した。また、VEGFによって誘導される血管内皮細胞のVEGFR2自己リン酸化、増殖及び血管様管腔構造の形成を阻害した。14)
- 2. 抗腫瘍効果
レンバチニブは、ヒト甲状腺乳頭癌由来K1細胞株、ヒト甲状腺濾胞癌由来RO82-W-1細胞株、ヒト甲状腺髄様癌由来TT細胞株、ヒト甲状腺未分化癌由来8305C細胞株及びヒト甲状腺由来扁平上皮癌由来SW579細胞株を移植したマウスにおいて、腫瘍増殖抑制作用を示した。15)
有効成分に関する理化学的知見
- 一 般 名
レンバチニブメシル酸塩(Lenvatinib Mesilate)
- 化 学 名
4-{3-Chloro-4-[(cyclopropylcarbamoyl)amino]phenoxy}-7-methoxyquinoline-6-carboxamide monomethanesulfonate
- 分 子 式
C21H19ClN4O4・CH4O3S
- 分 子 量
522.96
- 構 造 式
-
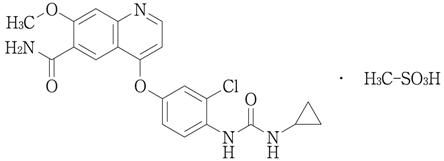
- 性 状
レンバチニブメシル酸塩は白色~うすい帯赤黄色の粉末である。
本品は水、メタノール又はN-メチルピロリドンに溶けにくく、エタノール(99.5)にほとんど溶けない。
- 融 点
221~224℃(分解)
- 分配係数
log P=3.30(1-オクタノール/水系)
承認条件
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
2. 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
包装
レンビマカプセル4mg:20カプセル(PTP10C×2)
レンビマカプセル10mg:20カプセル(PTP10C×2)
主要文献及び文献請求先
主要文献
1) 社内資料:固形がん患者を対象とした臨床第I相試験(国内試験) LEN-0001
- 2) Shumaker, R. et al.:Int. J. Clin. Pharmacol. Ther., 52, 284(2014) LEN-0002
- 3) 社内資料:代謝(in vitro及びin vivo) LEN-0003
- 4) 社内資料:がん患者を対象としたマスバランス試験(外国試験) LEN-0004
- 5) 社内資料:血漿蛋白結合率(in vitro) LEN-0005
- 6) Yamada, K. et al.:Clin. Cancer Res., 17, 2528(2011) LEN-0006
- 7) 社内資料:肝機能障害患者を対象とした臨床薬理試験(外国試験) LEN-0008
- 8) 社内資料:腎機能障害患者を対象とした臨床薬理試験(外国試験) LEN-0009
- 9) 社内資料:ケトコナゾールとの薬物相互作用試験(外国試験) LEN-0010
- 10) 社内資料:リファンピシンとの薬物相互作用試験(外国試験) LEN-0011
- 11) 社内資料:トランスポーター(in vitro) LEN-0018
- 12) 社内資料:131I難治性の甲状腺分化癌患者を対象とした臨床第III相試験(国際共同試験) LEN-0012
- 13) 社内資料:進行性甲状腺癌患者を対象とした臨床第II相試験(国内試験) LEN-0014
- 14) 社内資料:In vitro薬理試験 LEN-0015
- 15) 社内資料:In vivo薬理試験 LEN-0016
文献請求先
文献請求先・製品情報お問い合わせ先
エーザイ株式会社 hhcホットライン
- 電話番号
0120-419-497
製造販売業者等の氏名又は名称及び住所
製造販売元
エーザイ株式会社
東京都文京区小石川4‐6‐10
Generic Name: lenvatinib
Date of Approval: February 13, 2015
Company: Eisai Co., Ltd.
Treatment for: Thyroid Cancer
卫材新型甲状腺癌药物Lenvima在日本获批准上市
3月26日,卫材宣布该公司在日本为其自行开发的新型抗癌制剂Lenvima(lenvatinib mesylate)赢得上市批准,用于不可切除的甲状腺癌治疗。
在一项Lenvima用于分化型甲状腺癌的全球3期研究(SELECT研究)中,Lenvima与安慰剂相比,能明显延长患者的无进展生存期,提高有效率。在SELECT研究中,与Lenvima治疗相关的五种最常见任何级别的不良事件是高血压、腹泻、疲劳或虚弱、食欲下降及体重减轻。
此外,在日本进行的一项2期研究结果显示,Lenvima用于甲状腺髓样癌与未分化甲状腺癌也具有好的疗效和耐受性。基于这些研究结果,Lenvima成为在日本获批用于不可切除甲状腺癌的首款分子靶向治疗药物,用于分化型甲状腺癌及甲状腺髓样癌和未分化甲状腺癌。
日本甲状腺癌患者的人数预计有1.3万-2.9万人。对多数类型的甲状腺癌来说,治疗是可能的,但对于不可切除的甲状腺癌,几乎没有治疗选择,所以迫切需要开发新的治疗药物。
未分化甲状腺癌尤其是一种有明显未满足医疗需求的疾病,其临床恶化程度高,预后最差。通过这次批准,卫材期望Lenvima作为不可切除甲状腺癌的最新治疗标准,能对患者有所帮助,甲状腺癌目前在日本尚无确立的标准治疗。
Lenvima是一种口服给药的分子靶向制剂,它能选择性抑制几种不同分子的活性,包括VEGFR、 FGFR、RET、KIT和PDGFR。这款药物尤其能同时抑制VEGFR、FGFR以及RET,而这些分子主要参与甲状腺癌的肿瘤血管生成及增殖。
此外,在动力学分析中,通过X-射线共晶结构分析,Lenvima证明与VEGFR2有一种新的结合方式,对靶向分子展现出了快速结合,对酶活性有强效抑制。
Lenvima于2015年2月在美国投放市场,用于局部复发或转移性、侵袭性、放射性碘难治型分化型甲状腺癌治疗。目前,这款药物正在欧盟、瑞士、韩国、加拿大、新加坡、俄罗斯、澳大利亚及巴西接受上市审评。另外,卫材正在进行一项Lenvima用于肝细胞癌的全球3期试验,及用于几种其它肿瘤的2期研究,如肾细胞癌和非小细胞肺癌。
根据批准的条件,除了作为一种新的治疗选择用于甲状腺癌之外, Eisai需要对Lenvima进行一项上市后观察性研究,以促使Lenvima的合理应用。为了进一步帮助患者及他们的家庭,卫材致力于探索Lenvima潜在的临床收益。
|









