作成又は改訂年月
**2011年2月改訂(第3版,事務連絡等に基づく使用上の注意の項の改訂)
*2009年6月改訂
日本標準商品分類番号
873999
日本標準商品分類番号等
国際誕生年月
2008年10月
薬効分類名
抗線維化剤
承認等
販売名
ピレスパ錠200mg
販売名コード
3999025F1021
承認・許可番号
承認番号
22000AMX02373
商標名
Pirespa
薬価基準収載年月
2008年12月
販売開始年月
2008年12月
貯法・使用期限等
貯 法
室温保存
使用期限
外箱等に表示(使用期間4年)
規制区分*
劇薬
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
成分・含量(1錠中):
ピルフェニドン200mg
添加物:
乳糖水和物,カルメロースカルシウム,ヒドロキシプロピルセルロース,ステアリン酸マグネシウム,ヒプロメロース,クエン酸トリエチル,酸化チタン,タルク,黄色三二酸化鉄
性状
性状・剤形:
淡黄色~淡黄褐色の楕円形のフィルムコーティング錠である。
外形:

大きさ:
長径 約12.2mm
短径 約 6.4mm
厚さ 約 4.5mm
重量:
約0.30g
識別コード:
@521:200

一般的名称
ピルフェニドン錠
警告
1.
本剤の使用にあたっては,光遺伝毒性試験において染色体構造異常を示し,光曝露に伴う皮膚の発がんの可能性があることを患者に十分に説明し,理解したことを確認した上で投与を開始すること。[「重要な基本的注意」及び「その他の注意」の項参照]
2.
本剤の使用は,特発性肺線維症の治療に精通している医師のもとで行うこと。
|
禁忌
(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
|
効能又は効果/用法及び用量
効能又は効果
特発性肺線維症
用法及び用量
通常,成人にはピルフェニドンとして初期用量1回200mgを1日3回(1日600mg)食後に経口投与し,患者の状態を観察しながら1回量を200mgずつ漸増し,1回600mg(1日1800mg)まで増量する。
なお,症状により適宜増減する。
用法及び用量に関連する使用上の注意
1.
本剤は初期用量として1回200mg(1日600mg)から開始し,2週間を目安に1回200mgずつ漸増し,1回600mg(1日1800 mg)で維持することが望ましい。
2.
胃腸障害等の発現時には必要に応じて減量又は休薬を検討すること。なお,症状が軽減した場合,1.に従い漸増し,維持用量の目安を1回400mg(1日1200mg)以上とすることが望ましい。
3.
食後投与と比べ空腹時投与では,本剤の血漿中濃度が高値を示し,副作用があらわれるおそれがあるので,食後に投与すること。[「薬物動態」の項参照]
使用上の注意**
慎重投与
(次の患者には慎重に投与すること)
1.
肝機能障害のある患者[肝機能障害を悪化させるおそれがある。]
2.
腎機能障害のある患者[使用経験が少ない。]
3.
高齢者[「高齢者への投与」の項参照]
重要な基本的注意
1.
光線過敏症があらわれることがあり,また,光曝露に伴う皮膚の発がんの可能性があるため,投与にあたっては,事前に患者に対し以下の点について十分に指導すること。
(1)
外出時には長袖の衣服,帽子等の着用や日傘,日焼け止め効果の高いサンスクリーン(SPF50+,PA+++)の使用により,紫外線にあたることを避けるなど,光曝露に対する防護策を講じること。[「その他の注意」の項参照]
(2)
発疹,そう痒等の皮膚の異常が認められた場合には,速やかに医師に連絡すること。
2.
眠気,めまい,ふらつきが起こることがあるので,本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないように注意すること。
3.
AST(GOT),ALT(GPT)等の上昇を伴う肝機能障害,黄疸があらわれることがあるので,本剤投与中は定期的に検査を行い,患者の状態を十分に観察すること。[「重大な副作用」の項参照]
副作用
副作用等発現状況の概要
承認時における安全性評価対象例265例中,副作用は233例(87.9%)に認められた。主なものは,光線過敏症137例(51.7%),食欲不振61例(23.0%),胃不快感37例(14.0%),嘔気32例(12.1%)であった。
また,臨床検査値の異常変動は安全性評価対象例265例中120例(45.3%)に認められた。主なものは,γ-GTP上昇53例(20.0%)であった。
重大な副作用
1.
肝機能障害,黄疸(0.1~1%未満):AST(GOT),ALT(GPT)等の上昇を伴う肝機能障害,黄疸があらわれ,肝不全に至ることがあるので,定期的に検査を行うなど観察を十分に行い,異常が認められた場合には投与を中止 するなど,適切な処置を行うこと。
2.
無顆粒球症,白血球減少,好中球減少(頻度不明):無顆粒球症,白血球減少,好中球減少があらわれることがあるので,定期的に血液検査を行うなど観察を十分に行い,異常が認められた場合には投与を中止するなど,適切な処置を行うこと。
その他の副作用
次のような副作用があらわれた場合には,必要に応じて,減量又は投与を中止するなど適切な処置を行うこと。
皮膚:
5%以上
光線過敏症(51.7%),発疹
皮膚:
1~5%未満
そう痒,紅斑,湿疹,扁平苔癬
消化器:
5%以上
食欲不振(23.0%),胃不快感(14.0%),嘔気(12.1%),下痢,胸やけ
消化器:
1~5%未満
腹部膨満感,嘔吐,便秘,逆流性食道炎,口内炎,腹部不快感,腹痛,口唇炎
消化器:
1%未満
口唇びらん
循環器:
1~5%未満
動悸
精神神経系:
5%以上
眠気,めまい,ふらつき(感)
精神神経系:
1~5%未満
頭痛,頭重
精神神経系:
頻度不明
抑うつ,不安,不眠
肝臓:
5%以上
γ-GTP上昇(20.0%),AST(GOT)上昇,ALT(GPT)上昇,Al-P上昇,LDH上昇
肝臓:
1~5%未満
ビリルビン上昇
血液:
1~5%未満
白血球増加,好酸球増加
血液:
1%未満
血小板減少
その他:
5%以上
倦怠感
その他:
1~5%未満
体重減少,発熱,味覚異常,筋骨格痛,ほてり
高齢者への投与
一般に高齢者では生理機能が低下しているので,慎重に投与すること。
妊婦、産婦、授乳婦等への投与
1.
妊婦又は妊娠している可能性のある婦人には投与しないことが望ましい。[ラットにおいて,妊娠期間の延長及び出生率の低下,胎児への移行が認められている。また,ウサギでは,流産又は早産が認められている。なお,いずれの動物試験においても催奇形性は認められなかった 1),2)。]
2.
授乳中の婦人には本剤投与中は授乳を避けさせること。[ラットにおいて,乳汁中への移行及び哺育中期以降に出生児の体重増加抑制が認められている 2),3)。]
小児等への投与
低出生体重児,新生児,乳児,幼児又は小児に対する安全性は確立していない。[使用経験がない。]
適用上の注意
薬剤交付時:PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により,硬い鋭角部が食道粘膜へ刺入し,更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
その他の注意
1.
チャイニーズハムスター肺由来培養細胞を用いた光染色体異常試験において,光照射による染色体構造異常誘発性が認められており,光毒性(光線過敏症)が惹起される血漿中濃度と光遺伝毒性を生じる薬物濃度に乖離がないことから,光曝露に伴う皮膚の発がんの可能性がある 4)。
2.
モルモットを用いた皮膚光毒性試験において,皮膚光毒性を有することが認められた。なお,SPF50+,PA+++のサンスクリーンで光毒性の発現を予防できることが確認されている 5)。
3.
マウス,ラットを用いた長期がん原性試験(104週)において,肝細胞腫瘍(マウス800mg/kg/日以上,ラット750mg/kg/日以上)及び子宮腫瘍(ラット1500mg/kg/日)の発生増加が認められたが,いずれもげっ歯類に特異的な機序によるものと考えられる 6)。なお,遺伝毒性試験の結果は陰性であった 7)。
4.
ラット,イヌを用いた心血管系試験において,血圧低下(ラット300mg/kg),心拍数増加(ラット,イヌともに100mg/kg以上)が観察され,心電図では,房室ブロック(ラット100mg/kg以上),連発性の心室性期外収縮(ラット300mg/kg),QTc間隔への影響(イヌ100mg/kg以上)が認められた。なお, in vitro心臓電気生理学的試験では,心筋活動電位やhERG電流に対する影響は少ないことが確認されている 8)。
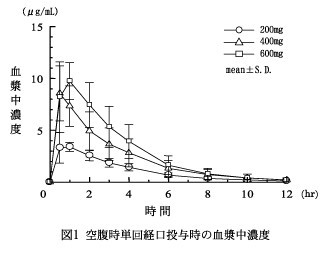
薬物動態
1.
血漿中濃度
(1)
空腹時単回投与
健康成人男性各6例に200mg,400mg及び600mgを空腹時単回経口投与したときの血漿中濃度及び薬物動態パラメータを図1・表1に示す。
Cmax,AUCはいずれも投与量にほぼ比例して増加した 9)。
表1 薬物動態パラメータ参照
(2)
反復投与
健康成人男性12例に200mg,400mg及び600mgを漸増法でそれぞれ1日3回朝,昼,夕の毎食後6日間(投与第1日目及び6日目は朝と昼投与の1日2回)計18日間反復経口投与したときの薬物動態パラメータを表2に示す。
各投与量における投与第1日目と6日目の血漿中濃度はほぼ同様の時間推移を示し,投与第1日目のCmax,AUCはいずれも投与量の増加に従い比例的に増大した 9)。
表2 薬物動態パラメータ参照
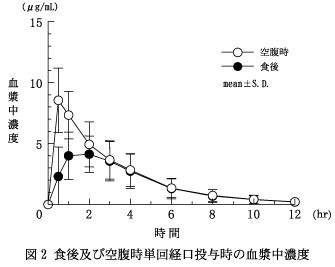
2.
食事の影響
健康成人男性6例に400mgを食後及び空腹時単回経口投与したときの血漿中濃度及び薬物動態パラメータを図2・表3に示す。
食事によりCmax,AUCは有意に低下し,Tmaxは有意に遅延した 9)。
表3 薬物動態パラメータ参照
3.
分布
(参考)
ラットに[14C]-ピルフェニドン100mg/kgを単回経口投与したとき,血漿より高い放射能濃度を示す臓器・組織は,肝臓,腎臓,膵臓及び包皮腺であった。大部分の臓器・組織中放射能濃度は,投与後5~30分に最高濃度を示した後,半減期4~7時間で消失したが,包皮腺の半減期は他組織に比べ長く約15時間であった 10)。
4.
代謝
ヒト肝ミクロソームにおいて複数のCYP分子種(CYP1A2,2C9,2C19,2D6,2E1)によって代謝される 11)。(in vitro)
代謝反応に複数のCYP分子種が関与するため,他剤によるCYP阻害の影響を受けにくいと推察される。
5.
排泄
健康成人男性各6例に200mg,400mg及び600mgを空腹時単回経口投与したとき,いずれの投与量においても48時間までの尿中排泄率は未変化体1%未満,ピルフェニドン-5-カルボン酸体(主代謝物)約90%であった 9)。
6.
その他
血清蛋白結合率:健康成人に600mgを空腹時単回経口投与したとき,限外ろ過法にて測定した血清蛋白結合率は,投与後1時間及び3時間後において,54~62%であった 9)。
薬物動態の表
表1 薬物動態パラメータ
投与量
(mg) |
n |
Cmax
(μg/mL) |
Tmax
(hr) |
AUC0-48
(μg・hr/mL) |
T1/2
(hr) |
| 200 |
6 |
3.88±0.82 |
0.75±0.27 |
13.97±2.71 |
2.10±0.45 |
| 400 |
6 |
9.24±1.74 |
0.58±0.20 |
29.10±11.77 |
1.96±0.55 |
| 600 |
6 |
10.57±1.78 |
0.83±0.26 |
37.03±11.97 |
1.76±0.40 |
(測定法:HPLC)(mean±S.D.)
表2 薬物動態パラメータ
1回
投与量
(mg) |
n |
投与日
(通算) |
Cmax0-4a)
(μg/mL) |
Tmax0-4a)
(hr) |
Cmax4-24b)
(μg/mL) |
Tmax4-24b)
(hr) |
AUC0-24c)
(μg・hr/mL) |
T1/2
(hr) |
| 200 |
12 |
1 |
2.71±0.91 |
1.08±0.47 |
2.83±1.12 |
6.04±1.05 |
19.17±6.46 |
2.17±0.30 |
| 200 |
12 |
6 |
3.06±1.28 |
1.08±0.82 |
2.70±0.51 |
6.29±0.96 |
22.03±5.47 |
2.25±0.29 |
| 400 |
12 |
1(7) |
4.94±1.29 |
1.79±0.89 |
6.22±1.59 |
5.79±1.36 |
46.13±10.01 |
2.42±0.48 |
| 400 |
12 |
6(12) |
6.19±1.89 |
1.17±0.54 |
5.91±2.09 |
6.38±1.15 |
48.69±11.21 |
2.36±0.38 |
| 600 |
12 |
1(13) |
8.20±1.29 |
1.25±0.45 |
9.21±1.97 |
6.33±1.15 |
77.22±15.44 |
2.53±0.42 |
| 600 |
12 |
6(18) |
8.19±1.54 |
1.71±0.54 |
10.00±1.70 |
6.13±1.00 |
82.31±16.50 |
2.55±0.45 |
a) 朝投与における値 b) 昼投与における値 c) 1日2回投与における値 (測定法:HPLC)(mean±S.D.)
表3 薬物動態パラメータ
| 投与量(mg) |
投与量(mg) |
n |
Cmax
(μg/mL) |
Tmax
(hr) |
AUC0-48
(μg・hr/mL) |
T1/2
(hr) |
| 400 |
食後 |
6 |
4.88±1.72 |
1.83±0.75 |
22.13±10.63 |
1.77±0.55 |
| 400 |
空腹時 |
6 |
9.24±1.74 |
0.58±0.20 |
29.10±11.77 |
1.96±0.55 |
(測定法:HPLC)(mean±S.D.)
臨床成績
承認時におけるプラセボを対照とした二重盲検比較試験において,ピルフェニドン投与はプラセボに比べて肺活量の低下を抑制することが示された(表4)。なお,本試験の対象は,厚生労働省びまん性肺疾患調査研究班第4次改訂の特発性間質性肺炎の臨床的診断基準に基づき特発性肺線維症と診断され,投与前に実施したトレッドミルを用いた6分間歩行試験時の労作時SpO2最低値が85%以上かつ安静時SpO2との差が5%以上である患者とした 12)。
表4 肺活量の変化量の比較 注1参照
臨床成績の表
表4 肺活量の変化量の比較 注1
| 群 |
群 |
有効性評価対象例数 |
調整平均(L) |
標準
誤差 |
プラセボ群との比較 |
プラセボ群との比較 |
| 群 |
群 |
有効性評価対象例数 |
調整平均(L) |
標準
誤差 |
調整平均の差(90%信頼区間) |
両側p値 |
| ピルフェニドン |
1800mg/日 |
104 |
-0.09 |
0.02 |
0.07
(0.01,0.13) |
0.0416 |
| ピルフェニドン |
1200mg/日 |
54 |
-0.08 |
0.03 |
0.09
(0.02,0.16) |
0.0394 |
| プラセボ |
プラセボ |
103 |
-0.16 |
0.02 |
- |
- |
注1:投与前値を共変量とした共分散分析
薬効薬理
炎症性サイトカイン(TNF-α,IL-1,IL-6等)の産生抑制と抗炎症性サイトカイン(IL-10)の産生亢進を示し,Th2型への偏りの改善(Th1・Th2バランスの修正)につながるIFN-γレベルの低下の抑制を示し,線維化形成に関与する増殖因子(TGF-β1,b-FGF,PDGF)の産生抑制を示すなどの各種サイトカイン及び増殖因子に対する産生調節作用を有する。また,線維芽細胞増殖抑制作用やコラーゲン産生抑制作用も有する。これらの複合的な作用に基づき抗線維化作用を示すと考えられる 13)。
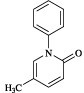
有効成分に関する理化学的知見
一般的名称:
ピルフェニドン(JAN)
Pirfenidone
化学名:
5-Methyl-1-phenyl-1H-pyridin-2-one
分子式:
C12H11NO
分子量:
185.22
化学構造式:
性状:
白色~微黄白色の結晶性の粉末である。
メタノール,エタノール(99.5)又はジメチルスルホキシドに溶けやすく,水にやや溶けにくい。
融点:
108.2℃
包装
 
ピレスパ錠200mg:瓶500錠
ピレスパ錠200mg:PTP100錠(10錠×10)
主要文献及び文献請求先
主要文献名
〔文献請求番号〕
1) 社内資料(胎盤・胎児移行性)〔200801753〕
2) 社内資料(生殖発生毒性試験)〔200801754〕
3) 社内資料(乳汁移行性)〔200801755〕
4) 社内資料(光遺伝毒性)〔200801779〕
5) 社内資料(皮膚光感作性試験及び皮膚光毒性試験)〔200801778〕
6) 社内資料(がん原性試験)〔200801756〕
7) 社内資料(遺伝毒性試験)〔200801757〕
8) 社内資料(安全性薬理試験,心血管系)〔200801758〕
9) 社内資料(臨床における薬物動態)〔200801760〕
10) 社内資料(ラットにおける体内組織への移行性)〔200801761〕
11) 社内資料(酸化的代謝に関与するCYP分子種の同定)〔200801762〕
12) 社内資料(第III相臨床試験)〔200801759〕
13) 社内資料(抗線維化作用メカニズム)〔200801766〕
文献請求先
主要文献に記載の社内資料につきましても下記にご請求ください。
塩野義製薬株式会社 医薬情報センター
〒541-0045大阪市中央区道修町3丁目1番8号
電話0120-956-734
FAX 06-6202-1541
製造販売業者等の氏名又は名称及び住所
製造販売元
塩野義製薬株式会社
〒541-0045 大阪市中央区道修町3丁目1番8号
|