作成又は改訂年月
**2010年6月改訂 (第4版)
*2009年6月改訂
日本標準商品分類番号
872473
薬効分類名
経皮吸収エストラジオール製剤
承認等
販売名
ディビゲル1mg
販売名コード
2473700M1020
承認・許可番号
承認番号
21900AMY00037
欧文商標名
DIVIGEL1mg
薬価基準収載年月
2007年9月
販売開始年月
2007年11月
貯法・使用期限等
貯法:
室温保存
使用期限:
包装に表示の使用期限内に使用すること
開封後は速やかに使用すること
規制区分
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
成分・含量
1包 (1.0g) 中エストラジオール1mg
添加物
エタノール、プロピレングリコール、カルボキシビニルポリマー、トリエタノールアミンを含有する。
性状
本品は乳白色透明の軟膏 (ゲル) 剤である。
識別コード
なし
一般的名称
エストラジオール軟膏 (ゲル) 剤
禁忌
(次の患者には投与しないこと)
(次の患者には使用しないこと)
1.
**エストロゲン依存性悪性腫瘍 (例えば乳癌、子宮内膜癌) 及びその疑いのある患者[腫瘍の悪化あるいは顕性化を促すことがある。]
2.
乳癌の既往歴のある患者1)
3.
血栓性静脈炎や肺塞栓症のある患者、又はその既往歴のある患者[卵胞ホルモン剤は凝固因子を増加させ、血栓形成傾向を促進するとの報告がある。]
4.
動脈性の血栓塞栓疾患 (例えば、冠動脈性心疾患、脳卒中) 又はその既往歴のある患者 (「その他の注意」の項参照)
5.
本剤の成分に対し過敏症の既往歴のある患者
6.
妊婦又は妊娠している可能性のある女性及び授乳婦 (「妊婦、産婦、授乳婦等への投与」の項参照)
7.
重篤な肝障害のある患者[代謝能が低下しており肝臓への負担が増加するため、症状が増悪することがある。]
8.
診断の確定していない異常性器出血のある患者[出血が子宮内膜癌による場合は、癌の悪化あるいは顕性化を促すことがある。]
9.
ポルフィリン症で急性発作の既往歴のある患者
|
効能又は効果
更年期障害及び卵巣欠落症状に伴う血管運動神経症状 (Hot flush及び発汗)
用法及び用量
通常、成人に対しディビゲル1mg (エストラジオールとして1mg含有) 1包 (1.0g) を1日1回左右いずれかの大腿部もしくは下腹部に、約400cm2の範囲に塗布する。
用法及び用量に関連する使用上の注意
副作用等の発現により本剤の減量が必要と判断された場合、本剤には低用量製剤がないので、使用を中止するなど適切な処置を行うこと。
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
1.
**子宮筋腫のある患者[子宮筋腫の発育を促進するおそれがある。]
2.
子宮内膜症のある患者[症状が増悪するおそれがある。]
3.
乳癌家族素因が強い患者、乳房結節のある患者、乳腺症の患者又は乳房レントゲン像に異常がみられた患者[症状を悪化させるおそれがある。]
4.
高血圧、心疾患、腎疾患のある患者、又はその既往歴のある患者[卵胞ホルモン剤の過量投与では体液貯留をきたし、これらの疾患を悪化させるおそれがある。]
5.
糖尿病患者[耐糖能を低下させるおそれがあるので十分管理を行いながら使用すること。]
6.
片頭痛、てんかんのある患者[症状を悪化させることがあるので、観察を十分に行うこと。]
7.
肝障害のある患者[肝障害を悪化させるおそれがあるので、定期的に肝機能検査を実施するなど観察を十分に行うこと。]
8.
術前又は長期臥床状態の患者[血液凝固能が亢進され、心血管系の副作用の危険性が高くなることがある。]
9.
全身性エリテマトーデスの患者[症状を悪化させるおそれがある。]
重要な基本的注意
1.
外国において、卵胞ホルモン剤と黄体ホルモン剤を長期併用した女性では、乳癌になる危険性が対照群の女性と比較して高くなり、その危険性は併用期間が長期になるに従って高くなるとの報告があるので、本剤の使用にあたっては、患者に対し本剤のリスクとベネフィットについて十分な説明を行うとともに必要最小限の使用にとどめ、漫然と長期使用を行わないこと。(「その他の注意」の項参照)
2.
使用前に病歴、家族素因等の問診、乳房検診ならびに婦人科検診を行い、使用開始後は定期的に血圧、乳房検診ならびに婦人科検診 (子宮を有する患者においては子宮内膜細胞診及び超音波検査による子宮内膜厚の測定を含む) を行うこと。(「慎重投与」の項1.~4.参照)
相互作用
本剤は主に薬物代謝酵素チトクロームP450 (CYP3A4) で代謝されるので、本酵素の活性に影響を及ぼす薬剤と併用する場合には、注意して使用すること。
併用注意
(併用に注意すること)
薬剤名等
リファンピシン
抗てんかん剤
フェノバルビタール
フェニトイン
カルバマゼピン
HIV逆転写酵素阻害剤
エファビレンツ
ネビラピン
セイヨウオトギリソウ (St. John's Wort、セント・ジョーンズ・ワート) 含有食品
ステロイドホルモン
臨床症状・措置方法
本剤の代謝が促進され、血中濃度が低下するおそれがある。
機序・危険因子
これらの薬剤等は薬物代謝酵素チトクロームP450 (CYP3A4) を誘導することにより、本剤の代謝を促進し、血中濃度を低下させる可能性がある。
薬剤名等
プロテアーゼ阻害剤
リトナビル
ネルフィナビル等
臨床症状・措置方法
本剤の血中濃度が変化するおそれがある。
機序・危険因子
これらの薬剤は薬物代謝酵素チトクロームP450 (CYP3A4) を誘導又は阻害する可能性がある。
副作用
副作用等発現状況の概要
〈国内データ〉
更年期障害及び卵巣欠落症状に対する国内臨床試験において、副作用調査対象例数302例中、臨床症状として166例 (55.0%) に副作用が認められた。主な副作用の発現頻度は全身性症状として子宮出血73例 (24.2%)、乳房緊満感39例 (12.9%)、帯下27例 (8.9%) 等であった。
また局所性の皮膚症状 (塗布部位) としては、紅斑34例 (11.3%)、そう痒感19例 (6.3%) 等であった。
また本剤塗布によると思われる主な臨床検査値の異常変動は、トリグリセリド上昇6例 (2.0%)、総コレステロール上昇2例 (0.7%) 等であった。
〈外国データ〉
外国における更年期障害に対する臨床試験 (計461例) において、主な副作用の発現頻度は乳房痛24例 (5.2%)、頭痛20例 (4.3%)、子宮出血15例 (3.3%) 等であった。
重大な副作用
1. アナフィラキシー様症状注1)
(頻度不明)
アナフィラキシー様症状があらわれることがあるので、観察を十分に行い、異常が認められた場合には使用を中止し、適切な処置を行うこと。
2. 静脈血栓塞栓症、血栓性静脈炎注1)
(頻度不明)
このような症状があらわれることがあるので、観察を十分に行い、下肢の疼痛・浮腫、胸痛、突然の息切れ、急性視力障害等の初期症状が認められた場合には使用を中止し、適切な処置を行うこと。また、患者に対しては、異常が認められた場合には直ちに医師等に相談するよう、あらかじめ説明すること。
注1) 国内の臨床試験では認められず、自発報告あるいは外国において認められている。
その他の副作用
次のような副作用が認められた場合には、適切な処置を行うこと。
〈国内データ〉
皮膚 塗布部位
(5%以上)
紅斑、そう痒感
皮膚 塗布部位
(1~5%未満)
刺激感
皮膚 塗布部位
(0.1~1%未満)
皮膚炎、色素沈着、塗布部位反応、湿疹、発疹、熱感、不快感
皮膚 塗布部位以外
(0.1~1%未満)
ざ瘡、湿疹、紅斑、皮下出血
生殖器
(5%以上)
子宮出血、帯下
生殖器
(1~5%未満)
子宮内膜肥厚、子宮筋腫
生殖器
(0.1~1%未満)
腟出血、外陰部そう痒感、外陰腟不快感、子宮体部細胞診異常
乳房
(5%以上)
乳房緊満感
乳房
(1~5%未満)
乳房痛、乳頭痛
乳房
(0.1~1%未満)
乳房腫瘤、乳汁様分泌物、乳腺症、乳房良性腫瘍
精神神経系
(1~5%未満)
頭痛
精神神経系
(0.1~1%未満)
片頭痛、顔面痙攣、めまい、不眠
循環器
(0.1~1%未満)
血圧上昇、高血圧、動悸
消化器
(1~5%未満)
下腹部痛、悪心
消化器
(0.1~1%未満)
便秘、胃炎、萎縮性胃炎、胃ポリープ、結腸ポリープ、腹部不快感、胃不快感、腹部膨満感、腹痛、口唇炎
電解質代謝
(0.1~1%未満)
顔面浮腫、カリウム低下
過敏症
(1~5%未満)
全身のそう痒
過敏症
(0.1~1%未満)
発疹、蕁麻疹
肝臓
(0.1~1%未満)
胆石症、胆嚢炎、脂肪肝、Al-P上昇、ALT (GPT) 上昇、AST (GOT) 上昇
呼吸器系
(0.1~1%未満)
鼻出血
泌尿器系
(0.1~1%未満)
乏尿
その他
(1~5%未満)
トリグリセリド上昇、体重の増加
その他
(0.1~1%未満)
関節痛、背部痛、四肢痛、筋骨格硬直、胸痛、腋窩痛、高脂血症、けん怠感、白血球数減少、貧血、ヘモグロビン減少、フィブリノーゲン増加、総コレステロール上昇、トリグリセリド低下、HDL上昇、血糖値上昇
〈外国データ〉
皮膚
(頻度不明)
皮膚刺激感
皮膚
(1~5%未満)
そう痒感
皮膚
(0.1~1%未満)
湿疹、ざ瘡、肝斑、多汗症、腫脹
生殖器
(頻度不明)
子宮内膜症
生殖器
(1~5%未満)
子宮出血
生殖器
(0.1~1%未満)
子宮癌、子宮筋腫、子宮頚管ポリープ、腟出血
乳房
(頻度不明)
乳癌
乳房
(5%以上)
乳房痛
精神神経系
(頻度不明)
片頭痛
精神神経系
(1~5%未満)
頭痛、めまい
精神神経系
(0.1~1%未満)
うつ病、攻撃性、回転性眩暈、感覚減退
循環器
(頻度不明)
高血圧、静脈血栓塞栓症、上行大動脈の拡張、肺塞栓症
循環器
(0.1~1%未満)
大脳血栓症、深部静脈血栓症、静脈血栓症、狭心症、不整脈
消化器
(頻度不明)
嘔吐、胃痙攣
消化器
(1~5%未満)
腹痛
消化器
(0.1~1%未満)
悪心
電解質代謝
(頻度不明)
眼瞼浮腫、顔面浮腫
電解質代謝
(1~5%未満)
全身浮腫
過敏症
(頻度不明)
斑状発疹
過敏症
(0.1~1%未満)
発疹、過敏症
肝臓
(頻度不明)
肝機能及び胆汁流量の変化、胆嚢炎、胆石症
その他
(頻度不明)
リビドーや気分の変化、急性膵炎
その他
(1~5%未満)
疲労感
その他
(0.1~1%未満)
背部痛、体重増加、ほてり
高齢者への投与
一般に高齢者では生理機能が低下しているので、患者の状態を観察しながら慎重に使用すること。
妊婦、産婦、授乳婦等への投与
1.
妊婦又は妊娠している可能性のある女性には使用しないこと。[卵胞ホルモン剤であるジエチルスチルベストロールを妊娠動物あるいは妊婦に投与したとき、出生児に生殖器系臓器の異常が報告されている。エストラジオールのヒトにおける催奇形性の報告はないが、妊娠動物への投与によって児の生殖器系臓器に異常が起こることが報告されている。ヒトにおいて、妊娠中の女性ホルモン剤 (経口避妊薬等) 投与によって児の先天性異常 (先天性心臓奇形及び四肢欠損症) のリスク増加の報告がある。]
2.
授乳中の女性には使用しないこと。[ヒトにおいて、母乳中への移行が報告されている。また、動物実験 (マウス) で新生児に卵胞ホルモン剤を投与した場合、児の成長後腟上皮の癌性変化を認めたとの報告がある。]
3.
卵胞ホルモン剤を妊娠動物に投与した場合、児の成長後、腟上皮及び子宮内膜の癌性変化を示唆する結果が報告されている。また新生児に投与した場合、児の成長後腟上皮の癌性変化を認めたとの報告がある。
適用上の注意
塗布部位
(1)
毎日塗布部位を変えて塗布することが望ましい。
(2)
胸部、顔、外陰部及び粘膜には塗布しないこと。
(3)
創傷又は湿疹・皮膚炎等 (重度の乾燥や日焼けなどによる皮膚炎も含む) がみられる部位は避けて塗布すること。
塗布時
(1)
本剤は開封後速やかに患者自身で塗布すること。
(2)
本剤は、用法・用量に記載した範囲を大きく超えて塗り広げると吸収量が低下するので用法・用量にしたがって塗布すること。
(3)
塗布後、ゲルを数分間乾かし、塗布部位は1時間以内に洗浄しないこと。
(4)
塗布直後は塗布部位を他人に触れさせないこと。
(5)
塗布後手を洗うこと。
(6)
眼に入らないように注意すること。
(7)
飲用しないこと。
(8)
本剤は、アルコールを含有するため、アルコール過敏症の患者に使用した場合、かぶれ、発疹等の過敏症状があらわれることがあるので使用に際し注意すること。
(9)
保湿クリーム、日焼け止めクリーム等の影響については確認を行っていないため、可能な限り同時使用を避けること。
その他の注意
1.
本剤は、持続的あるいは周期的治療に用いることができる。子宮を有する患者に対しては、エストロゲン刺激性の子宮内膜増殖症を防ぐために適当な期間、1ヵ月に少なくとも12から14日間、持続的に適当量の黄体ホルモン剤を併用することが推奨される。
併用方法は、以下に示す持続的投与法又は周期的投与法のいずれかの方法で行うことが望ましい。
(1)
持続的投与法
黄体ホルモン剤を原則として連日経口投与する。  (2)
周期的投与法
28日間を一周期として、その後半の12~14日間に、黄体ホルモン剤を経口投与する。 
2.
ホルモン補充療法 (HRT) と子宮内膜癌の危険性
卵胞ホルモン剤を長期間 (約1年以上) 使用した閉経期以降の女性では、子宮内膜癌になる危険性が対照群の女性と比較して高く、この危険性は、使用期間に相関して上昇し (1~5年間で2.8倍、10年以上で9.5倍)、黄体ホルモン剤の併用により抑えられる (対照群の女性と比較して0.8倍) との疫学調査の結果が報告されている2)。
3.
HRTと乳癌の危険性
(1)
米国における閉経後女性を対象とした無作為化臨床試験 (Women's Health Initiative (WHI) 試験) の結果、結合型エストロゲン・黄体ホルモン配合剤投与群では、乳癌になる危険性がプラセボ投与群と比較して有意に高くなる (ハザード比: 1.24) との報告がある3)。並行して行われた子宮摘出者に対する試験の結果、結合型エストロゲン単独投与群では、乳癌になる危険性がプラセボ投与群と比較して有意差はない (ハザード比: 0.80) との報告がある4, 5)。
(2)
英国における疫学調査 (Million Women Study (MWS)) の結果、卵胞ホルモン剤と黄体ホルモン剤を併用している女性では、乳癌になる危険性が対照群と比較して有意に高くなり (2.00倍)、この危険性は、併用期間が長期になるに従って高くなる (1年未満: 1.45倍、1~4年: 1.74倍、5~9年: 2.17倍、10年以上: 2.31倍) との報告がある6)。
4.
HRTと冠動脈性心疾患の危険性
米国におけるWHI試験の結果、結合型エストロゲン・黄体ホルモン配合剤投与群では、冠動脈性心疾患の危険性がプラセボ投与群と比較して高い傾向にあり、特に服用開始1年後では有意に高くなる (ハザード比: 1.81) との報告がある7)。並行して行われた子宮摘出者に対する試験の結果、結合型エストロゲン単独投与群では、冠動脈性心疾患の危険性がプラセボ投与群と比較して有意差はない (ハザード比: 0.91) との報告がある4)。
5.
HRTと脳卒中の危険性
米国におけるWHI試験の結果、結合型エストロゲン・黄体ホルモン配合剤投与群では、脳卒中 (主として脳梗塞) の危険性がプラセボ投与群と比較して有意に高くなる (ハザード比: 1.31) との報告がある8)。並行して行われた子宮摘出者に対する試験の結果、結合型エストロゲン単独投与群では、脳卒中 (主として脳梗塞) の危険性がプラセボ投与群と比較して有意に高くなる (ハザード比: 1.37) との報告がある4, 9)。
6.
HRTと認知症の危険性
米国における65歳以上の閉経後女性を対象とした無作為化臨床試験 (WHI Memory Study (WHIMS)) の結果、結合型エストロゲン・黄体ホルモン配合剤投与群では、アルツハイマーを含む認知症の危険性がプラセボ投与群と比較して有意に高くなる (ハザード比: 2.05) との報告がある10)。並行して行われた子宮摘出者に対する試験の結果、結合型エストロゲン単独投与群では、アルツハイマーを含む認知症の危険性がプラセボ投与群と比較して有意ではないが、高い傾向がみられた (ハザード比: 1.49) との報告がある11)。
7.
HRTと卵巣癌の危険性
(1)
卵胞ホルモン剤を長期間使用した閉経期以降の女性では、卵巣癌になる危険性が対照群の女性と比較して高くなるとの疫学調査の結果が報告されている12, 13, 14)。
(2)
米国におけるWHI試験の結果、結合型エストロゲン・黄体ホルモン配合剤投与群において、卵巣癌になる危険性がプラセボ投与群と比較して有意ではないが、高い傾向がみられた (ハザード比: 1.58) との報告がある15)。
8.
HRTと胆嚢疾患の危険性
米国におけるWHI試験の結果、結合型エストロゲン・黄体ホルモン配合剤投与群において、胆嚢疾患になる危険性がプラセボ投与群と比較して有意に高くなる (ハザード比: 1.59) との報告がある16)。並行して行われた子宮摘出者に対する試験の結果、結合型エストロゲン単独投与群では、胆嚢疾患になる危険性がプラセボ投与群と比較して有意に高くなる (ハザード比: 1.67) との報告がある16)。
9.
卵胞ホルモン剤投与と乳癌発生との因果関係については未だ明らかではないが、使用期間と相関性があることを示唆する疫学調査の結果が報告されている17)。
10.
卵胞ホルモン剤の長期投与により、ヒトで肝腫瘍が発生したとの報告がある。
11.
実験動物に卵胞ホルモン剤を皮下投与 (埋め込み投与を含む) したとき、マウスにおけるリンパ系腫瘍、ラットの下垂体腺腫及びハムスターにおいては腎腫瘍の発生が報告されている。
薬物動態
1.
血清中濃度
閉経後女性10例に本剤を1日1回14日間反復塗布したとき、血清中エストラジオール濃度は3日から5日で定常状態に達するものと推定された。最終塗布後の最高血清中濃度 (Cmax) は40.5±12.6pg/mL (平均±標準偏差)、最終塗布後24時間までの血清中濃度-時間曲線下面積(AUC 0-24) は712.6±174.5pg・hr/mLであった。最終塗布後24時間での血清中エストラジオール濃度は26.4±9.6pg/mLで、以降約70時間の半減期で消失した。また、初回塗布後と最終塗布後のトラフ値の比較により求めた蓄積係数は2.0であった 18)。 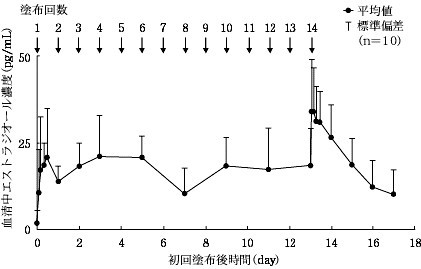 閉経後女性に本剤を1日1回14日間反復塗布したときの血清中エストラジオール濃度推移 閉経後女性に本剤を1日1回14日間反復塗布したときの血清中エストラジオール濃度推移 更年期障害及び卵巣欠落症状を有する患者102例に本剤を1日1回反復塗布したとき、血清中エストラジオール濃度は塗布前値 (13.85±22.16pg/mL) から、塗布後4週で77.38±77.50pg/mL、塗布後8週で64.26±49.46pg/mLに上昇した 19)。 閉経後外国人女性16例に本剤を200cm 2、400cm 2及び可能な限り広い面積 (最大面積) に1日1回14日間反復塗布したときの血清中エストラジオール濃度推移について、最大面積では、200cm 2及び400cm 2よりも、Cmax及びAUC (吸収量) が有意に低下した。一方、200cm 2と400cm 2では、Cmaxに差異を認めるものの吸収量に差はなかった 20)。 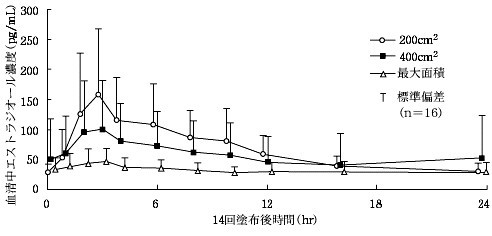 閉経後外国人女性に本剤を200cm2、400cm2及び最大面積に1日1回14日間反復塗布したときの血清中エストラジオール濃度推移 閉経後外国人女性に本剤を200cm2、400cm2及び最大面積に1日1回14日間反復塗布したときの血清中エストラジオール濃度推移 2.
尿中排泄18)
閉経後女性10例に本剤を1日1回14日間反復塗布したときの、エストロン、エストラジオール及びエストリオールの尿中排泄量 (非抱合型+抱合型) をエストラジオールに換算して、24時間間隔での総排泄量を求めた。排泄速度は一定で、尿中累積排泄率は塗布量の約1%であった。
臨床成績
更年期症状又は卵巣欠落症状を有する患者を対象に血管運動神経症状の改善効果としてHot flush発現回数を用いて有効性の評価を行った。
(1)
第II相試験 (プラセボ対照二重盲検試験: 本剤44例、プラセボ50例)21)
37~59歳の患者に本剤又はプラセボを1日1回8週間塗布した。本剤は、最終評価時のHot flush発現回数について、プラセボに対し有意差が認められた (p=0.010、共分散分析)。
(表1参照)
(2)
第III相比較試験 (有効性評価例数102例)19)
35~59歳の患者に本剤を1日1回8週間塗布した。観察期終了時、塗布4、8週後におけるHot flush発現回数は、それぞれ8.32±3.02、2.42±2.15及び1.05±1.56回/日と経時的な減少が認められた。
(3)
長期投与試験 (有効性評価例数98例)22)
36~64歳の患者に本剤を1日1回52週間塗布した。観察期終了時、塗布4、8、28、52週後におけるHot flush発現回数は、それぞれ3.79±3.26、1.20±1.55、0.54±1.05、0.18±0.66及び0.20±0.78回/日であった。
表1 Hot flush発現回数 (回/日) の推移
| |
観察期終了時 |
2週後 |
4週後 |
6週後 |
8週後 |
| ディビゲル1mg |
8.48±4.82 |
4.48±3.03 |
3.16±3.32 |
2.15±2.30 |
1.71±2.36 |
| プラセボ |
8.56±3.32 |
5.29±3.50 |
4.07±3.56 |
3.21±3.36 |
3.09±3.44 |
(平均±標準偏差)
薬効薬理
1.
薬理作用23)
エストロゲン欠乏モデルである卵巣摘出ラットに本剤 (5μL~40μL) を14日間連続経皮投与したところ、卵巣摘出による尾部皮膚温の上昇及び子宮重量の低下を用量に依存して抑制することが確認された。また、本剤投与により発情期の持続が観察された。
2.
作用機序
更年期あるいは卵巣摘出による卵巣機能の急激な低下に伴ったエストロゲンの分泌低下によって、全身の組織及び機能の種々の病的変化 (更年期障害) が生じる。更年期障害の代表的な症状に、Hot flush (のぼせ、ほてり)、発汗などの血管運動神経症状及び泌尿生殖器の萎縮症状があり、直接の原因に対する治療法であるホルモン補充療法が最も効果的で、治療の早期から症状の改善が見られる。本剤は、経皮投与によりエストラジオールを直接全身循環系に到達させることによって血清中エストラジオール濃度を維持させ、これらの症状を軽減させる。
有効成分に関する理化学的知見
一般名:
エストラジオール (Estradiol)
化学名:
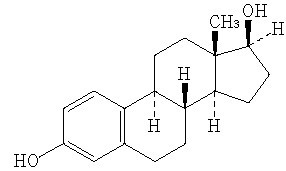
Estra-1, 3, 5 (10)-triene-3, 17β-diol
構造式:
分子式:
C18H24O2
分子量:
272.38
性状:
白色~微黄色の結晶又は結晶性の粉末で、においはない。
1, 4-ジオキサン又はN , N -ジメチルホルムアミドに溶けやすく、アセトンにやや溶けやすく、エタノール (95) にやや溶けにくく、ジエチルエーテルに溶けにくく、水にほとんど溶けない。
硫酸に溶ける。吸湿性である。
融点:
175~180℃
旋光度:
〔α〕20D: +75~+82゜ (乾燥後、0.1g、1, 4-ジオキサン、10mL、100mm)
取扱い上の注意
1.
本剤はアルコールを含有するため、塗布後は十分換気を行い、ゲルが乾燥するまでは火気及び喫煙を避けること。
2.
小児の手の届かないところに保管すること。
包装

ディビゲル1mg: (分包品) 1.0g×140包、1.0g×280包
主要文献及び文献請求先
主要文献
1)
Holmberg, L. et al. : Lancet 363, 453, 2004
2)
Grady, D. et al. : Obstet. Gynecol. 85, 304, 1995
3)
Chlebowski, R.T. et al. : JAMA 289, 3243, 2003
4)
Anderson, G.L. et al. : JAMA 291, 1701, 2004
5)
Stefanick, M.L. et al. : JAMA 295, 1647, 2006
6)
Beral, V. et al. : Lancet 362, 419, 2003
7)
Manson, J.E. et al. : N. Engl. J. Med. 349, 523, 2003
8)
Wassertheil-Smoller, S. et al. : JAMA 289, 2673, 2003
9)
Hendrix, S.L. et al. : Circulation 113, 2425, 2006
10)
Shumaker, S.A. et al. : JAMA 289, 2651, 2003
11)
Shumaker, S.A. et al. : JAMA 291, 2947, 2004
12)
Rodriguez, C. et al. : JAMA 285, 1460, 2001
13)
Lacey, J.V. Jr. et al. : JAMA 288, 334, 2002
14)
Beral, V. et al. : Lancet 369, 1703, 2007
15)
Anderson, G.L. et al. :JAMA 290, 1739, 2003
16)
Cirillo, D.J. et al. : JAMA 293, 330, 2005
17)
Beral, V. et al.: Lancet 350, 1047, 1997
18)
株式会社ポーラファルマ 社内資料: 薬物動態試験 (反復塗布)
19)
株式会社ポーラファルマ 社内資料: 臨床試験 (第III相比較試験)
20)
株式会社ポーラファルマ 社内資料: 薬物動態試験 (塗布面積・洗浄による影響)
21)
株式会社ポーラファルマ 社内資料: 臨床試験 (第II相用量設定試験)
22)
株式会社ポーラファルマ 社内資料: 臨床試験 (長期投与試験)
23)
株式会社ポーラファルマ 社内資料: 非臨床試験 (薬効薬理)
文献請求先
*主要文献に記載の社内資料につきましても下記にご請求ください。
株式会社ポーラファルマ 学術
〒141-0031 東京都品川区西五反田8-9-5
TEL 03-5436-2725
FAX 03-5496-9718
製造販売業者等の氏名又は名称及び住所
製造販売元
株式会社ポーラファルマ
東京都品川区西五反田8-9-5
|