作成又は改訂年月
**2009年12月改訂(第10版、薬事法改正に伴う改訂)
*2006年12月改訂
日本標準商品分類番号
874236
日本標準商品分類番号等
*再審査結果公表年月(最新)
2006年12月
国際誕生年月
1993年10月
薬効分類名
肝細胞癌治療剤
承認等
販売名
スマンクス肝動注用4mg
販売名コード
YJ(医情研)コード
4236401D1032
承認・許可番号
承認番号
21600AMZ00272
商標名
SMANCS 4mg for Hepatic Intra-arterial Injection
薬価基準収載年月
2004年7月
販売開始年月
1994年2月
貯法・使用期限等
貯法
遮光、-8℃以下に保存
使用期限
ケース等に表示(製造後2年)
規制区分
劇薬
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
有効成分(1バイアル中)
日局 ジノスタチン スチマラマー 4mg(力価)
性状
本剤は微黄色の多孔性の塊で、用時懸濁して用いる注射用製剤である。
容器
褐色バイアル
販売名
スマンクス肝動注用6mg
販売名コード
YJ(医情研)コード
4236401D2039
承認・許可番号
承認番号
21600AMZ00273
商標名
SMANCS 6mg for Hepatic Intra-arterial Injection
薬価基準収載年月
2004年7月
販売開始年月
1994年2月
貯法・使用期限等
貯法
遮光、-8℃以下に保存
使用期限
ケース等に表示(製造後2年)
規制区分
劇薬
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
有効成分(1バイアル中)
日局 ジノスタチン スチマラマー 6mg(力価)
性状
本剤は微黄色の多孔性の塊で、用時懸濁して用いる注射用製剤である。
容器
褐色バイアル
一般的名称
注射用ジノスタチン スチマラマー
Zinostatin Stimalamer
警告
ショック、肝不全、急性腎不全及び胃穿孔、消化管出血・潰瘍等の重篤な副作用があらわれることがあるので、緊急時に十分に措置できる医療施設において、本療法に十分な経験を持つ医師が用いること。
|
禁忌
(次の患者には投与しないこと)
1.
ジノスタチン スチマラマー又はヨード系薬剤に対する重篤な過敏症の既往歴のある患者
2.
重篤な甲状腺疾患のある患者[本剤に専用の懸濁用液はヨード化合物であり、ヨード摂取量増加により甲状腺障害を増悪させるおそれがある。]
|
原則禁忌
(次の患者には投与しないことを原則とするが、特に必要とする場合には慎重に投与すること)
総ビリルビン値が3mg/dL以上の患者又は肝癌病変の臨床病期IIIの患者[肝不全等を起こしやすいので、やむを得ず投与する場合は亜区域投与とすること。]
|
効能又は効果
肝細胞癌
用法及び用量
ジノスタチン スチマラマー1mg(力価)に対し、ジノスタチン スチマラマー懸濁用液1mLの割合で加え、約3分間超音波照射を行った後、肝動脈内に挿入されたカテーテルより1日1回4~6mg(力価)を肝動脈内に投与し、約4週間の観察期間をおき、繰り返し投与する。繰り返し投与の場合は6mg(力価)の範囲で適宜増減する。
用法及び用量に関連する使用上の注意
1回投与量が6mgを超す場合あるいは投与間隔が4週間以内の場合は重篤な副作用があらわれることがあるので、用法・用量の範囲内で使用すること。
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
1.
本人又は両親、兄弟に気管支喘息、発疹、蕁麻疹等のアレルギー症状を起こしやすい体質を有する患者
2.
甲状腺疾患のある患者(「禁忌」の項参照)
3.
休薬後に再度本剤の投与を受ける患者[本剤は抗原性を有し、抗体をつくりやすいので過敏症を起こすおそれがある。]
4.
消化性潰瘍のある患者[本剤の胃十二指腸動脈内への流入により消化性潰瘍を悪化させることがある。]
5.
総ビリルビン値が2~3mg/dLまでの患者又は肝癌病変の臨床病期IIの患者あるいは高度門脈閉塞(Vp3)のある患者[肝不全等を起こすおそれがあるので、可能な限り亜区域投与を行うことが望ましい。]
6.
肝内AVシャントのある患者[肺塞栓等を起こすおそれがある。]
7.
肋間動脈への投与が必要な患者[本剤の流入により脊髄梗塞を起こすおそれがある。]
8.
食道静脈瘤のある患者[食道静脈瘤の破裂のおそれがある。]
重要な基本的注意
1.
使用にあたっては添付文書を熟読すること。
2.
肝不全、肝膿瘍、間質性肺炎、急性腎不全等の重篤な副作用があらわれることがあるので、必要に応じて臨床検査(肝機能・腎機能等)を行うなど、患者の状態を十分に観察し、異常が認められた場合には、適切な処置を行うこと。
3.
標的とする部位以外への流入により、重篤な胃穿孔、消化管出血、胃・十二指腸潰瘍や脳梗塞、肺梗塞、肺塞栓、成人呼吸窮迫症候群、脊髄梗塞等が起こることがあるので、投与に際しては以下の点に注意すること。
(1)
本剤は肝動脈(固有肝動脈、右肝動脈、左肝動脈、中肝動脈等)内投与にのみ使用すること。ただし腫瘍の栄養血管が下横隔動脈、左胃動脈等肝動脈以外である場合は、それらの栄養血管の血管走行を十分検査し投与すること。投与に際しては本剤の大動脈への逆流あるいは胃十二指腸動脈内への流入回避に十分注意して、カテーテルを挿入し投与すること。
(2)
門脈本幹との著明なAPシャントのある患者に投与を行う場合には、シャントより肝側までカテーテルを挿入し投与すること。
(3)
本剤が肝動脈内で球状形態となる速度(1mLあたり15~30秒)で少量ずつ投与を行うこと。
4.
本剤に対する過敏症等の反応を予測するため、使用に際しては十分な問診を行うとともにあらかじめジノスタチン スチマラマーによるプリック試験を行うことが望ましい。
5.
生殖可能な年齢の患者に投与する場合には、性腺に対する影響を考慮すること。
副作用
副作用等発現状況の概要
*承認時の臨床試験では177例中170例(96.05%)に、市販後の使用成績調査では、4,779例中1,899例(39.74%)に臨床検査値異常を含む副作用が認められている。(再審査結果通知:2006年12月)
重大な副作用
1.
ショック
(0.1~5%未満)
ショック(血圧低下、呼吸困難、全身潮紅、血管浮腫(顔面浮腫、咽頭浮腫等)、蕁麻疹等)を起こすことがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
2.
肝不全
(0.1~5%未満)
肝不全があらわれることがあるので、必要に応じてビリルビン、コリンエステラーゼ等を含む肝機能検査を行うなど観察を十分に行い、黄疸、腹水等があらわれた場合には適切な処置を行うこと。
3.
肝膿瘍
(0.1~5%未満)
肝膿瘍があらわれることがあるので、発熱の遷延、腹痛、右季肋部痛等が認められた場合には、速やかに腹部超音波検査等を実施し、抗生物質の投与、経皮経肝肝膿瘍ドレナージを行うなど適切な処置を行うこと。
4.
肝内胆汁性嚢胞
(0.1~5%未満)
肝内胆汁性嚢胞があらわれることがあるので、発熱の遷延、上腹部痛等が認められた場合には、速やかに腹部超音波検査等を実施し、必要に応じて嚢胞穿刺にて胆汁の吸入を行うなど適切な処置を行うこと。
5.
間質性肺炎
(0.1%未満)
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎があらわれることがあるので、このような場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
6.
成人呼吸窮迫症候群
(0.1%未満)
成人呼吸窮迫症候群があらわれることがあるので、急速に進行する呼吸困難、低酸素血症、胸部X線による両側性びまん性肺浸潤陰影が認められた場合には呼吸管理、循環管理等適切な処置を行うこと。
7.
急性腎不全
(0.1~5%未満)
急性腎不全等があらわれることがあるので、必要に応じて血清クレアチニン、BUN等を含む腎機能検査を行うなど観察を十分に行い、異常が認められた場合には適切な処置を行うこと。
8.
胃穿孔(頻度不明)、 消化管出血・潰瘍(0.1~5%未満)
胃穿孔、消化管出血、胃・十二指腸潰瘍等があらわれることがあるので、観察を十分に行い、異常が認められた場合には適切な処置を行うこと。
9.
アシドーシス
(0.1未満)
アシドーシスがあらわれることがあるので、観察を十分に行い、このような場合には適切な処置を行うこと。
10.
脊髄梗塞
(頻度不明)
肋間動脈からの投与により、脊髄梗塞、両下肢麻痺等があらわれることがあるので、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
その他の副作用
発熱
5%以上
発熱(27.8%)
発熱
0.1~5%未満
悪寒・戦慄
消化器
5%以上
悪心・嘔吐、腹痛
消化器
0.1~5%未満
食欲不振、腹部膨満感、心窩部不快感、上腹部不快感、びらん性胃炎
消化器
0.1%未満
膵炎
肝臓
0.1~5%未満
ビリルビン上昇、AST(GOT)上昇、ALT(GPT)上昇、γ- GTP上昇、Al- P上昇、LDH上昇、コリンエステラーゼ低下、黄疸、総蛋白低下、アルブミン低下、赤沈亢進、コレステロール低下、ウロビリン尿、腹水
肝臓
0.1%未満
ICGR15上昇、A/G 低下、肝萎縮、血清アンモニア値上昇
胆のう、胆管
0.1~5%未満
胆のう炎
胆のう、胆管
0.1%未満
胆のう壊死、胆管炎、胆管狭窄
胆のう、胆管
頻度不明
胆管壊死
血液
0.1~5%未満
貧血、血小板減少、白血球増多、白血球減少、好中球増多、好酸球増多、リンパ球減少、単球増多、プロトロンビン時間延長
血液
0.1%未満
好塩基球増多、好中球減少、リンパ球増多
泌尿器
0.1~5%未満
BUN上昇、血清クレアチニン上昇、尿中NAG上昇
泌尿器
0.1%未満
蛋白尿、尿酸上昇、尿糖、尿沈渣異常、血尿
皮膚注)
0.1%未満
紅斑、潰瘍
皮膚注)
頻度不明
びらん、皮下脂肪組織炎
過敏症
0.1~5%未満
発疹、潮紅
循環器
0.1~5%未満
血圧低下、血圧上昇、肝動脈狭小化及び閉塞
循環器
0.1%未満
徐脈
循環器
頻度不明
血管炎
呼吸器
0.1~5%未満
胸水、しゃっくり
呼吸器
0.1%未満
呼吸困難、胸膜炎
呼吸器
頻度不明
肺水腫
電解質
0.1~5%未満
低カリウム血症
電解質
0.1%未満
低カルシウム血症
精神神経系
0.1~5%未満
振戦
精神神経系
0.1%未満
精神症状(譫妄状態、不安状態、記憶障害、失見当識)
その他
5%以上
動注部位の重苦しさ・痛み
その他
0.1~5%未満
全身倦怠感、胸部痛、頭痛、腰部痛、背部痛
その他
0.1%未満
動注時息苦しさ、上腹部圧痛、浮腫
その他の副作用の注意
注)皮膚の変化は腹壁等に至る血管への流入による障害としてあらわれる。またこれらの症状から、皮膚壊死、筋壊死に至ることがあるので、このような場合には適切な処置を行うこと。
妊婦、産婦、授乳婦等への投与
1.
妊婦等:
妊婦又は妊娠している可能性のある婦人には投与しないことが望ましい。[動物実験で胎児毒性が報告されている。]
2.
授乳婦:
授乳婦に投与する場合には授乳を中止させること。[動物実験で乳汁中移行が報告されている。]
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立されていない。(使用経験がない。)
適用上の注意
1.
調製時:
(1)
本剤の使用にあたっては、専用の懸濁用液を使用すること。
(2)
懸濁液の調製にあたっては、本剤に懸濁用液を無菌的に静かに加えた後、液を振り混ぜずにそのまま超音波を約3分間照射すること。
超音波処理後、液を手で振り混ぜ、液中に明らかな塊がないことを確認したうえで使用すること。
液中に塊が認められた場合には、超音波を更に30秒~1分間照射すること。
超音波照射装置は、周波数が25~50kHz、出力密度が0.2~0.5W/cm2の範囲のものを使用すること。
(3)
懸濁液は用時調製し、調製後は速やかに使用するか、又は冷蔵庫に遮光保存して2日以内に使用すること。
2.
使用時:
(1)
本剤は光により不活性化されるので、十分に注意して使用すること。
(2)
調製後の懸濁液は油性成分を含有しているため、ポリカーボネート製の三方活栓や延長チューブ等を使用した場合、そのコネクター部分に緩みやひび割れが発生し、血液及び薬液漏れ、空気混入等の可能性があるので注意すること。
その他の注意
1.
本剤に対する抗体が出現することがある
2.
In vitro及びin vivoいずれの試験においても遺伝子突然変異誘発性あるいは染色体異常誘発性が認められた。
薬物動態
1.
肝腫瘍内濃度
肝腫瘍患者(2症例)の肝動脈内にジノスタチン スチマラマーを懸濁した液4mg/4mLを投与したとき、肝腫瘍組織内に投与後15日及び26日でもジノスタチン スチマラマーが高濃度検出され、その濃度はそれぞれ229.8ng/g及び381.8ng/gであった1)。(「薬物動態の表」表1参照)
2.
血漿中濃度
肝腫瘍患者の肝動脈内にジノスタチン スチマラマーを懸濁した液4mg/4mLを投与したとき、ジノスタチン スチマラマーの血漿中濃度は投与後1時間で510.3ng/mLであり、その後経時的に低下し、消失半減期は6.1時間であった1)。(「薬物動態の表」表2参照)
薬物動態の表
表1
| |
投与後日数 |
肝組織内免疫反応性濃度(ng/g):腫瘍組織 |
肝組織内免疫反応性濃度(ng/g):腫瘍組織近傍正常肝 |
肝組織内免疫反応性濃度(ng/g):正常肝 |
| 症例1 |
15日 |
229.8(16.5) |
18.6(1.3) |
13.9(1.0) |
| 症例2 |
26日 |
381.8(55.3) |
19.8(2.9) |
6.9(1.0) |
( )内は正常肝内濃度に対する比
表2
| |
投与前 |
投与後:1h |
投与後:3h |
投与後:6h |
投与後:24h |
| ジノスタチン スチマラマー濃度(ng/mL) |
0 |
510.3 |
385.3 |
184.4 |
45.4 |
臨床成績
全国45施設において肝細胞癌患者を対象に行われた臨床試験(効果判定可能症例:167例)での有効例はCR1例、PR59例であり、PR以上の奏効率は35.9%(60/167)であった2)。
薬効薬理
1.
薬理作用
(1)
細胞増殖抑制作用 3)4)
ヒト肝癌培養細胞(SK-Hep1及びHuH2)、肝癌以外のヒト癌培養細胞(KB、MKN45、ST4、HeLa、ACHN、MCF7及びK562)及びマウス白血病細胞(L1210及びP388)に対して、濃度依存的な細胞増殖抑制作用を示した。
また、アドリアマイシン、5-フルオロウラシルあるいはビンクリスチン耐性のP388細胞に対しても濃度依存的な細胞増殖抑制作用を示した。
(2)
抗腫瘍作用 4)~6)
VX2細胞を肝臓に移植されたVX2肝癌ウサギにおいて、肝動脈内投与により用量依存的な抗腫瘍作用を示した。また、マウス乳癌MM46細胞あるいはマウス結腸癌colon26細胞を皮下に移植されたマウスにおいて、静脈内投与実験(本薬の水溶液を投与)により用量依存的な抗腫瘍作用を示した。
2.
作用機序7)
DNA鎖に対する直接切断作用によりDNA生合成を抑制し、細胞増殖抑制作用ならびに抗腫瘍作用を示す。
有効成分に関する理化学的知見
一般名
ジノスタチン スチマラマー(Zinostatin Stimalamer)
化学名
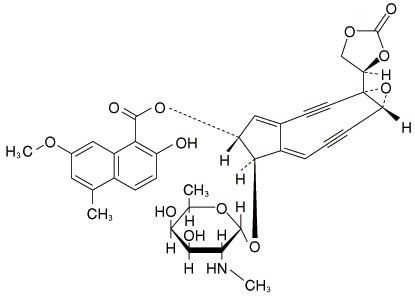
(4S,6R,11R,12R )-11-[α-D-2,6-Dideoxy-2-(methylamino)-galactopyranosyloxy]-4-[(4R )-2-oxo-1,3-dioxolan-4-yl]-5-oxatricyclo[8.3.0.04,6]trideca-1(13),9-diene-2,7-diyn-12-yl 2-hydroxy-7-methoxy-5-methylnaphthalene-1-carboxylate
構造式
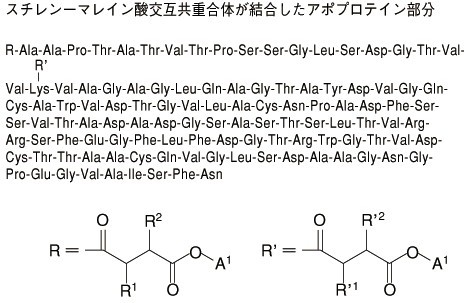
 ジノスタチン スチマラマーはクロモフォアとアポプロテイン(113個のアミノ酸よりなるポリペプチド)よりなるジノスタチン1分子に、部分ブチルエステル化したスチレン-マレイン酸交互共重合体2分子を結合させて得られる平均分子量約15,000の物質である。交互共重合体はアポプロテインのN末端のアラニンのα-アミノ基及び20位のリジンのε-アミノ基とアミド結合している。 ジノスタチン スチマラマーは微黄色の粉末である。水に溶けやすく、エタノール(95)又はジエチルエーテルにほとんど溶けない。
包装

肝動注用4mg:1バイアル
肝動注用6mg:1バイアル
主要文献及び文献請求先
主要文献
1)
峠 哲哉 他:癌と化学療法 18(10):1677,1991[SMNC-005]
2)
田口鐵男 他:癌と化学療法 18(10):1665,1991[NCS-00100]
3)
田中章平 他:癌と化学療法 21(2):219,1994[SMA-143]
4)
沼崎洋三 他:癌と化学療法 18(13):2289,1991[SMNC-004]
5)
木村正美 他:癌と化学療法 16(6):2183,1989[SMNC-010]
6)
織田 勉 他:癌と化学療法 18(14):2423,1991[SMNC-002]
7)
田中章平 他:癌と化学療法 18(13):2295,1991[SMNC-003]
文献請求先・製品情報お問い合わせ先
アステラス製薬株式会社 営業本部DIセンター
〒103-8411 東京都中央区日本橋本町2丁目3番11号
 0120-189-371
製造販売業者等の氏名又は名称及び住所
製造販売
アステラス製薬株式会社
東京都板橋区蓮根3丁目17番1号
|





 0120-189-371
0120-189-371