名
英文:Cefamezin α for Injection 0.5g / 1g /2g
头孢唑啉钠水合物注射剂 0.5克 / 1克 / 2克
日文:セファメジンα注射用 0.5g / 1g / 2g
中文:头孢唑啉钠水合物注射剂 0.5克 / 1克 / 2克 图片
有效成分
英文:Cefazolin Sodium Hydrate
日文:セファゾリンナトリウム水和物
中文:头孢唑啉钠
生产厂家
英文:astellas(安斯泰来)
日文:
中文:
医药品类别:
适合病症:广谱抗生素
批准上市时间:1999年
商品条码:
药品形状:冻干粉状
有效成分量:0.5克 / 1克 /2克 /瓶
最小包装单位容量:10瓶/盒
セファメジンα注射用0.25g/セファメジンα注射用0.5g/セファメジンα注射用1g/セファメジンα注射用2g
作成又は改訂年月
**2009年8月改訂(第10版、薬事法改正に伴う改訂)
*2006年6月改訂
日本標準商品分類番号
876132
日本標準商品分類番号等
再評価結果公表年月(最新)
2004年9月
薬効分類名
合成セファロスポリン製剤
承認等
販売名
セファメジンα注射用0.25g
販売名コード
YJ(医情研)コード
6132401D1045
承認・許可番号
承認番号
21800AMX10157
商標名
Cefamezin α 0.25g for Injection
薬価基準収載年月
*2006年6月
販売開始年月
1999年7月
貯法・使用期限等
貯法
室温保存
使用期限
ケース等に表示(製造後2年)
規制区分
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
セファメジンα注射用0.25gは1バイアル中に日局 セファゾリンナトリウム水和物0.25g(力価)を含有する。
性状
本剤は白色~微帯黄白色の結晶を充てんした製剤で、本剤をリドカイン注射液に溶解したときのpH及び浸透圧比は下記のとおりである。
容器
無色バイアル
含量/溶解液量
0.25g(力価)/2mL
溶解液
リドカイン注射液(0.5w/v%)
pH
5.0~6.3
浸透圧比(生理食塩液に対する比)
約1
販売名
セファメジンα注射用0.5g
販売名コード
YJ(医情研)コード
6132401D2084
承認・許可番号
承認番号
21800AMX10159
商標名
Cefamezin α 0.5g for Injection
薬価基準収載年月
*2006年6月
販売開始年月
1999年7月
貯法・使用期限等
貯法
室温保存
使用期限
ケース等に表示(製造後2年)
規制区分
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
セファメジンα注射用0.5gは1バイアル中に日局 セファゾリンナトリウム水和物0.5g(力価)を含有する。
性状
本剤は白色~微帯黄白色の結晶を充てんした製剤で、本剤をリドカイン注射液に溶解したときのpH及び浸透圧比は下記のとおりである。
容器
無色バイアル
含量/溶解液量
0.5g(力価)/2mL
溶解液
リドカイン注射液(0.5w/v%)
pH
5.0~6.3
浸透圧比(生理食塩液に対する比)
約2
販売名
セファメジンα注射用1g
販売名コード
YJ(医情研)コード
6132401D3145
承認・許可番号
承認番号
21800AMX10160
商標名
Cefamezin α 1g for Injection
薬価基準収載年月
*2006年6月
販売開始年月
1999年7月
貯法・使用期限等
貯法
室温保存
使用期限
ケース等に表示(製造後2年)
規制区分
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
セファメジンα注射用1gは1バイアル中に日局 セファゾリンナトリウム水和物1g(力価)を含有する。
性状
本剤は白色~微帯黄白色の結晶を充てんした製剤で、本剤を注射用水、生理食塩液、ブドウ糖注射液又はリドカイン注射液に溶解したときのpH及び浸透圧比は下記のとおりである。
容器
無色バイアル
含量/溶解液量
1g(力価)/10mL
溶解液
注射用水
pH
4.8~6.3
浸透圧比(生理食塩液に対する比)
約1
含量/溶解液量
1g(力価)/10mL
溶解液
生理食塩液
pH
4.8~6.3
浸透圧比(生理食塩液に対する比)
約2
含量/溶解液量
1g(力価)/100mL
溶解液
生理食塩液
pH
4.6~6.3
浸透圧比(生理食塩液に対する比)
約1
含量/溶解液量
1g(力価)/10mL
溶解液
ブドウ糖注射液(5w/v%)
pH
4.8~6.3
浸透圧比(生理食塩液に対する比)
約2
含量/溶解液量
1g(力価)/3mL
溶解液
リドカイン注射液(0.5w/v%)
pH
5.0~6.3
浸透圧比(生理食塩液に対する比)
約3
販売名
セファメジンα注射用2g
販売名コード
YJ(医情研)コード
6132401D4141
承認・許可番号
承認番号
21800AMX10158
商標名
Cefamezin α 2g for Injection
薬価基準収載年月
*2006年6月
販売開始年月
1999年7月
貯法・使用期限等
貯法
室温保存
使用期限
ケース等に表示(製造後2年)
規制区分
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
セファメジンα注射用2gは1バイアル中に日局 セファゾリンナトリウム水和物2g(力価)を含有する。
性状
本剤は白色~微帯黄白色の結晶を充てんした製剤で、本剤を生理食塩液又はブドウ糖注射液に溶解したときのpH及び浸透圧比は下記のとおりである。
含量/溶解液量
2g(力価)/100mL
溶解液
生理食塩液
pH
4.6~6.3
浸透圧比(生理食塩液に対する比)
約1
含量/溶解液量
2g(力価)/100mL
溶解液
ブドウ糖注射液(5w/v%)
pH
4.6~6.3
浸透圧比(生理食塩液に対する比)
約1
一般的名称
注射用セファゾリンナトリウム水和物
Cefazolin Sodium Hydrate
禁忌
(次の患者には投与しないこと)
本剤の成分によるショックの既往歴のある患者
|
原則禁忌
(次の患者には投与しないことを原則とするが、特に必要とする場合には慎重に投与すること)
本剤の成分又はセフェム系抗生物質に対し、過敏症の既往歴のある患者
|
効能又は効果
〈適応菌種〉
セファゾリンに感性のブドウ球菌属、レンサ球菌属、肺炎球菌、大腸菌、肺炎桿菌、プロテウス・ミラビリス、プロビデンシア属
〈適応症〉
敗血症、感染性心内膜炎、表在性皮膚感染症、深在性皮膚感染症、リンパ管・リンパ節炎、慢性膿皮症、外傷・熱傷及び手術創等の二次感染、びらん・潰瘍の二次感染、乳腺炎、骨髄炎、関節炎、咽頭・喉頭炎、扁桃炎、急性気管支炎、肺炎、肺膿瘍、膿胸、慢性呼吸器病変の二次感染、膀胱炎、腎盂腎炎、腹膜炎、胆嚢炎、胆管炎、バルトリン腺炎、子宮内感染、子宮付属器炎、子宮旁結合織炎、眼内炎(全眼球炎を含む)、中耳炎、副鼻腔炎、化膿性唾液腺炎
用法及び用量
セファゾリンとして、通常、1日量成人には1g(力価)、小児には体重kg当り20~40mg(力価)を2回に分けて緩徐に静脈内へ注射するが、筋肉内へ注射することもできる。
症状及び感染菌の感受性から効果不十分と判断される場合には、1日量成人1.5~3g(力価)を、小児には体重kg当り50mg(力価)を3回に分割投与する。
症状が特に重篤な場合には、1日量成人5g(力価)、小児には体重kg当り100mg(力価)までを分割投与することができる。
また、輸液に加え、静脈内に点滴注入することもできる。
<注射液の調製法>
(1)
静脈内注射
本品を注射用水、生理食塩液又はブドウ糖注射液に溶解する。
(2)
筋肉内注射
本品をリドカイン注射液(0.5w/v%)約2~3mLに溶解する。
用法及び用量に関する説明
静脈内注射
本品1g(力価)の溶解には3~3.5mL以上を使用する。
筋肉内注射
0.25g(力価)、0.5g(力価)の溶解には約2mLを使用し、1g(力価)の溶解には約3mLを使用する。
用法及び用量に関連する使用上の注意
1.
本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
2.
高度の腎障害のある患者では、血中濃度が持続するので、腎障害の程度に応じて投与量を減量し、投与の間隔をあけて使用すること。(「薬物動態」の項参照)
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
1.
ペニシリン系抗生物質に対し、過敏症の既往歴のある患者
2.
本人又は両親、兄弟に気管支喘息、発疹、蕁麻疹等のアレルギー症状を起こしやすい体質を有する患者
3.
高度の腎障害のある患者(〈用法・用量に関連する使用上の注意〉及び「薬物動態」の項参照)
4.
経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者[ビタミンK欠乏症状があらわれることがあるので、観察を十分に行うこと。]
5.
高齢者(「高齢者への投与」の項参照)
重要な基本的注意
本剤によるショック、アナフィラキシー様症状の発生を確実に予知できる方法がないので、次の措置をとること。
(1)
事前に既往歴等について十分な問診を行うこと。なお、抗生物質等によるアレルギー歴は必ず確認すること。
(2)
投与に際しては、必ずショック等に対する救急処置のとれる準備をしておくこと。
(3)
投与開始から投与終了後まで、患者を安静の状態に保たせ、十分な観察を行うこと。特に、投与開始直後は注意深く観察すること。
相互作用
併用注意
(併用に注意すること)
薬剤名等
ワルファリンカリウム
臨床症状・措置方法
ワルファリンカリウムの作用が増強されるおそれがある。ただし、本剤に関する症例報告はない。
機序・危険因子
腸内細菌によるビタミンKの産生を抑制することがある。
薬剤名等
利尿剤
フロセミド等
臨床症状・措置方法
腎障害が増強されるおそれがある。
機序・危険因子
機序は明らかではないが、ラット、ウサギにおいて、腎障害が増強されるとの報告がある。
副作用
副作用等発現状況の概要
本剤での臨床試験等は実施していないが、本剤を溶解したものはセファメジン注射用、筋注用と同一のものであるので、セファメジン注射用、筋注用での調査結果を以下に示す。
総症例84,799例(静注、点滴静注、筋注を含む)中、副作用(臨床検査値の変動を除く)は838例で発現頻度は0.99%であった。また、臨床検査値の変動のうち最も頻度が高かったのはAST(GOT)の上昇0.50%(222/44,143例)、次いでALT(GPT)の上昇0.49%(214/44,068例)であった。 (1971年8月~1982年4月までの集計)
重大な副作用
1.
ショック
ショック(0.1%未満)を起こすことがあるので、観察を十分に行い、不快感、口内異常感、喘鳴、眩暈、便意、耳鳴、発汗等があらわれた場合には投与を中止し、適切な処置を行うこと。
2.
アナフィラキシー様症状
アナフィラキシー様症状(呼吸困難、全身潮紅、血管浮腫、蕁麻疹等)(0.1%未満)があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
3.
血液障害
汎血球減少(0.1%未満)、無顆粒球症(0.1%未満、初期症状:発熱、咽頭痛、頭痛、倦怠感等)、溶血性貧血(0.1%未満、初期症状:発熱、ヘモグロビン尿、貧血症状等)、血小板減少(0.1%未満、初期症状:点状出血、紫斑等)があらわれることがあるので、定期的に検査を行うなど観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
4.
肝障害
黄疸(0.1%未満)、AST(GOT)、ALT(GPT)、Al-Pの上昇(各0.1~5%未満)等があらわれることがあるので、定期的に検査を行うなど観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
5.
腎障害
急性腎不全等の重篤な腎障害(0.1%未満)があらわれることがあるので、定期的に検査を行うなど観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
6.
大腸炎
偽膜性大腸炎等の血便を伴う重篤な大腸炎(0.1%未満)があらわれることがある。腹痛、頻回の下痢があらわれた場合には直ちに投与を中止し、適切な処置を行うこと。
7.
皮膚障害
皮膚粘膜眼症候群(Stevens-Johnson症候群、0.1%未満)、中毒性表皮壊死症(Lyell症候群、0.1%未満)があらわれることがあるので、観察を十分に行い、発熱、頭痛、関節痛、皮膚や粘膜の紅斑・水疱、皮膚の緊張感・灼熱感・疼痛等が認められた場合には投与を中止し、適切な処置を行うこと。
8.
間質性肺炎、PIE症候群
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎、PIE症候群(各0.1%未満)等があらわれることがあるので、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
9.
痙攣
腎不全の患者に大量投与すると、痙攣等の神経症状(頻度不明)を起こすことがある1)。
その他の副作用
過敏症注)
0.1~5%未満
発疹、蕁麻疹、紅斑
過敏症注)
0.1%未満
そう痒、発熱、浮腫
血液
0.1~5%未満
顆粒球減少、好酸球増多
腎臓
0.1~5%未満
BUN上昇
腎臓
0.1%未満
血清クレアチニン上昇
消化器
0.1~5%未満
悪心、嘔吐
消化器
0.1%未満
食欲不振、下痢
菌交代症
0.1%未満
口内炎、カンジダ症
ビタミン欠乏症
0.1%未満
ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等)
その他
0.1%未満
頭痛、めまい、全身倦怠感
その他の副作用の注意
注)発現した場合には、投与を中止し、適切な処置を行うこと。
高齢者への投与
高齢者には次の点に注意し、用量並びに投与間隔に留意するなど患者の状態を観察しながら、慎重に投与すること。
1.
高齢者では生理機能が低下していることが多く、副作用が発現しやすい。
2.
高齢者ではビタミンK欠乏による出血傾向があらわれることがある。
妊婦、産婦、授乳婦等への投与
1.
妊婦等:
妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[妊娠中の投与に関する安全性は確立していない。]
2.
授乳婦:
授乳中の婦人への投与は避けることが望ましいが、やむを得ず投与する場合は、授乳を避けさせること。[母乳中へ移行することが報告されている。(「薬物動態」の項参照)]
小児等への投与
低出生体重児、新生児に対する安全性は確立していない。(使用経験が少ない。)
なお、低出生体重児、新生児では乳児、幼児等に比べて血清中濃度半減期が延長するとの報告がある。(「薬物動態」の項参照)
臨床検査結果に及ぼす影響
1.
テステープ反応を除くベネディクト試薬、フェーリング試薬、クリニテストによる尿糖検査では偽陽性を呈することがあるので注意すること。
2.
直接クームス試験陽性を呈することがあるので注意すること。
適用上の注意
1.
静脈内投与時:
静脈内大量投与により、血管痛、血栓性静脈炎を起こすことがあるので、これを予防するために注射液の調製、注射部位、注射方法等について十分注意し、その注射速度はできるだけ遅くすること。
2.
筋肉内投与時(静脈内注射が困難な場合にのみ使用すること):
筋肉内注射にあたっては、下記の点に注意すること。
(1)
筋肉内投与はやむを得ない場合にのみ、必要最小限に行うこと。同一部位への反復注射は行わないこと。特に低出生体重児、新生児、乳児、小児には注意すること。
(2)
神経走行部位を避けること。
(3)
注射針を刺入したとき、激痛を訴えたり、血液の逆流をみた場合は直ちに針を抜き、部位をかえて注射すること。
(4)
筋注用に溶解した溶液は静脈内への注射は絶対に避けること。
(5)
注射部位に疼痛、硬結をみることがある。
3.
調製方法:
温度による溶解度の差(下表)により、澄明に溶解しない場合があるが、この場合は液量を増やすか温湯であたため澄明な溶液としてから使用すること。また、溶解後は室温又は冷蔵庫保存で48時間以内に使用すること。 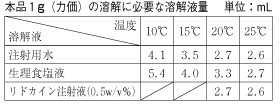 4.
調製時:
ガベキサートメシル酸塩、ナファモスタットメシル酸塩、シメチジン、ファモチジン、アミノ糖系抗生物質と混合すると混濁することがある。
薬物動態
本剤での臨床試験は実施していないが、本剤を溶解したものはセファメジン注射用、筋注用と同一のものであるので、セファメジン注射用、筋注用の成績を以下に示す。
1.
血中濃度
(1)
成人
健康成人に1gを30分で点滴静注すると、血漿中濃度は点滴終了直後にピーク値131μg/mLに達し、その半減期は2.46時間であった 2)。また、2gを30分及び1時間で点滴静注すると、血清中濃度は点滴終了直後にそれぞれピーク値228μg/mL、172μg/mLを示した 3)。1gを静注すると、血清中濃度は5分後に143.8μg/mL、6時間後に6.8μg/mLを示し、その半減期は1.67時間であった 4)。0.5gを筋注すると血清中濃度は1時間後にピーク値38.0μg/mLに達し、その半減期は2.3時間であった 5)。  (2)
腎機能障害のある患者では、腎障害の程度に応じて血清中濃度半減期が延長し、血清中濃度は持続した6)。(「薬物動態の表」表1参照)
(3)
低出生体重児、新生児及び小児 7)
低出生体重児、新生児及び小児に25mg/kg静注した際の血清中濃度半減期は、低出生体重児、新生児で2.3~5.1時間、乳児、幼児、学童では1.3~2.2時間であった。なお、低出生体重児、新生児、乳児、幼児、学童の血清中濃度の推移は次表のとおりである。(「薬物動態の表」表2、3、4参照)
2.
組織内移行
患者喀痰中8)、胸水中9)、胆汁中10)等への体液中移行、扁桃組織11)、胆嚢組織10)、子宮組織12)、骨組織13)等への組織内移行は良好である。
3.
乳汁中移行
授乳婦20例に2g静注したときの母乳中濃度は静注後2時間目1.3±0.9μg/mL、3時間目1.5±0.2μg/mL、4時間目1.2±1.0μg/mLであった14)。
4.
代謝
尿中には抗菌代謝物質は認められていない15)。
5.
排泄
主として腎臓より排泄され、健康成人に点滴静注、静注あるいは筋注したときの尿中排泄率はそれぞれ88.7%(1g30分点滴:投与後8時間まで)2)、88.2%(2g1時間点滴:投与後7時間まで)3)、91.3%(1g静注:投与後8時間まで)4)、88.9%(0.5g筋注:投与後6時間まで)5)と良好である。
薬物動態の表
表1 500mg静注時の血清中濃度半減期及び尿中回収量
| 腎機能 |
GFR(mL/min) |
例数 |
t1/2(h) |
尿中回収量(9h) |
| 正常 |
- |
3 |
1.6 |
420.8mg |
| 中等度障害 |
28~75 |
3 |
2.7 |
166.7mg |
| 高度障害 |
7.3~20 |
3 |
14.9 |
50.2mg |
表2 低出生体重児(≦2,500g)(μg/mL)
| 日齢 |
例数 |
30分 |
1時間 |
2時間 |
4時間 |
6時間 |
| ≦3日 |
5 |
97 |
89.2 |
78 |
58.7 |
44.7 |
| 4~7日 |
8 |
99.0 |
97.8 |
83 |
56.8 |
40.2 |
| ≧8日 |
7 |
100.5 |
91.4 |
67.9 |
47.5 |
31.8 |
表3 新生児(μg/mL)
| 日齢 |
例数 |
30分 |
1時間 |
2時間 |
4時間 |
6時間 |
| ≦3日 |
14 |
122.4 |
119 |
101.2 |
79.1 |
58 |
| 4~7日 |
2 |
93 |
85 |
70 |
34 |
20 |
| ≧8日 |
3 |
95.5 |
79.3 |
54.8 |
29.7 |
17.8 |
表4 乳児、幼児、学童(μg/mL)
| |
例数 |
15分 |
30分 |
1時間 |
2時間 |
4時間 |
6時間 |
| 乳児 |
5 |
- |
90.4 |
75.2 |
54.3 |
28.1 |
16.5 |
| 幼児 |
4 |
131 |
114 |
81.3 |
38.9 |
11.4 |
7.4 |
| 学童 |
4 |
160.8 |
120.5 |
79.1 |
51.8 |
18.8 |
9.5 |
臨床成績
本剤での臨床試験は実施していないが、本剤を溶解したものはセファメジン注射用、筋注用と同一のものであるので、セファメジン注射用、筋注用の成績を以下に示す。
比較試験(呼吸器感染症16)、尿路感染症17))及び一般臨床試験18)(静注、点滴静注、筋注を含む)における疾患別有効率は以下のとおりである。
臨床成績の表
適応疾患別臨床効果
| 疾患名 |
有効例/症例数 |
有効率(%) |
| 敗血症 |
6/9 |
66.7 |
| 感染性心内膜炎 |
3/5 |
60.0 |
| 皮膚感染症:表在性皮膚感染症(毛嚢炎) |
2/5 |
40.0 |
| 皮膚感染症:深在性皮膚感染症(ひょう疽、せつ、カルブンケル、丹毒、フレグモーネ等) |
64/78 |
82.1 |
| 皮膚感染症:リンパ管・リンパ節炎 |
15/22 |
68.2 |
| 皮膚感染症:慢性膿皮症(粉瘤、膿瘍) |
13/19 |
68.4 |
| 外科・整形外科領域感染症:外傷・熱傷及び手術創等の二次感染 |
26/33 |
78.8 |
| 外科・整形外科領域感染症:びらん・潰瘍の二次感染(潰瘍、褥瘡) |
2/3 |
- |
| 外科・整形外科領域感染症:乳腺炎 |
9/11 |
81.8 |
| 外科・整形外科領域感染症:骨髄炎 |
6/6 |
100 |
| 外科・整形外科領域感染症:関節炎 |
3/3 |
- |
| 呼吸器感染症:咽頭・喉頭炎 |
8/11 |
72.7 |
| 呼吸器感染症:扁桃炎 |
46/48 |
95.8 |
| 呼吸器感染症:急性気管支炎、慢性呼吸器病変の二次感染(慢性気管支炎、気管支拡張症、慢性呼吸器疾患の二次感染) |
73/89 |
82.0 |
| 呼吸器感染症:肺炎 |
163/194 |
84.0 |
| 呼吸器感染症:肺膿瘍 |
14/22 |
63.6 |
| 呼吸器感染症:膿胸 |
9/13 |
69.2 |
| 腎盂腎炎 |
105/149 |
70.5 |
| 腹膜炎(腹膜炎、骨盤腹膜炎) |
35/43 |
81.4 |
| 胆嚢炎、胆管炎 |
48/55 |
87.3 |
| 婦人科感染症:バルトリン腺炎 |
2/2 |
- |
| 婦人科感染症:子宮内感染(子宮内感染、子宮頸管炎、子宮内膜炎) |
29/39 |
74.4 |
| 婦人科感染症:子宮旁結合織炎 |
6/13 |
46.2 |
| 全眼球炎 |
1/3 |
- |
| 耳鼻科感染症:中耳炎 |
51/63 |
81.0 |
| 耳鼻科感染症:副鼻腔炎 |
1/3 |
- |
| 耳鼻科感染症:化膿性唾液腺炎(顎下腺炎、化膿性耳下腺炎) |
3/3 |
- |
薬効薬理
本剤での薬理試験等は実施していないが、本剤を溶解したものはセファメジン注射用、筋注用と同一のものであるので、セファメジン注射用、筋注用の成績を以下に示す。
1.
抗菌作用
抗菌スペクトルはグラム陽性菌、グラム陰性菌の広範囲にわたっており、特にグラム陽性球菌ではブドウ球菌属、レンサ球菌属、肺炎球菌、グラム陰性桿菌では、大腸菌、肺炎桿菌、プロテウス・ミラビリス、プロビデンシア属に優れた抗菌力を示す。作用形式は殺菌的である5)15)19)20)。
2.
作用機序
作用機序は細菌細胞壁の合成阻害であり、ペニシリン結合蛋白(PBP)に強い結合親和性を有する。
有効成分に関する理化学的知見
一般名
セファゾリンナトリウム水和物(Cefazolin Sodium Hydrate)
略号
CEZ
化学名
Monosodium (6R,7R )-3-(5-methyl-1,3,4-thiadiazol-2-ylsulfanylmethyl)-8-oxo-7-[2-(1H -tetrazol-1-yl) acetylamino]-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate pentahydrate
構造式
分子式
C14H13N8NaO4S3・5H2O
分子量
566.57
融点
明確な融点を示さない。
分配係数
(1-オクタノール/水系)
pH1 3.30×10 -1
pH3 4.38×10 -2
pH5 3.96×10 -3
pH7 3.45×10 -4
pH9 2.90×10 -4
性状
セファゾリンナトリウム水和物は白色~微帯黄白色の結晶である。水に溶けやすく、メタノールにやや溶けにくく、エタノール(95)に溶けにくく、ジエチルエーテルにほとんど溶けない。
包装

0.25g(力価):10バイアル
0.5g(力価):10バイアル
1g(力価):10バイアル
2g(力価):10バイアル
主要文献及び文献請求先
主要文献
1)
Bechtel,T. P. et al.:Am. J. Hosp. Pharm. 37(2):271, 1980 [CEZ-01979]
2)
入江 伸 他:化学療法の領域 15(5):766, 1999 [CEZ-04121]
3)
石川羊男 他:診療と新薬 15(4):919, 1978 [CEZ-01166]
4)
嶋津良一 他:日本化学療法学会雑誌 28(S-5):696, 1980 [CEZ-04657]
5)
上田 泰 他:日本化学療法学会雑誌 18(5):564, 1970 [CEZ-00248]
6)
木下康民 他:日本化学療法学会雑誌 18(5):604, 1970 [CEZ-00254]
7)
堀 誠 他:母子化学療法研究の歩み p.64, 1979 [CEZ-01753]
8)
松本慶蔵 他:日本化学療法学会雑誌 18(5):552, 1970 [CEZ-00246]
9)
清水辰典:Jpn. J. Antibiot. 31(2):108, 1978 [CEZ-01191]
10)
田村 隆 他:日本臨床外科医学会雑誌 43(12):1325, 1982 [CEZ-02781]
11)
三好豊二 他:耳鼻咽喉科臨床 73(11):1719, 1980 [CEZ-02259]
12)
山田順常 他:産婦人科の世界 29(5):601, 1977 [CEZ-00876]
13)
藤巻有久 他:新薬と臨床 28(12):2091, 1979 [CEZ-01944]
14)
長 和彦 他:日本新生児学会雑誌 15(1):231, 1979 [CEZ-01756]
15)
西田 実 他:日本化学療法学会雑誌 18(5):481, 1970 [CEZ-00237]
16)
中川圭一 他:感染症学雑誌 46(6):210, 1972 [CEZ-00112]
17)
青河寛次 他:Jpn. J. Antibiot. 25(2):72, 1972 [CEZ-00097]
18)
日本化学療法学会雑誌 18(5), 1970 Cefazolin論文特集号を中心に集計
19)
Sabath,L. D. et al.:J. Infect. Dis. 128(Suppl.) S320, 1973 [CEZ-00031]
20)
松本佳巳 他:Pharma Med. 20(5):168, 2002 [CEZ-04348]
文献請求先・製品情報お問い合わせ先
アステラス製薬株式会社 営業本部DIセンター
〒103-8411 東京都中央区日本橋本町2丁目3番11号
 0120-189-371
製造販売業者等の氏名又は名称及び住所
製造販売
アステラス製薬株式会社
東京都板橋区蓮根3丁目17番1号
|








 0120-189-371
0120-189-371