作成又は改訂年月
2011年9月作成(第1版)
日本標準商品分類番号
87119
薬効分類名
アルツハイマー型認知症治療剤
承認等
販売名
ドネペジル塩酸塩OD錠3mg「TCK」
販売名コード
1190012F3088
承認・許可番号
承認番号
22300AMX00983000
商標名
DONEPEZIL HYDROCHLORIDE OD Tablets 3mg 「TCK」
薬価基準収載年月
2011年11月
販売開始年月
2011年11月
貯法・使用期限等
貯法
気密容器、室温保存(アルミ袋開封後は、湿気を避けて保存すること)
使用期限
外装に表示
規制区分
劇薬
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
有効成分の名称
ドネペジル塩酸塩
含量
1錠中ドネペジル塩酸塩3mg
添加物
乳糖水和物、セルロース、トウモロコシデンプン、デンプングリコール酸Na、メタクリル酸コポリマーL、ポリリン酸Na、スクラロース、無水ケイ酸、ステアリン酸Mg、黄色三二酸化鉄
性状
色・剤形
黄色・口腔内崩壊錠
外形
直径(mm)
6.5
厚さ(mm)
2.4
重量(mg)
101
識別コード
TU 124
販売名
ドネペジル塩酸塩OD錠5mg「TCK」
販売名コード
1190012F4084
承認・許可番号
承認番号
22300AMX00984000
商標名
DONEPEZIL HYDROCHLORIDE OD Tablets 5mg 「TCK」
薬価基準収載年月
2011年11月
販売開始年月
2011年11月
貯法・使用期限等
貯法
気密容器、室温保存(アルミ袋開封後は、湿気を避けて保存すること)
使用期限
外装に表示
規制区分
劇薬
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
有効成分の名称
ドネペジル塩酸塩
含量
1錠中ドネペジル塩酸塩5mg
添加物
乳糖水和物、セルロース、トウモロコシデンプン、デンプングリコール酸Na、メタクリル酸コポリマーL、ポリリン酸Na、スクラロース、無水ケイ酸、ステアリン酸Mg
性状
色・剤形
白色・口腔内崩壊錠
外形
直径(mm)
8.0
厚さ(mm)
2.7
重量(mg)
168
識別コード
TU 125
一般的名称
ドネペジル塩酸塩口腔内崩壊錠
禁忌
(次の患者には投与しないこと)
本剤の成分又はピペリジン誘導体に対し過敏症の既往歴のある患者
|
効能又は効果
効能又は効果/用法及び用量
軽度及び中等度のアルツハイマー型認知症における認知症症状の進行抑制
効能又は効果に関連する使用上の注意
1.
アルツハイマー型認知症と診断された患者にのみ使用すること。
2.
本剤がアルツハイマー型認知症の病態そのものの進行を抑制するという成績は得られていない。
3.
アルツハイマー型認知症以外の認知症性疾患において本剤の有効性は確認されていない。
用法及び用量
通常、成人にはドネペジル塩酸塩として1日1回3mgから開始し、1~2週間後に5mgに増量し、経口投与する。
用法及び用量に関連する使用上の注意
1.
3mg/日投与は有効用量ではなく、消化器系副作用の発現を抑える目的なので、原則として1~2週間を超えて使用しないこと。
2.
医療従事者、家族などの管理のもとで投与すること。
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
本剤はアセチルコリンエステラーゼ阻害剤であり、コリン作動性作用により以下に示す患者に対しては症状を誘発又は増悪する可能性があるため慎重に投与すること。
(1)
洞不全症候群、心房内及び房室接合部伝導障害等の心疾患のある患者
[迷走神経刺激作用により徐脈あるいは不整脈を起こす可能性がある。]
(2)
消化性潰瘍の既往歴のある患者、非ステロイド性消炎鎮痛剤投与中の患者
[胃酸分泌の促進及び消化管運動の促進により消化性潰瘍を悪化させる可能性がある。]
(3)
気管支喘息又は閉塞性肺疾患の既往歴のある患者
[気管支平滑筋の収縮及び気管支粘液分泌の亢進により症状が悪化する可能性がある。]
(4)
錐体外路障害(パーキンソン病、パーキンソン症候群等)のある患者
[線条体のコリン系神経を亢進することにより、症状を誘発又は増悪する可能性がある。]
重要な基本的注意
1.
本剤の投与により、徐脈、心ブロック(洞房ブロック、房室ブロック)、QT延長等があらわれることがあるので、特に心疾患(心筋梗塞、弁膜症、心筋症等)を有する患者や電解質異常(低カリウム血症等)のある患者等では、重篤な不整脈に移行しないよう観察を十分に行うこと。
2.
他の認知症性疾患との鑑別診断に留意すること。
3.
他のアセチルコリンエステラーゼ阻害作用を有する同効薬(ガランタミン等)と併用しないこと。
4.
本剤は口腔内で崩壊するが、口腔の粘膜から吸収されることはないため、唾液又は水で飲み込むこと。(「適用上の注意」の項参照)
相互作用
相互作用の概略
本剤は、主として薬物代謝酵素CYP3A4及び一部CYP2D6で代謝される。
併用注意
(併用に注意すること)
1.
薬剤名等
スキサメトニウム塩化物水和物
臨床症状・措置方法
筋弛緩作用を増強する可能性がある。
機序・危険因子
併用薬剤の脱分極性筋弛緩作用を増強する可能性がある。
2.
薬剤名等
コリン賦活剤(アセチルコリン塩化物、カルプロニウム塩化物、ベタネコール塩化物、アクラトニウムナパジシル酸塩)、コリンエステラーゼ阻害剤(アンベノニウム塩化物、ジスチグミン臭化物、ピリドスチグミン臭化物、ネオスチグミン等)
臨床症状・措置方法
迷走神経刺激作用などコリン刺激作用が増強される可能性がある。
機序・危険因子
本剤とともにコリン作動性の作用メカニズムを有している。
3.
薬剤名等
イトラコナゾール、エリスロマイシン等
臨床症状・措置方法
本剤の代謝を阻害し、作用を増強させる可能性がある。
機序・危険因子
併用薬剤のチトクロームP450(CYP3A4)阻害作用による。
4.
薬剤名等
キニジン硫酸塩水和物等
臨床症状・措置方法
本剤の代謝を阻害し、作用を増強させる可能性がある。
機序・危険因子
併用薬剤のチトクロームP450(CYP2D6)阻害作用による。
5.
薬剤名等
カルバマゼピン、デキサメタゾン、フェニトイン、フェノバルビタール、リファンピシン等
臨床症状・措置方法
本剤の代謝を促進し、作用を減弱させる可能性がある。
機序・危険因子
併用薬剤のチトクロームP450(CYP3A4)の誘導による。
6.
薬剤名等
中枢性抗コリン剤(トリヘキシフェニジル塩酸塩、ピロヘプチン塩酸塩、マザチコール塩酸塩水和物、メチキセン塩酸塩、ビペリデン塩酸塩等)、アトロピン系抗コリン剤(ブチルスコポラミン臭化物、アトロピン硫酸塩水和物等)
臨床症状・措置方法
本剤と抗コリン剤は互いに干渉し、それぞれの効果を減弱させる可能性がある。
機序・危険因子
本剤と抗コリン剤の作用が、相互に拮抗する。
7.
薬剤名等
非ステロイド性消炎鎮痛剤
臨床症状・措置方法
消化性潰瘍を起こす可能性がある。
機序・危険因子
コリン系の賦活により胃酸分泌が促進される。
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
1.
失神、徐脈、心ブロック、QT延長、心筋梗塞、心不全(いずれも頻度不明)
失神、徐脈、心ブロック(洞房ブロック、房室ブロック)、QT延長、心筋梗塞、心不全があらわれることがあるので、このような症状があらわれた場合には、投与を中止するなど適切な処置を行うこと。
2.
消化性潰瘍、十二指腸潰瘍穿孔、消化管出血(いずれも頻度不明)
本剤のコリン賦活作用による胃酸分泌及び消化管運動の促進によって消化性潰瘍(胃・十二指腸潰瘍)、十二指腸潰瘍穿孔、消化管出血があらわれることがあるので、このような症状があらわれた場合には、投与を中止するなど適切な処置を行うこと。
3.
肝炎、肝機能障害、黄疸(いずれも頻度不明)
肝炎、肝機能障害、黄疸があらわれることがあるので、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
4.
脳性発作、脳出血、脳血管障害(いずれも頻度不明)
脳性発作(てんかん、痙攣等)、脳出血、脳血管障害があらわれることがあるので、このような症状があらわれた場合には、投与を中止するなど適切な処置を行うこと。
5.
錐体外路障害(頻度不明)
寡動、運動失調、ジスキネジア、ジストニア、振戦、不随意運動、歩行異常、姿勢異常、言語障害等の錐体外路障害があらわれることがあるので、このような症状があらわれた場合には、投与を中止するなど適切な処置を行うこと。
6.
悪性症候群(Syndrome malin)(頻度不明)
無動緘黙、強度の筋強剛、嚥下困難、頻脈、血圧の変動、発汗等が発現し、それに引き続き発熱がみられる場合は、投与を中止し、体冷却、水・電解質管理等の全身管理とともに適切な処置を行うこと。本症発症時には、白血球の増加や血清CK(CPK)の上昇がみられることが多く、また、ミオグロビン尿を伴う腎機能の低下がみられることがある。
7.
横紋筋融解症(頻度不明)
横紋筋融解症があらわれることがあるので、観察を十分に行い、筋肉痛、脱力感、CK(CPK)上昇、血中及び尿中ミオグロビン上昇等があらわれた場合には、投与を中止し、適切な処置を行うこと。また、横紋筋融解症による急性腎不全の発症に注意すること。
8.
呼吸困難(頻度不明)
呼吸困難があらわれることがあるので、このような症状があらわれた場合には、投与を中止し、適切な処置を行うこと。
9.
急性膵炎(頻度不明)
急性膵炎があらわれることがあるので、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
10.
急性腎不全(頻度不明)
急性腎不全があらわれることがあるので、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
11.
原因不明の突然死(頻度不明)
その他の副作用
1. 過敏症注)
(頻度不明)
発疹、そう痒感
2. 消化器
(頻度不明)
食欲不振、嘔気、嘔吐、下痢、腹痛、便秘、流涎、嚥下障害、便失禁
3. 精神神経系
(頻度不明)
興奮、不穏、不眠、眠気、易怒性、幻覚、攻撃性、せん妄、妄想、多動、リビドー亢進、多弁、躁状態、抑うつ、錯乱、無感情、悪夢
4. 中枢・末梢神経系
(頻度不明)
徘徊、振戦、頭痛、めまい、昏迷
5. 肝臓
(頻度不明)
LDH、AST(GOT)、ALT(GPT)、γ-GTP、Al-Pの上昇
6. 循環器
(頻度不明)
動悸、血圧上昇、血圧低下、心房細動
7. 泌尿器
(頻度不明)
BUNの上昇、尿失禁、頻尿、尿閉
8. 血液
(頻度不明)
白血球減少、ヘマトクリット値減少、貧血、血小板減少
9. その他
(頻度不明)
CK(CPK)、総コレステロール、トリグリセライド、アミラーゼ、尿アミラーゼの上昇、けん怠感、むくみ、転倒、顔面紅潮、脱力感、胸痛、筋痛、発汗、顔面浮腫、発熱
その他の副作用の注意
注)このような症状があらわれた場合には、投与を中止すること。
妊婦、産婦、授乳婦等への投与
1.
妊婦又は妊娠している可能性のある婦人には、治療での有益性が危険性を上回ると判断される場合にのみ投与すること。
[動物実験(ラット経口10mg/kg)で出生率の減少、死産児頻度の増加及び生後体重の増加抑制が報告されている。]
2.
授乳中の婦人への投与は避けることが望ましいが、やむを得ず投与する場合は、授乳を避けさせること。
[ラットに14C-ドネペジル塩酸塩を経口投与したとき、乳汁中へ移行することが認められている。]
小児等への投与
小児に対する安全性は確立していない。(使用経験がない)
過量投与
徴候・症状
コリンエステラーゼ阻害剤の過量投与は高度な嘔気、嘔吐、流涎、発汗、徐脈、低血圧、呼吸抑制、虚脱及び痙攣等のコリン系副作用を引き起こす可能性がある。筋脱力の可能性もあり、呼吸筋の弛緩により死亡に至ることもあり得る。
処置
アトロピン硫酸塩水和物のような3級アミン系抗コリン剤が本剤の過量投与の解毒剤として使用できる。アトロピン硫酸塩水和物の1.0~2.0mgを初期投与量として静注し、臨床反応に基づいてその後の用量を決める。他のコリン作動薬では4級アンモニウム系抗コリン剤と併用した場合、血圧及び心拍数が不安定になることが報告されている。本剤あるいはその代謝物が透析(血液透析、腹膜透析又は血液濾過)により除去できるかどうかは不明である。
適用上の注意
1.
薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
2.
服用時
(1)
本剤は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
(2)
本剤は寝たままの状態では、水なしで服用させないこと。
その他の注意
1.
外国において、NINDS-AIREN診断基準に合致した脳血管性認知症(本適応は国内未承認)と診断された患者を対象(アルツハイマー型認知症と診断された患者は除外)に6ヵ月間のプラセボ対照無作為二重盲検試験3試験が実施された。最初の試験の死亡率はドネペジル塩酸塩5mg群1.0%(2/198例)、ドネペジル塩酸塩10mg群2.4%(5/206例)及びプラセボ群3.5%(7/199例)であった。2番目の試験の死亡率はドネペジル塩酸塩5mg群1.9%(4/208例)、ドネペジル塩酸塩10mg群1.4%(3/215例)及びプラセボ群0.5%(1/193例)であった。3番目の試験の死亡率はドネペジル塩酸塩5mg群1.7%(11/648例)及びプラセボ群0%(0/326例)であり両群間に統計学的な有意差がみられた。なお、3試験を合わせた死亡率はドネペジル塩酸塩(5mg及び10mg)群1.7%、プラセボ群1.1%であったが、統計学的な有意差はなかった。
2.
動物実験(イヌ)で、ケタミン・ペントバルビタール麻酔又はペントバルビタール麻酔下にドネペジル塩酸塩を投与した場合、呼吸抑制があらわれ死亡に至ったとの報告がある。
薬物動態
生物学的同等性試験
ドネペジル塩酸塩OD錠5mg「TCK」と標準製剤を、クロスオーバー法によりそれぞれ1錠(ドネペジル塩酸塩5mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.8)~log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。
また、ドネペジル塩酸塩OD錠3mg「TCK」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成18年11月24日薬食審査発第1124004号)」に基づき、ドネペジル塩酸塩OD錠5mg「TCK」を標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた。1)
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
薬物動態の表
薬物動態パラメータ
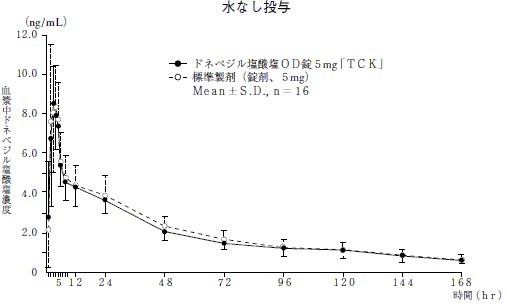
<水なし投与>
| |
判定パラメータ |
判定パラメータ |
参考パラメータ |
参考パラメータ |
| |
AUC0→168hr(ng・hr/mL) |
Cmax(ng/mL) |
Tmax(hr) |
T1/2(hr) |
| ドネペジル塩酸塩OD錠5mg「TCK」 |
327.75±71.07 |
9.12±1.87 |
3.1±1.0 |
57.22±21.80 |
| 標準製剤(錠剤、5mg) |
342.79±82.89 |
9.57±1.90 |
2.9±1.1 |
61.99±21.46 |
(Mean±S.D.,n=16)
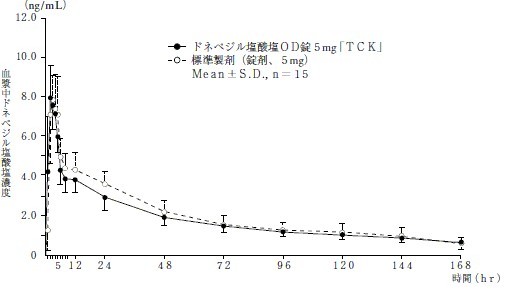
<水あり投与>
| |
判定パラメータ |
判定パラメータ |
参考パラメータ |
参考パラメータ |
| |
AUC0→168hr(ng・hr/mL) |
Cmax(ng/mL) |
Tmax(hr) |
T1/2(hr) |
| ドネペジル塩酸塩OD錠5mg「TCK」 |
297.48±50.20 |
8.87±1.14 |
2.3±0.9 |
74.58±24.30 |
| 標準製剤(錠剤、5mg) |
327.53±75.68 |
8.76±1.96 |
2.9±1.0 |
57.00±21.81 |
(Mean±S.D.,n=15)
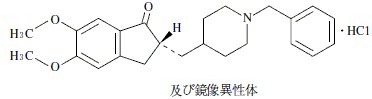
有効成分に関する理化学的知見
一般名
ドネペジル塩酸塩(Donepezil Hydrochloride)
化学名
(2RS )-2-[(1-Benzylpiperidin-4-yl)methyl]-5,6-dimethoxy-2,3-dihydro-1H -inden-1-one monohydrochloride
分子式
C24H29NO3・HCl
分子量
415.95
構造式
性状
白色の結晶性の粉末である。
水にやや溶けやすく、エタノール(99.5)に溶けにくい。
水溶液(1→100)は旋光性を示さない。
取扱い上の注意
安定性試験
加速試験(40℃、相対湿度75%、6ヵ月)の結果、ドネペジル塩酸塩OD錠3mg「TCK」及びドネペジル塩酸塩OD錠5mg「TCK」は通常の市場流通下において3年間安定であることが推測された。2)
包装

ドネペジル塩酸塩OD錠3mg「TCK」:28錠(PTP)
ドネペジル塩酸塩OD錠3mg「TCK」:140錠(PTP)
ドネペジル塩酸塩OD錠5mg「TCK」:56錠(PTP)
ドネペジル塩酸塩OD錠5mg「TCK」:140錠(PTP)
主要文献及び文献請求先
主要文献
1)
辰巳化学株式会社:生物学的同等性試験
2)
辰巳化学株式会社:安定性試験
文献請求先
主要文献に記載の社内資料につきましては下記にご請求下さい。
辰巳化学株式会社 薬事・学術課
〒921-8164 金沢市久安3丁目406番地
TEL 076-247-2132
FAX 076-247-5740
製造販売業者等の氏名又は名称及び住所
製造販売元
辰巳化学株式会社
金沢市久安3丁目406番地
|