アルツハイマー型認知症治療剤
承認等
販売名
アリセプト内服ゼリー3mg

販売名コード
1190012Q1027
承認・許可番号
承認番号
22100AMX02091000
商標名
Aricept

薬価基準収載年月
2009年11月
販売開始年月
2009年12月
貯法・使用期限等
貯 法
室温保存
使用期限
外箱又はラベルに表示の使用期限内に使用すること。
注 意
「取扱い上の注意」の項参照
規制区分
劇薬
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
販売名
アリセプト内服ゼリー3mg
成分・含量 1個(10g中)
ドネペジル塩酸塩3mg
添加物
アセスルファムカリウム、安息香酸ナトリウム、エデト酸カルシウム二ナトリウム水和物、カラギーナン、クエン酸水和物、クエン酸ナトリウム水和物、乳酸カルシウム水和物、パラオキシ安息香酸エチル、プロピレングリコール、粉末還元麦芽糖水アメ、ペクチン、香料、安息香酸ベンジル、エタノール、バニリン
性状
剤形
内服ゼリー剤
pH
3.2~4.0
外形(容器の形状)
性状
白色~微黄色のゼリー剤でにおいはないか又はわずかに特有なにおいがある。
販売名
アリセプト内服ゼリー5mg

販売名コード
1190012Q2023
承認・許可番号
承認番号
22100AMX02095000
商標名
Aricept

薬価基準収載年月
2009年11月
販売開始年月
2009年12月
貯法・使用期限等
貯 法
室温保存
使用期限
外箱又はラベルに表示の使用期限内に使用すること。
注 意
「取扱い上の注意」の項参照
規制区分
劇薬
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
販売名
アリセプト内服ゼリー5mg
成分・含量 1個(10g中)
ドネペジル塩酸塩5mg
添加物
アセスルファムカリウム、安息香酸ナトリウム、エデト酸カルシウム二ナトリウム水和物、カラギーナン、クエン酸水和物、クエン酸ナトリウム水和物、乳酸カルシウム水和物、パラオキシ安息香酸エチル、プロピレングリコール、粉末還元麦芽糖水アメ、ペクチン、香料、安息香酸ベンジル、エタノール、バニリン
性状
剤形
内服ゼリー剤
pH
3.2~4.0
外形(容器の形状)
性状
白色~微黄色のゼリー剤でにおいはないか又はわずかに特有なにおいがある。
販売名
アリセプト内服ゼリー10mg

販売名コード
1190012Q3020
承認・許可番号
承認番号
22100AMX02096000
商標名
Aricept

薬価基準収載年月
2009年11月
販売開始年月
2009年12月
貯法・使用期限等
貯 法
室温保存
使用期限
外箱又はラベルに表示の使用期限内に使用すること。
注 意
「取扱い上の注意」の項参照
規制区分
劇薬
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
販売名
アリセプト内服ゼリー10mg
成分・含量 1個(10g中)
ドネペジル塩酸塩10mg
添加物
アセスルファムカリウム、安息香酸ナトリウム、エデト酸カルシウム二ナトリウム水和物、カラギーナン、クエン酸水和物、クエン酸ナトリウム水和物、乳酸カルシウム水和物、パラオキシ安息香酸エチル、プロピレングリコール、粉末還元麦芽糖水アメ、ペクチン、香料、安息香酸ベンジル、エタノール、バニリン
性状
剤形
内服ゼリー剤
pH
3.2~4.0
外形(容器の形状)
性状
白色~微黄色のゼリー剤でにおいはないか又はわずかに特有なにおいがある。
一般的名称
ドネペジル塩酸塩製剤
禁忌
(次の患者には投与しないこと)
本剤の成分又はピペリジン誘導体に対し過敏症の既往歴のある患者
|
効能又は効果
効能又は効果/用法及び用量
アルツハイマー型認知症における認知症症状の進行抑制
効能又は効果に関連する使用上の注意
1.
アルツハイマー型認知症と診断された患者にのみ使用すること。
2.
本剤がアルツハイマー型認知症の病態そのものの進行を抑制するという成績は得られていない。
3.
アルツハイマー型認知症以外の認知症性疾患において本剤の有効性は確認されていない。
用法及び用量
通常、成人にはドネペジル塩酸塩として1日1回3mgから開始し、1~2週間後に5mgに増量し、経口投与する。高度のアルツハイマー型認知症患者には、5mgで4週間以上経過後、10mgに増量する。なお、症状により適宜減量する。
用法及び用量に関連する使用上の注意
1.
3mg/日投与は有効用量ではなく、消化器系副作用の発現を抑える目的なので、原則として1~2週間を超えて使用しないこと。
2.
10mg/日に増量する場合は、消化器系副作用に注意しながら投与すること。
3.
医療従事者、家族などの管理のもとで投与すること。
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
本剤はアセチルコリンエステラーゼ阻害剤であり、コリン作動性作用により以下に示す患者に対しては症状を誘発又は増悪する可能性があるため慎重に投与すること。
(1)
洞不全症候群、心房内及び房室接合部伝導障害等の心疾患のある患者
〔迷走神経刺激作用により徐脈あるいは不整脈を起こす可能性がある。〕
(2)
消化性潰瘍の既往歴のある患者、非ステロイド性消炎鎮痛剤投与中の患者
〔胃酸分泌の促進及び消化管運動の促進により消化性潰瘍を悪化させる可能性がある。〕
(3)
気管支喘息又は閉塞性肺疾患の既往歴のある患者
〔気管支平滑筋の収縮及び気管支粘液分泌の亢進により症状が悪化する可能性がある。〕
(4)
錐体外路障害(パーキンソン病、パーキンソン症候群等)のある患者
〔線条体のコリン系神経を亢進することにより、症状を誘発又は増悪する可能性がある。〕
重要な基本的注意
1.
本剤の投与により、徐脈、心ブロック(洞房ブロック、房室ブロック)、QT延長等があらわれることがあるので、特に心疾患(心筋梗塞、弁膜症、心筋症等)を有する患者や電解質異常(低カリウム血症等)のある患者等では、重篤な不整脈に移行しないよう観察を十分に行うこと。
2.
他の認知症性疾患との鑑別診断に留意すること。
3.
本剤投与で効果が認められない場合、漫然と投与しないこと。
4.
**他のアセチルコリンエステラーゼ阻害作用を有する同効薬(ガランタミン等)と併用しないこと。
相互作用
相互作用の概略
本剤は、主として薬物代謝酵素CYP3A4及び一部CYP2D6で代謝される。〔「薬物動態」の項参照〕
併用注意
(併用に注意すること)
1.
薬剤名等
スキサメトニウム塩化物水和物
臨床症状・措置方法
筋弛緩作用を増強する可能性がある。
機序・危険因子
併用薬剤の脱分極性筋弛緩作用を増強する可能性がある。
2.
薬剤名等
コリン賦活剤
アセチルコリン塩化物
カルプロニウム塩化物
ベタネコール塩化物
アクラトニウムナパジシル酸塩
コリンエステラーゼ阻害剤
アンベノニウム塩化物
ジスチグミン臭化物
ピリドスチグミン臭化物
ネオスチグミン等
臨床症状・措置方法
迷走神経刺激作用などコリン刺激作用が増強される可能性がある。
機序・危険因子
本剤とともにコリン作動性の作用メカニズムを有している。
3.
薬剤名等
イトラコナゾール
エリスロマイシン等
臨床症状・措置方法
本剤の代謝を阻害し、作用を増強させる可能性がある。
機序・危険因子
併用薬剤のチトクロームP450(CYP3A4)阻害作用による。
4.
薬剤名等
キニジン硫酸塩水和物等
臨床症状・措置方法
本剤の代謝を阻害し、作用を増強させる可能性がある。
機序・危険因子
併用薬剤のチトクロームP450(CYP2D6)阻害作用による。
5.
薬剤名等
カルバマゼピン
デキサメタゾン
フェニトイン
フェノバルビタール
リファンピシン等
臨床症状・措置方法
本剤の代謝を促進し、作用を減弱させる可能性がある。
機序・危険因子
併用薬剤のチトクロームP450(CYP3A4)の誘導による。
6.
薬剤名等
中枢性抗コリン剤
トリヘキシフェニジル塩酸塩
ピロヘプチン塩酸塩
マザチコール塩酸塩水和物
メチキセン塩酸塩
ビペリデン塩酸塩等
アトロピン系抗コリン剤
ブチルスコポラミン臭化物
アトロピン硫酸塩水和物等
臨床症状・措置方法
本剤と抗コリン剤は互いに干渉し、それぞれの効果を減弱させる可能性がある。
機序・危険因子
本剤と抗コリン剤の作用が、相互に拮抗する。
7.
薬剤名等
非ステロイド性消炎鎮痛剤
臨床症状・措置方法
消化性潰瘍を起こす可能性がある。
機序・危険因子
コリン系の賦活により胃酸分泌が促進される。
副作用
副作用等発現状況の概要
軽度及び中等度のアルツハイマー型認知症
承認時までの臨床試験において、総症例457例中、48例(10.5%)の副作用が報告されている。また、98例(21.4%)の臨床検査値異常変動が報告されている。(承認時)
使用成績調査において、総症例3,240例中、346例(10.7%)の副作用(臨床検査値異常変動を含む)が報告されている。(再審査終了時)
高度のアルツハイマー型認知症
承認時までの臨床試験において、総症例386例中、171例(44.3%)の副作用(臨床検査値異常変動を含む)が報告されている。(承認時)
重大な副作用
1.
失神、徐脈、心ブロック、QT延長、心筋梗塞、心不全
失神(0.1%未満)、徐脈(0.1~1%未満)、心ブロック(洞房ブロック、房室ブロック)、QT延長、心筋梗塞、心不全(各0.1%未満)があらわれることがあるので、このような症状があらわれた場合には、投与を中止するなど適切な処置を行うこと。
2.
消化性潰瘍、十二指腸潰瘍穿孔、消化管出血
本剤のコリン賦活作用による胃酸分泌及び消化管運動の促進によって消化性潰瘍(胃・十二指腸潰瘍)(0.1%未満)、十二指腸潰瘍穿孔(頻度不明)、消化管出血(0.1%未満)があらわれることがあるので、このような症状があらわれた場合には、投与を中止するなど適切な処置を行うこと。
3.
肝炎、肝機能障害、黄疸
肝炎(頻度不明)、肝機能障害(0.1~1%未満)、黄疸(頻度不明)があらわれることがあるので、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
4.
脳性発作、脳出血、脳血管障害
脳性発作(てんかん、痙攣等)(0.1~1%未満)、脳出血、脳血管障害(各0.1%未満)があらわれることがあるので、このような症状があらわれた場合には、投与を中止するなど適切な処置を行うこと。
5.
錐体外路障害(0.1~1%未満)
寡動、運動失調、ジスキネジア、ジストニア、振戦、不随意運動、歩行異常、姿勢異常、言語障害等の錐体外路障害があらわれることがあるので、このような症状があらわれた場合には、投与を中止するなど適切な処置を行うこと。
6.
悪性症候群(Syndrome malin)(0.1%未満)
無動緘黙、強度の筋強剛、嚥下困難、頻脈、血圧の変動、発汗等が発現し、それに引き続き発熱がみられる場合は、投与を中止し、体冷却、水・電解質管理等の全身管理とともに適切な処置を行うこと。本症発症時には、白血球の増加や血清CK(CPK)の上昇がみられることが多く、また、ミオグロビン尿を伴う腎機能の低下がみられることがある。
7.
横紋筋融解症(頻度不明)
横紋筋融解症があらわれることがあるので、観察を十分に行い、筋肉痛、脱力感、CK(CPK)上昇、血中及び尿中ミオグロビン上昇等があらわれた場合には、投与を中止し、適切な処置を行うこと。また、横紋筋融解症による急性腎不全の発症に注意すること。
8.
呼吸困難(0.1%未満)
呼吸困難があらわれることがあるので、このような症状があらわれた場合には、投与を中止し、適切な処置を行うこと。
9.
急性膵炎(頻度不明)
急性膵炎があらわれることがあるので、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
10.
急性腎不全(0.1%未満)
急性腎不全があらわれることがあるので、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
11.
原因不明の突然死(0.1%未満)
その他の副作用
21. その他
頻度不明
発汗、顔面浮腫、発熱
その他の副作用の注意
注)このような症状があらわれた場合には、投与を中止すること。
発現頻度は、軽度及び中等度のアルツハイマー型認知症承認時までの臨床試験及び使用成績調査、高度のアルツハイマー型認知症承認時までの臨床試験の結果をあわせて算出した。
妊婦、産婦、授乳婦等への投与
1.
妊婦又は妊娠している可能性のある婦人には、治療での有益性が危険性を上回ると判断される場合にのみ投与すること。
〔動物実験(ラット経口10mg/kg)で出生率の減少、死産児頻度の増加及び生後体重の増加抑制が報告されている。〕
2.
授乳中の婦人への投与は避けることが望ましいが、やむを得ず投与する場合は、授乳を避けさせること。
〔ラットに14C-ドネペジル塩酸塩を経口投与したとき、乳汁中へ移行することが認められている。〕
小児等への投与
小児に対する安全性は確立していない(使用経験がない)。
過量投与
1.
徴候・症状
コリンエステラーゼ阻害剤の過量投与は高度な嘔気、嘔吐、流涎、発汗、徐脈、低血圧、呼吸抑制、虚脱及び痙攣等のコリン系副作用を引き起こす可能性がある。筋脱力の可能性もあり、呼吸筋の弛緩により死亡に至ることもあり得る。
2.
処置
アトロピン硫酸塩水和物のような3級アミン系抗コリン剤が本剤の過量投与の解毒剤として使用できる。アトロピン硫酸塩水和物の1.0~2.0mgを初期投与量として静注し、臨床反応に基づいてその後の用量を決める。他のコリン作動薬では4級アンモニウム系抗コリン剤と併用した場合、血圧及び心拍数が不安定になることが報告されている。本剤あるいはその代謝物が透析(血液透析、腹膜透析又は血液濾過)により除去できるかどうかは不明である。
適用上の注意
1.
投与経路
内服用のみに使用させること。
2.
薬剤交付時
(1)
服用の直前にアルミ袋を開封するよう指導すること(主薬が酸化により分解されることがある)。
(2)
包装又はカップごと服用しないよう指導すること。
3.
服用時
(1)
本剤はカップ入りのゼリー製剤であり、スプーン等で投与しやすい大きさにして服用させること。
(2)
カップ開封後はできるだけ速やかに服用させること。
その他の注意
1.
外国において、NINDS‐AIREN診断基準に合致した脳血管性認知症(本適応は国内未承認)と診断された患者を対象(アルツハイマー型認知症と診断された患者は除外)に6カ月間のプラセボ対照無作為二重盲検試験3試験が実施された。最初の試験の死亡率はドネペジル塩酸塩5mg群1.0%(2/198例)、ドネペジル塩酸塩10mg群2.4%(5/206例)及びプラセボ群3.5%(7/199例)であった。2番目の試験の死亡率はドネペジル塩酸塩5mg群1.9%(4/208例)、ドネペジル塩酸塩10mg群1.4%(3/215例)及びプラセボ群0.5%(1/193例)であった。3番目の試験の死亡率はドネペジル塩酸塩5mg群1.7%(11/648例)及びプラセボ群0%(0/326例)であり両群間に統計学的な有意差がみられた。なお、3試験を合わせた死亡率はドネペジル塩酸塩(5mg及び10mg)群1.7%、プラセボ群1.1%であったが、統計学的な有意差はなかった。
2.
動物実験(イヌ)で、ケタミン・ペントバルビタール麻酔又はペントバルビタール麻酔下にドネペジル塩酸塩を投与した場合、呼吸抑制があらわれ死亡に至ったとの報告がある。
薬物動態
1.
血中濃度
(1)
単回投与
健康成人男子を対象に、錠剤を絶食下単回経口投与したときの平均血漿中濃度推移を図に示した。最高血漿中濃度(C
max)及び血漿中濃度-時間曲線下面積(AUC)は投与量の増加に依存して高くなった。5mg又は10mg単回投与時における薬物動態パラメータを表に示した。

健康成人男子を対象に、アリセプト内服ゼリー5mg、錠5mgを絶食下単回経口投与したときの平均血漿中濃度推移は図のとおりであった。

(2)
反復投与
健康成人男子を対象に、錠剤5mg又は8mg
注)を1日1回14日間反復経口投与した。図に示すように、反復投与後の血漿中濃度は投与後約2週間で定常状態に達し、蓄積性あるいは体内動態に変化はないと考えられた。

(3)
食事の影響
健康成人男子を対象に吸収に及ぼす食事の影響を錠2mg注)で検討した結果、摂食時投与の血漿中濃度は絶食時とほぼ同様な推移を示し、食事による影響は認められなかった。
(4)
生物学的同等性
健康成人男子を対象に実施した生物学的同等性試験の結果、錠3mgと内服ゼリー3mg(8名)、錠5mgと内服ゼリー5mg(9名)はそれぞれ生物学的に同等であることが確認された。また、内服ゼリー10mgは錠10mgと生物学的に同等とみなされた。
2.
蛋白結合
In vitro試験において、ヒト血漿蛋白結合率は88.9%であり、in vivoでの血清蛋白結合率は92.6%であった。
3.
代謝
主代謝経路はN‐脱アルキル化反応であり、それに次いでO‐脱メチル化反応とそれに続くグルクロン酸抱合反応であると考えられた。
N‐脱アルキル化反応には主としてCYP3A4が、またO‐脱メチル化反応には主としてCYP2D6が関与していることが示唆された。1)
4.
排泄
健康成人男子を対象に錠2mg注)を単回経口投与したとき、投与後7日目までに尿中に排泄された未変化体は投与量の9.4%であり、代謝物を含めると29.6%であった。また、10mgの単回経口投与後、11日目までに排泄された未変化体は尿中で10.6%、糞中で1.7%であった。未変化体及び代謝物を合計した尿中排泄率は35.9%であり、糞中排泄率は8.4%であった。
5.
高齢者、肝疾患及び腎機能障害患者における薬物動態
(1)
高齢者
高齢者を対象に錠2mg注)を単回経口投与したときの薬物動態パラメータは健康成人と比較して、消失半減期が1.5倍有意に延長したが、Cmax、tmax及びAUCに有意な差は認められなかった。
(2)
肝疾患患者
アルコール性肝硬変患者(米国)を対象に錠5mgを単回経口投与したときの薬物動態パラメータは健康成人と比較して肝疾患患者のCmaxが1.4倍高く有意差が認められたが、他のパラメータに有意差は認められなかった。2)
(3)
腎機能障害患者
腎機能障害患者(英国)を対象に錠5mgを単回経口投与したときの薬物動態パラメータには、健康成人のそれと有意差は認められなかった。3)
注)承認用法・用量は「通常、成人にはドネペジル塩酸塩として1日1回3mgから開始し、1~2週間後に5mgに増量し、経口投与する。高度のアルツハイマー型認知症患者には、5mgで4週間以上経過後、10mgに増量する。なお、症状により適宜減量する。」である。
薬物動態の表
健康成人男子に5mg又は10mg単回経口投与した際の薬物動態パラメータ(錠剤)
| 投与量 |
Cmax
(ng/mL) |
tmax
(hr) |
AUC
(ng・hr/mL) |
t1/2
(hr) |
CL/F
(L/hr/kg) |
| 5mg |
9.97
±2.08 |
3.00
±1.10 |
591.72
±155.87 |
89.3
±36.0 |
0.141
±0.040 |
| 10mg |
28.09
±9.81 |
2.42
±1.24 |
1098.40
±304.63 |
75.7
±17.3 |
0.153
±0.043 |
CL/F:総クリアランス
(Mean±S.D., n=6)
健康成人男子に5mg単回経口投与した際の薬物動態パラメータ(内服ゼリー剤及び錠剤)
| 投与量 |
Cmax
(ng/mL) |
tmax
(hr) |
AUC0‐168
(ng・hr/mL) |
t1/2
(hr) |
内服ゼリー
5mg |
12.70
±3.90 |
3.0
(2.0‐4.0) |
442.7
±102.8 |
62.2
±4.9 |
| 錠5mg |
12.25
±4.13 |
2.0
(2.0‐3.0) |
433.4
±107.4 |
64.3
±12.7 |
(Mean±S.D.、ただしt
maxは中央値(最小値‐最大値)、n=9)
臨床成績
1.
軽度及び中等度のアルツハイマー型認知症
軽度及び中等度のアルツハイマー型認知症患者268例を対象にアリセプト錠5mg(3mg/日を1週間投与後、5mg/日を23週間投与)又はプラセボを24週間投与する二重盲検比較試験を実施した。
最終全般臨床症状評価において5mg群はプラセボ群と比較して有意に優れていた。「改善」以上の割合は5mg群17%、プラセボ群13%、「軽度悪化」以下の割合は5mg群17%、プラセボ群43%であった。
認知機能を評価するADAS‐Jcog得点の経時変化を表に示す(最終解析対象:205例)。投与開始時との得点差の平均では、投与12週後より5mg群がプラセボ群と比較して有意な改善が認められた。最終時の5mg群とプラセボ群の投与前後の変化量の差は2.44点であった。
重症度評価尺度であるCDRの経時変化を表に示す(最終解析対象:228例)。投与開始時との得点差の平均では、投与12週後より5mg群がプラセボ群と比較して有意な改善が認められた。4)
2.
高度のアルツハイマー型認知症
高度のアルツハイマー型認知症患者302例を対象にアリセプト錠10mg(3mg/日を2週間投与後、5mg/日を4週間投与、次いで10mg/日を18週間投与)、5mg(3mg/日を2週間投与後、5mg/日を22週間投与)又はプラセボを24週間投与する二重盲検比較試験を実施した。
CIBIC plus(全般的臨床症状評価)において10mg群はプラセボ群と比較して有意に優れていた(最終解析対象:287例)。

認知機能を評価するSIB得点の最終時の変化量を表に示す(最終解析対象:288例)。投与開始時との得点差の平均では、5mg群、10mg群それぞれ、6.7点、9.0点であり、プラセボ群と比較して有意な改善が認められた。
5)
臨床成績の表
ADAS‐Jcogの経時変化(軽度及び中等度アルツハイマー型認知症)
評価
時期 |
投与群 |
0週からの変化量※1
平均値±S.E.(n) |
変化量の群間比較
平均差※2 |
| 12週 |
5mg |
-3.03±0.47(106) |
- |
| 12週 |
プラセボ |
-0.84±0.50(101) |
2.19 |
| 24週 |
5mg |
-3.07±0.50(96) |
- |
| 24週 |
プラセボ |
-0.11±0.56(86) |
2.96 |
| 最終※3 |
5mg |
-2.70±0.48(107) |
- |
| 最終※3 |
プラセボ |
-0.26±0.52(98) |
2.44 |
(マイナス値は改善を示す。)
CDR合計点の経時変化(軽度及び中等度アルツハイマー型認知症)
評価
時期 |
投与群 |
0週からの変化量※1
平均値±S.E.(n) |
変化量の群間比較
平均差※2 |
| 12週 |
5mg |
-0.12±0.08(113) |
- |
| 12週 |
プラセボ |
0.23±0.10(109) |
0.35 |
| 24週 |
5mg |
-0.14±0.13(104) |
- |
| 24週 |
プラセボ |
0.72±0.17(95) |
0.86 |
| 最終※3 |
5mg |
-0.10±0.12(116) |
- |
| 最終※3 |
プラセボ |
0.75±0.15(112) |
0.85 |
(マイナス値は改善を示す。)
※1:[各評価時期の値]-[0週の値]
※2:[プラセボ群の0週からの変化量の平均値]-[5mg群の0週からの変化量の平均値]
※3:最終時は原則として24週時の評価としたが、中止・脱落例については、12週以上の服薬がある場合の最終データを解析の対象とした。
最終時※1のSIB(高度アルツハイマー型認知症)
| 投与群 |
0週からの変化量※2
平均値±S.E.(n) |
変化量の群間比較
平均差※3 |
| 10mg |
4.7±1.1(92) |
9.0 |
| 5mg |
2.5±1.0(95) |
6.7 |
| プラセボ |
-4.2±1.0(101) |
- |
(プラス値は改善を示す。)
※1:最終時は原則として24週時の評価としたが、中止・脱落例については、最終データを解析の対象とした。
※2:[最終の値]-[0週の値]
※3:[各投与群の0週からの変化量の平均値]-[プラセボ群の0週からの変化量の平均値]
薬効薬理
1.
作用機序
アルツハイマー型認知症では、脳内コリン作動性神経系の顕著な障害が認められている。本薬は、アセチルコリン(ACh)を分解する酵素であるアセチルコリンエステラーゼ(AChE)を可逆的に阻害することにより脳内ACh量を増加させ、脳内コリン作動性神経系を賦活する。6) 7) 8) 9)
2.
AChE阻害作用及びAChEに対する選択性
In vitroでのAChE阻害作用のIC50値は6.7nmol/Lであり、ブチリルコリンエステラーゼ阻害作用のIC50値は7,400nmol/Lであった。AChEに対し選択的な阻害作用を示した。6)
3.
脳内AChE阻害作用及びACh増加作用
経口投与により、ラット脳のAChEを阻害し、また脳内AChを増加させた。7) 8)
4.
学習障害改善作用
脳内コリン作動性神経機能低下モデル(内側中隔野の破壊により学習機能が障害されたラット)において、経口投与により学習障害改善作用を示した。9)
有効成分に関する理化学的知見
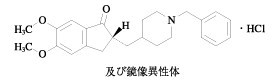
一 般 名
ドネペジル塩酸塩(Donepezil Hydrochloride)
*化 学 名
(2RS)‐2‐[(1‐Benzylpiperidin‐4‐yl)methyl]‐5,6‐dimethoxy‐2,3‐dihydro‐1H‐inden‐1‐one monohydrochloride
分 子 式
C24H29NO3・HCl
分 子 量
415.95
*構 造 式
*物理化学的性状
ドネペジル塩酸塩は白色の結晶性の粉末である。
本品は水にやや溶けやすく、エタノール(99.5)に溶けにくい。
本品の水溶液(1→100)は旋光性を示さない。
融 点
223.5℃(分解)
分配係数
log P=4.27(1-オクタノール/水)
取扱い上の注意
1.
誤用を避けるため他の容器に移し替えて保存しないこと。
2.
小児等の手の届かないところに保存すること。
3.
高温を避けて保存すること。
4.
包装に表示している上下の向きに注意して保存すること。
5.
アルミ袋の状態で保存すること(アルミ袋内に脱酸素剤を封入している)。
6.
ゼリー表面に水分がみられることがあるが、製剤由来のものである。
包装
アリセプト内服ゼリー3mg:14個(7個×2)
アリセプト内服ゼリー5mg:14個(7個×2)
アリセプト内服ゼリー10mg:14個(7個×2)