作成又は改訂年月
**2009年6月改訂(第11版、薬事法改正に伴う改訂)
*2008年11月改訂
日本標準商品分類番号
872391
日本標準商品分類番号等
再審査結果公表年月(最新)
2007年6月
国際誕生年月
1996年7月
薬効分類名
5-HT3受容体拮抗型制吐剤(ラモセトロン塩酸塩口腔内崩壊錠)
承認等
販売名
ナゼアOD錠0.1mg
販売名コード
2391004F1024
承認・許可番号
承認番号
21000AMZ00656
商標名
Nasea OD Tablets 0.1mg
薬価基準収載年月
1998年8月
販売開始年月
1998年8月
貯法・使用期限等
**貯法
遮光、気密容器、室温保存〔開封後は湿気を避けて保存すること。〕
**使用期限
ケース等に表示(製造後3年)〔使用期限内であっても開封後はなるべく速やかに使用すること。〕
**注意
【取扱い上の注意】の項参照
規制区分
劇薬
処方せん医薬品
注意-医師等の処方せんにより使用すること
組成
有効成分(1錠中)
ラモセトロン塩酸塩0.1mg
添加物
乳糖水和物、D-マンニトール、アスパルテーム(L-フェニルアラニン化合物)、カンテン末、黄色三二酸化鉄、三二酸化鉄
性状
剤形
口腔内崩壊錠
色
曲面側:うすい赤みの黄色
平面側:くすんだ赤みの黄色
外形・表
外形・裏
外形・側面
大きさ・直径(mm)
8.5
大きさ・厚さ(mm)
4.0
重量(g)
0.17
識別コード
 405(シート記載)
本剤は、頂部が扁平な半球状の錠剤である。
一般的名称
ラモセトロン塩酸塩口腔内崩壊錠
Ramosetron Hydrochloride
効能又は効果
抗悪性腫瘍剤(シスプラチン等)投与に伴う消化器症状(悪心、嘔吐)
用法及び用量
通常、成人にはラモセトロン塩酸塩として0.1mgを1日1回経口投与する。なお、年齢、症状により適宜増減する。
使用上の注意
重要な基本的注意
1.
本剤は口腔内で崩壊するが、口腔の粘膜から吸収されることはないため、唾液又は水で飲み込ませること。
2.
本剤は強い悪心、嘔吐が生じる抗悪性腫瘍剤(シスプラチン等)の投与の場合に限り使用すること。
3.
主として、本剤は強い悪心、嘔吐が生じる抗悪性腫瘍剤(シスプラチン等)を投与する際に、その悪心、嘔吐を未然に防ぐために使用し、注射剤は悪心、嘔吐が発現している患者への制吐療法として使用すること。
4.
本剤は、抗悪性腫瘍剤の投与1時間前に投与する。
5.
癌化学療法の各クールにおいて、本剤の投与期間は5日間以内とする。
6.
抗悪性腫瘍剤投与後、本剤の効果が不十分で悪心、嘔吐が発現した場合には、他の制吐療法(注射剤の投与等)を考慮すること。
相互作用
相互作用の概略
*本剤は、主として肝臓の薬物代謝酵素CYP1A2及びCYP2D6により代謝される。(「薬物動態」の項参照)
併用注意
(併用に注意すること)
薬剤名等
*フルボキサミン
臨床症状・措置方法
*本剤の血中濃度が上昇し、副作用が増強されるおそれがある。
機序・危険因子
*フルボキサミンのCYP1A2阻害作用により本剤の血中濃度が上昇する可能性がある。
副作用
副作用等発現状況の概要
承認時までの臨床試験では、278例中17例(6.1%)に、市販後の使用成績調査では、3,121例中214例(6.9%)に臨床検査値異常を含む副作用が認められた。(再審査結果通知:2007年6月)
以下の副作用は、上記の試験・調査あるいは自発報告等で認められたものである。
重大な副作用
ショック、アナフィラキシー様症状(いずれも頻度不明):ショック、アナフィラキシー様症状(気分不良、胸内苦悶感、呼吸困難、喘鳴、顔面潮紅、発赤、そう痒感、チアノーゼ、血圧低下等)を起こすことがあるので観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
重大な副作用(類薬)
てんかん様発作:他の5-HT3受容体拮抗型制吐剤で、外国において、てんかん様発作があらわれたとの報告がある。
その他の副作用
過敏症注)
0.1%未満
皮疹
精神神経系
0.1~1%未満
頭痛・頭重
精神神経系
0.1%未満
眠気
消化器
0.1%未満
便秘
腎臓
0.1~1%未満
BUN上昇
肝臓
1~5%未満
肝機能異常(AST(GOT)上昇、ALT(GPT)上昇、LDH上昇、ビリルビン上昇)
その他
0.1~1%未満
発熱
その他の副作用の注意
注)このような症状があらわれた場合には投与を中止すること。
高齢者への投与
患者の状態を観察しながら慎重に投与すること。副作用が発現した場合には、投与を中止するなど適切な処置を行うこと。[一般に高齢者では生理機能が低下している。]
妊婦、産婦、授乳婦等への投与
1.
妊婦等
妊婦又は妊娠している可能性のある婦人には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[妊娠中の投与に関する安全性は確立されていない。]
2.
授乳婦
授乳中の婦人に投与する場合には授乳を中止させること。[ラットにおいて乳汁中への移行が報告されている。]
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない。(使用経験がない。)
適用上の注意
1.
薬剤交付時
(1)
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。[PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。]
(2)
本剤はPTP包装より取り出す際、縁の欠け又は傷つく可能性があるが、品質には問題はない。欠けが生じた場合は全量服薬させること。PTP包装からの取り出しは、爪を立てずに指の腹で押し出すことが望ましい。
2.
服用時
本剤は舌の上にのせ唾液を浸潤させ舌で軽くつぶし、崩壊後唾液のみで服用可能である。
薬物動態
吸収・代謝・排泄
*健康成人に0.4~1.6mg経口投与したときの血漿中未変化体濃度は投与後約2時間にCmaxを示し、以後半減期は約5時間であった。Cmax及びAUCは投与量に比例し、体内動態は線形性を示した1)。静脈内投与時の血漿中濃度2)をもとに有効利用率を求めたところ50%以上であった。投与後24時間までの尿中未変化体排泄率は8~13%であった1)。尿中には未変化体の他に代謝物として脱メチル体、水酸化体及びその抱合体が存在した3)。健康成人に反復投与したとき、体内動態の変化はなく、蓄積性は認められなかった1)。
in vitro代謝試験において、ラモセトロン塩酸塩の一次代謝には肝臓の薬物代謝酵素CYP1A1、CYP1A2及びCYP2D6が関与することが示されており4)、ヒトにおける本剤の一次代謝にはCYP1A2及びCYP2D6が関与していると考えられる。
薬物動態の表
<健康成人に経口投与したときの薬動力学パラメータ>1)
| 投与量 |
Tmax(h) |
Cmax(ng/mL) |
t1/2(h) |
AUC(ng・h/mL) |
有効利用率(%) |
| 0.4mg |
2.17 |
1.37 |
5.52 |
11.58 |
53.0 |
| 0.8mg |
2.50 |
2.77 |
5.35 |
25.77 |
59.0 |
| 1.6mg |
2.67 |
5.63 |
4.93 |
48.05 |
55.0 |
(6例の平均値) (注)本剤の承認された1日用量は、0.1mgである。
臨床成績
シスプラチン等の抗悪性腫瘍剤投与により発現する悪心、嘔吐を対象として、シスプラチン投与の1時間前に本剤を投与する二重盲検比較試験及び一般臨床試験を国内延べ90施設、284例を対象として行った。臨床成績の概要は以下のとおりである5)~9)。
なお、シスプラチン等の抗悪性腫瘍剤投与により発現する悪心、嘔吐を対象とした二重盲検比較試験7)において、本剤の有用性が確認されている。
臨床成績の表
| 投与量 |
シスプラチン等の抗悪性腫瘍剤投与により発現する悪心、嘔吐に対して単回経口投与を行ったときの有効率 |
シスプラチン等の抗悪性腫瘍剤投与により発現する悪心、嘔吐に対して5日間連日投与を行ったときの有効率 |
| 0.1mg |
77.9% (106/136例) |
80.0% (12/15例) |
薬効薬理
1.
薬理作用
(1)
5-HT3受容体拮抗作用
モルモット摘出結腸のセロトニン誘発収縮実験10)において、強力かつ選択的な5-HT3受容体拮抗作用を示した。また、ラット11)及びフェレット12)のセロトニン誘発徐脈反射(ベツォルト-ヤーリッシュ反射)の実験において、経口投与により強力かつ持続的な5-HT3受容体拮抗作用を示した。
(2)
抗悪性腫瘍剤誘発嘔吐抑制作用
シスプラチン投与により誘発されたフェレットの嘔吐に対して、経口投与により抑制作用を示し、その作用は強力かつ持続的であった13)。
2.
作用機序
シスプラチン等の抗悪性腫瘍剤は消化管の腸クロム親和性細胞からセロトニンを遊離させる。このセロトニンが消化管粘膜内求心性迷走神経終末に存在する5-HT3受容体に結合し、その刺激が嘔吐中枢を経て嘔吐を誘発させる。ラモセトロン塩酸塩はこの5-HT3受容体を遮断することにより制吐作用を発現するものと考えられる。
有効成分に関する理化学的知見
一般名
ラモセトロン塩酸塩(Ramosetron Hydrochloride)
化学名
(-)-(R )-5-[(1-Methyl-1H -indol-3-yl)carbonyl]-4,5,6,7-tetrahydro-1H -benzimidazole monohydrochloride
分子式
C17H17N3O・HCl
分子量
315.80
構造式
性状
ラモセトロン塩酸塩は白色~微帯黄白色の結晶性の粉末である。水又はメタノールに溶けやすく、エタノール(99.5)にやや溶けにくい。吸湿性である。光によって変化する。
取扱い上の注意
** 注意
(1)
本剤は自動分包機使用不適[通常の錠剤に比べやわらかい。]
(2)
**本品は高防湿性の内袋により品質保持をはかっている。
包装
10錠(1錠×10)
主要文献及び文献請求先
主要文献
1)
中島光好 他:臨床と研究 72(11):2912,1995 [NA-088]
2)
中島光好 他:臨床と研究 71(9):2461,1994 [NA-065]
3)
社内報告書(健康成人・薬物動態)(D199603030-02.00,1996)
4)
社内報告書(ヒト肝ミクロソーム・代謝)(DIR050011)
5)
野田起一郎 他:新薬と臨床 45(3):482,1996 [NA-00288]
6)
野田起一郎 他:新薬と臨床 45(7):1309,1996 [NA-110]
7)
野田起一郎 他:新薬と臨床 45(8):1445,1996 [NA-116]
8)
武谷雄二 他:産科と婦人科 63(9):1297,1996 [NA-093]
9)
武谷雄二 他:産婦人科の世界 48(8):749,1996 [NA-117]
10)
Miyata,K.et al.:J.Pharmacol.Exp.Ther.259:15,1991 [NA-033]
11)
Miyata,K.et al.:J.Pharmacol.Exp.Ther.259(2):815,1991 [NA-00196]
12)
藤原明 他:薬理と臨床 6(7):1209,1996 [NA-153]
13)
藤原明:薬理と臨床 6(7):1215,1996 [NA-155]
文献請求先・製品情報お問い合わせ先
主要文献に記載の社内報告書につきましても下記にご請求下さい。
アステラス製薬株式会社 営業本部DIセンター
〒103-8411 東京都中央区日本橋本町2丁目3番11号
 0120-189-371
製造販売業者等の氏名又は名称及び住所
製造販売
アステラス製薬株式会社
東京都板橋区蓮根3丁目17番1号

|






 405(シート記載)
405(シート記載)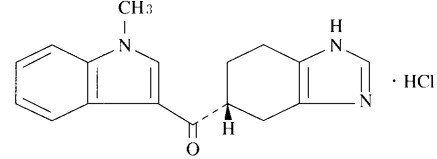
 0120-189-371
0120-189-371
