作成又は改訂年月
2010年10月作成 (第1版)
日本標準商品分類番号
873999
日本標準商品分類番号等
国際誕生年月
2008年11月
薬効分類名
経口血小板増加薬/トロンボポエチン受容体作動薬
承認等
販売名
レボレード錠12.5mg
販売名コード
3999028F1025
承認・許可番号
承認番号
22200AMX00960
商標名
REVOLADE Tablets
薬価基準収載年月
2010年12月
販売開始年月
2010年12月
貯法・使用期限等
貯法
室温保存
使用期限
包装に表示
規制区分
劇薬
処方せん医薬品
(注意-医師等の処方せんにより使用すること)
組成
1錠中のエルトロンボパグ オラミン(エルトロンボパグとして)含量
15.9mg(12.5mg)
添加物
結晶セルロース、D-マンニトール、デンプングリコール酸ナトリウム、ステアリン酸マグネシウム、ポビドン、ヒプロメロース、酸化チタン、マクロゴール400、ポリソルベート80
性状
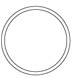
本剤は白色円形のフィルムコーティング錠で識別コード及び形状は下記のとおりである。
識別コード
GSMZ1 12.5
表
(直径)
 7.9mm
裏
側面
(厚さ)
 3.5mm
質量
184mg
販売名
レボレード錠25mg
販売名コード
3999028F2021
承認・許可番号
承認番号
22200AMX00961
商標名
REVOLADE Tablets
薬価基準収載年月
2010年12月
販売開始年月
2010年12月
貯法・使用期限等
貯法
室温保存
使用期限
包装に表示
規制区分
劇薬
処方せん医薬品
(注意-医師等の処方せんにより使用すること)
組成
1錠中のエルトロンボパグ オラミン(エルトロンボパグとして)含量
31.9mg(25mg)
添加物
結晶セルロース、D-マンニトール、デンプングリコール酸ナトリウム、ステアリン酸マグネシウム、ポビドン、ヒプロメロース、酸化チタン、マクロゴール400、ポリソルベート80
性状
本剤は白色円形のフィルムコーティング錠で識別コード及び形状は下記のとおりである。
識別コード
GSNX3 25
表
(直径)
 10.3mm
裏
側面
(厚さ)
 4.2mm
質量
364mg
一般的名称
エルトロンボパグ オラミン
Eltrombopag Olamine
効能又は効果
効能又は効果/用法及び用量
効能又は効果に関連する使用上の注意
1.
他の治療にて十分な効果が得られない場合、又は忍容性に問題があると考えられる場合に使用すること。
2.
血小板数、臨床症状からみて出血リスクが高いと考えられる場合に使用すること。
用法及び用量
通常、成人には、エルトロンボパグとして初回投与量12.5mgを1日1回、食事の前後2時間を避けて空腹時に経口投与する。なお、血小板数、症状に応じて適宜増減する。また、1日最大投与量は50mgとする。
用法及び用量に関連する使用上の注意
1.
本剤の投与中は、血液検査及び肝機能検査を定期的に実施し、本剤の用量は下記(1)~(7)を参照の上、調節すること。本剤の投与開始時及び用量調節時には血小板数及び末梢血塗抹標本検査を含む全血球計算を、血小板数が安定する(血小板数50,000/μL以上が少なくとも4週間)までは毎週、安定した後は毎月検査することが望ましい。
(1)
本剤は治療上必要最小限の用量で使用すること。
(2)
本剤の効果は、通常1~2週間であらわれるので、効果の確認のため少なくとも2週間は同一用量を維持すること。
(3)
血小板数50,000/μLを目安とし、血小板数がそれを下回る場合には増量を考慮すること。
(4)
血小板数が50,000/μL~200,000/μLの場合には、出血のリスクを低下できる治療上必要最小限の用量となるよう、適宜減量も考慮すること。
(5)
血小板数が200,000/μL~400,000/μLの場合には本剤を減量すること。
(6)
血小板数が400,000/μLを超えた場合には本剤を休薬すること。この場合血小板数の測定は週に2回実施することが望ましい。休薬後、血小板数が150,000/μLまで減少した場合には休薬前の投与量よりも原則として一段階用量を減量した上で投与を再開すること。
(7)
投与量を調節する場合には、通常、12.5mg/日ずつとする。
2.
本剤は食事とともに服用すると血中濃度が低下することがあるので、食事の前後2時間を避けて空腹時に服用すること(「薬物動態」の項参照)。
3.
制酸剤、乳製品、多価陽イオン(鉄、カルシウム、アルミニウム、マグネシウム、セレン、亜鉛等)含有製剤等とともに服用すると本剤の血中濃度が低下するので、本剤服用の前後4時間はこれらの摂取を避けること(「相互作用」の項参照)。
4.
本剤を1日50mg、4週間投与しても血小板数が増加せず、臨床的に問題となる出血傾向の改善が認められない場合には、本剤の投与中止を考慮すること。
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
1.
肝障害のある患者[肝障害が悪化するおそれがある。また、血中濃度-時間曲線下面積(AUC)が増加する可能性がある(「薬物動態」の項参照)。]
2.
腎障害のある患者[腎障害患者での有効性及び安全性は確立していないため、これらの患者では血小板数の推移に加えて安全性についても慎重に観察すること(「薬物動態」の項参照)。]
3.
アンチトロンビンIII欠損、抗リン脂質抗体症候群等の血栓塞栓症の素因のある患者[血栓塞栓症があらわれるおそれがある。]
重要な基本的注意
1.
本剤は、血液疾患の治療に十分な経験を持つ医師のもとで使用すること。
2.
本剤の投与により肝機能障害があらわれることがあるので、本剤の投与開始前及び用量調節時は2週間毎、用量の変更がなければ1ヵ月毎に肝機能検査(AST(GOT)、ALT(GPT)、ビリルビン等)を実施すること(「重大な副作用」の項参照)。
3.
血小板数が正常範囲以下であっても血栓塞栓症が認められているため、血小板数にかかわらず血栓塞栓症の発現に注意すること(「重大な副作用」の項参照)。また、血小板数が正常範囲を超えると、血栓塞栓症のリスクが増加する可能性があるので、観察を十分に行い、血小板数が治療の目標とするレベルを超えた場合には、本剤の減量又は休薬を考慮する等注意すること。
4.
本剤の投与中止後2週間以内に血小板数が投与開始前の値まで低下し、出血を生じることがあるので、本剤の投与中止後4週間程度は頻回に血小板数を測定すること(「重大な副作用」の項参照)。
5.
本剤を含むトロンボポエチン受容体作動薬には、骨髄のレチクリン線維の形成及び線維化を進行させる可能性があるので、本剤の投与開始前には末梢血塗抹標本検査を行い、細胞の形態学的異常を確認すること。また、本剤の投与中は、毎月白血球分画を含む全血球計算を検査し、未熟細胞又は異型細胞が観察された場合には、末梢血塗抹標本検査を行い、形態学的異常(涙滴赤血球、有核赤血球、未熟白血球等)の発現を確認し、血球減少の有無も確認すること。これらの異常が認められた場合には、本剤の投与を中止し、骨髄生検(染色による骨髄線維化の評価等)の実施を考慮すること(「重大な副作用」の項参照)。
6.
トロンボポエチン受容体作動薬には、既存の骨髄異形成症候群等の血液悪性腫瘍を進行させる可能性がある。
7.
げっ歯類を用いた毒性試験において、白内障がみられた。また、臨床試験において白内障が報告されているので、白内障に対する眼科的な検査を定期的に行うことが望ましい。
相互作用
併用注意
(併用に注意すること)
1.
薬剤名等
ロスバスタチン
臨床症状・措置方法
本剤とロスバスタチンとの併用により、ロスバスタチンの血中濃度が上昇したとの報告がある。
ロスバスタチンの減量を考慮し、患者の状態を慎重に観察すること。
機序・危険因子
本剤がOATP1B1及びBCRPを阻害する可能性がある(「薬物動態」の項参照)。
2.
薬剤名等
制酸剤
乳製品
多価陽イオン(鉄、カルシウム、アルミニウム、マグネシウム、セレン、亜鉛等)含有製剤等
臨床症状・措置方法
同時に服用すると本剤の吸収が著しく妨げられることがあるので、本剤投与の前後4時間はこれらの摂取を避けること。
機序・危険因子
本剤はこれら多価陽イオンと錯体を形成する。
副作用
副作用等発現状況の概要
国内臨床試験において、23例中11例(48%)に臨床検査値異常を含む副作用が報告された。その主なものは、疲労、ALT(GPT)増加、血小板数増加、低カリウム血症各2例(9%)であった(承認時)。また、これら23例中19例がその後国内長期継続投与試験に移行した。移行した19例中5例(26%)に臨床検査値異常を含む副作用が報告された。その主なものは、白内障2例(11%)であった。(2009年8月時点の中間報告結果)
海外臨床試験において、135例中50例(37%)に臨床検査値異常を含む副作用が報告された。その主なものは、頭痛15例(11%)、ALT(GPT)増加6例(4%)、悪心6例(4%)、白内障5例(4%)、下痢4例(3%)であった(承認時)。
重大な副作用
1. 肝機能障害
AST(GOT、4%)、ALT(GPT、9%)、ビリルビン(4%)の増加等の肝機能障害があらわれることがあるので、本剤投与開始前及び投与中は定期的に肝機能検査を行う等、観察を十分に行い、異常が認められた場合には投与を中止する等適切な処置を行うこと(「重要な基本的注意」の項参照)。
2. 血栓塞栓症
肺塞栓症(頻度不明注))、深部静脈血栓症(頻度不明注))、一過性脳虚血発作(4%)、心筋梗塞(頻度不明注))、虚血性脳卒中(頻度不明注))等の血栓塞栓症があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止する等適切な処置を行うこと(「重要な基本的注意」の項参照)。
3. 出血
本剤の投与中止後に出血(頻度不明注))を生じることがあるので、観察を十分に行い、異常が認められた場合には、適切な処置を行うこと(「重要な基本的注意」の項参照)。
4. 骨髄線維化
骨髄線維化(頻度不明注))があらわれる可能性があるので、観察を十分に行い、異常が認められた場合には投与を中止する等適切な処置を行うこと(「重要な基本的注意」の項参照)。
その他の副作用
1. 消化器
5%未満
悪心
2. 消化器
頻度不明注)
嘔吐、下痢、口内乾燥
3. 皮膚
頻度不明注)
脱毛症、発疹
4. 筋骨格
頻度不明注)
背部痛、筋骨格系胸痛、筋骨格痛、筋痛
5. その他
5%以上
疲労、血小板数増加、低カリウム血症、白内障、頭痛
6. その他
頻度不明注)
咽頭炎、尿路感染
注)海外のみで認められている副作用については頻度不明とした。
高齢者への投与
高齢者では一般に生理機能が低下しているので、患者の状態を観察しながら注意して投与すること。
妊婦、産婦、授乳婦等への投与
1.
妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[妊婦への投与に関する安全性は確立しておらず、胎児の血小板への影響についても不明である。動物試験(ラット)において母体毒性用量で胚致死、胎児体重の低値及び低頻度の頸肋(変異)の増加が報告されている。]
2.
授乳中の婦人には、投与を避けることが望ましい。やむを得ず投与する場合には、授乳を避けさせること。[動物試験(ラット)で乳汁中への移行が示唆されている。]
小児等への投与
小児等に対する安全性及び有効性は確立していない(使用経験がない)。
過量投与
徴候・症状
本剤5,000mgを過量投与した症例では、軽度の発疹、一過性の徐脈、疲労、AST(GOT)及びALT(GPT)上昇が報告され、血小板数は929,000/μLまで増加した。
処置
吸収を抑えるために、カルシウム、アルミニウム、マグネシウム等の多価陽イオンを含有する製剤の経口投与を考慮すること。また、血小板数の検査を頻回に行い、患者の状態を十分に観察すること。本剤の腎排泄の寄与は小さく、血漿蛋白結合率が高いため、血液透析は有効な除去法ではないと考えられる。
適用上の注意
1.
薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。[PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。]
2.
PTPシートからの取り出しは、裏のシールを剥がした後、指の腹で押し出すこと。
その他の注意
1.
実験動物及びヒトのin vivo光安全性試験ではそれぞれ皮膚光毒性及び光感作性を示さなかったが、in vitro光遺伝毒性試験では、細胞毒性を示す濃度(≧15μg/mL)で700mJ/cm2のUV照射により染色体異常誘発能が認められた。
2.
本剤はヒト及びチンパンジー以外のトロンボポエチン受容体に対し親和性をもたず、ヒト及びチンパンジー以外の動物に対して薬理活性を示さない。このため毒性試験において、薬理活性に付随する影響は評価されていない。
薬物動態
1.
血中濃度
日本人健康成人男性を対象に、本剤25、50あるいは75mgを空腹時単回及び反復経口投与した時、本剤は速やかに吸収され、投与後3~4時間(中央値)で最高血漿中濃度(Cmax)に達した。単回及び反復投与時の曝露量(Cmax及びAUC)は、投与量の増加に対し、ほぼ線形的に増加した。また、本剤は反復投与開始後約7日で定常状態に達すると考えられた。表-1に薬物動態パラメータを示した。(本剤の国内承認用量は12.5~50mgを1日1回投与である。) 日本人特発性血小板減少性紫斑病患者に本剤12.5、25あるいは50mgを投与した時の定常状態における薬物動態パラメータを表-2に、血漿中エルトロンボパグ濃度推移を図-1に示した。  なお、日本人及び外国人の成績を用いた母集団薬物動態解析の結果、エルトロンボパグのAUC 0-τは、非東アジア系特発性血小板減少性紫斑病患者(主に白人)と比較して、東アジア系特発性血小板減少性紫斑病患者で約87%高値を示した。また、日本人特発性血小板減少性紫斑病患者のAUC 0-τは、非東アジア系特発性血小板減少性紫斑病患者のAUC 0-τ(母集団薬物動態解析推定値)に比べ、約85%高値を示した。 2.
分布
本剤はin vitro試験の結果、2~100μg/mLの濃度範囲で99.9%以上がヒト血漿蛋白質と結合し、主な結合蛋白質はアルブミンであった。
本剤はBCRPの基質であったが、P-糖蛋白質(Pgp)及びOATP1B1の基質ではないことが確認された。また、本剤はin vitro試験でOATP1B1及びBCRPを阻害(IC50値:いずれも約2.7μM)した。
3.
代謝
本剤はin vitro試験の結果、最大100μMの濃度でCYP1A2、CYP2A6、CYP2C19、CYP2D6、CYP2E1、CYP3A4/5及びCYP4A9/11の活性を阻害しなかったが、CYP2C8(パクリタキセル)及びCYP2C9(ジクロフェナク)の活性を阻害し、IC50値はそれぞれ24.8μM(11μg/mL)及び20.2μM(8.9μg/mL)であった。
健康成人男性に本剤75mgを反復経口投与した時、本剤はCYP1A2、CYP2C19、CYP2C9及びCYP3A4の活性を阻害及び誘導しなかった(外国人データ)。
本剤はin vitro試験の結果、UGT1A1、UGT1A3、UGT1A4、UGT1A6、UGT1A9、UGT2B7及びUGT2B15の活性を阻害(IC50値:3.0~33μM)した。
健康成人男性に本剤の14C-標識体75mgを経口投与した時、酸化体、グルクロン酸抱合体、グルタチオン抱合体又はシステイン抱合体に代謝された(外国人データ)。また、in vitro試験の結果、本剤の酸化的代謝にはCYP1A2及びCYP2C8が、グルクロン酸抱合にはUGT1A1及びUGT1A3が関与していると考えられた。
4.
排泄(外国人データ)
本剤の主な排泄経路は糞中であり、本剤の14C-標識体75mgを単回経口投与後168時間までに、平均で投与量の30.7%が尿中に、投与量の58.9%が糞中に排泄された。尿中に未変化体(エルトロンボパグ)は認められず、糞中には投与量の約20%が未変化体として排泄された。
5.
食事の影響(外国人データ)
健康成人に本剤50mgを、乳製品を含む高カロリー、高脂肪の食事(カルシウム427mg含有)とともに単回経口投与した時、空腹時に比べてAUC0-∞は59%、Cmaxは65%低下した。また、本剤75mgを高脂肪又は低脂肪のカルシウム含有量の低い(50mg未満)食事とともに投与した時、いずれもエルトロンボパグのAUC0-∞及びCmaxに影響を与えなかった。
6.
性別・年齢
母集団薬物動態解析の結果、女性特発性血小板減少性紫斑病患者におけるAUC0-τは、男性に比べて約50%高かった。また、年齢は本剤の薬物動態に影響を及ぼさなかった。
7.
腎障害患者における薬物動態(外国人データ)
腎障害患者に本剤50mgを単回経口投与した時のエルトロンボパグのAUC0-∞の幾何平均値は健康成人と比べて軽度の腎障害患者(CLcr:50~80mL/min)で32%、中等度の腎障害患者(CLcr:30~49mL/min)で36%、重度の腎障害患者(CLcr:30mL/min未満)で60%低かった。しかしながら、健康成人及び軽度~重度の腎障害患者のAUC0-∞の範囲(最小値~最大値)は、順に32.65~99.32、22.54~83.51、21.10~109.95、3.44~117.54μg・hr/mLとばらつきが大きかった。
8.
肝障害患者における薬物動態(外国人データ)
肝障害患者に本剤50mgを単回経口投与した時のエルトロンボパグのAUC0-∞の幾何平均値は健康成人と比べて軽度の肝障害患者(Child-Pughスコア:5~6)で41%、中等度の肝障害患者(Child-Pughスコア:7~9)で93%、重度の肝障害患者(Child-Pughスコア:10以上)で80%高かった。しかしながら、健康成人及び軽度~重度の肝障害患者のAUC0-∞の範囲(最小値~最大値)は、順に34.46~174.99、35.86~127.74、57.64~263.22、32.26~263.51μg・hr/mLとばらつきが大きかった。
9.
相互作用(外国人データ)
(1)
制酸剤
健康成人に、本剤75mgと多価陽イオン(水酸化アルミニウム及び炭酸マグネシウム)を含む制酸剤を単回併用投与した時、エルトロンボパグのAUC0-∞及びCmaxはともに約70%低下した。
(2)
ロスバスタチン
健康成人に本剤75mg投与の定常状態時に、OATP1B1及びBCRPの基質であるロスバスタチン10mgを単回併用投与した時、単独投与時に比べてロスバスタチンのAUC0-∞は55%、Cmaxは103%増加した(n=39)。層別解析の結果、アジア人では、AUC0-∞は32%、Cmaxは61%増加した(n=21)。なお、ロスバスタチンは、本剤の薬物動態に影響を及ぼさなかった。
表-1 健康成人に単回及び10日間反復経口投与した時の薬物動態パラメータ
投与量
(mg) |
例数 |
Cmax
(μg/mL) |
AUCa)
(μg・hr/mL) |
tmax
(hr) |
t1/2
(hr) |
CL/F
(L/hr) |
| 単回投与 |
|
|
|
|
|
|
| 25 |
10 |
3.56±1.13 |
55.4±23.2 |
3.0(2.0-5.0) |
29.6±5.0 |
0.534±0.256 |
| 50 |
10 |
6.44±2.14 |
106.6±32.4 |
3.0(1.5-5.0) |
31.0±5.9 |
0.525±0.218 |
| 75 |
10 |
8.39±2.84 |
134.9±37.4 |
3.0(2.0-6.0) |
32.4±7.6 |
0.604±0.201 |
| 反復投与 |
|
|
|
|
|
|
| 25 |
10 |
4.83±1.17 |
58.9±18.4 |
3.0(1.5-5.0) |
39.7±3.2 |
0.478±0.196 |
| 50 |
9 |
10.6±2.38 |
133.8±33.6 |
4.0(2.0-5.0) |
51.3±12.2 |
0.396±0.102 |
| 75 |
10 |
12.78±2.84 |
164.2±35.5 |
4.0(2.0-5.0) |
47.8±11.5 |
0.476±0.102 |
算術平均値±標準偏差、tmaxは中央値(範囲) a)単回投与:AUC 0-∞、反復投与:AUC 0-τ
表-2 日本人特発性血小板減少性紫斑病患者の定常状態における薬物動態パラメータ
投与量
(mg) |
例数 |
Cmax
(μg/mL) |
tmax
(hr) |
AUC0-τ
(μg・hr/mL) |
t1/2b)
(hr) |
| 12.5 |
8 |
2.99±1.25 |
3.19(2.00-4.17) |
41.64±24.36a) |
19.5±7.16a) |
| 25 |
5 |
6.78±2.62 |
4.00(2.00-4.00) |
92.53±41.12 |
27.0±7.66 |
| 50 |
4 |
11.88±3.93 |
2.97(1.92-4.17) |
171.6±75.24 |
18.2±4.94 |
算術平均値±標準偏差、tmaxは中央値(範囲) a)n=7 b)24時間までのポイントから算出のため、参考値
臨床成績
1.
国内臨床試験
既治療の慢性特発性血小板減少性紫斑病患者(血小板数が30,000/μL未満)23例を対象として、二重盲検下で本剤12.5又は25mgを1日1回空腹時に、7週間投与した。投与は12.5mgから開始し、投与3週目の血小板数に応じて25mgに用量調節した。その結果、投与6週目における本剤の有効率(血小板数が50,000/μL以上、400,000/μL以下に増加した患者の割合[95%信頼区間])は60%[32.29,83.66]であり、プラセボ(0%[0.00,36.94])に比べて明らかな血小板数増加効果が認められた。 二重盲検期終了後は、本剤の投与期間が26週間になるように本剤を継続投与した。用量は血小板数に応じて12.5、25又は50mgに調節した。その結果、投与5週目から26週目までの血小板数(中央値)は50,000/μLを超えて推移し、血小板数の増加に伴い出血症状が改善した(図-2、3)。 
 上記23例中19例が国内長期継続投与試験に移行した。用量は血小板数に応じて12.5~50mgに調節し、19例中9例では異なる用量の組み合わせや投与間隔の調節も行った。その結果、長期継続投与試験でも血小板数の増加と出血症状の改善が示された。投与期間の中央値は335.0日(範囲:260~464日)であった。(2009年8月時点の中間報告結果) 2.
海外臨床試験
既治療の慢性特発性血小板減少性紫斑病患者(血小板数が30,000/μL未満)197例を対象として、本剤25、50又は75mgを1日1回空腹時に、26週間投与する二重盲検試験を実施した(本剤135例、プラセボ62例)。投与は50mgから開始し、血小板数に応じて25、50又は75mgに用量調節した。その結果、本剤群のプラセボ群に対する血小板数増加効果のオッズ比[99%信頼区間]は8.2[3.59,18.73]であり、有意に高かった(p<0.001)。また、本剤群の血小板数(中央値)は、投与1週目より増加し、投与2~26週目まで50,000/μLを超えて推移した(図-4)。本剤投与により出血症状(WHO Bleeding Scaleを用いて評価、Grade2~4)が認められた患者の割合について、本剤群のプラセボ群に対するオッズ比[95%信頼区間]は0.35[0.19,0.64]であり、本剤群の方が有意に低下した(p<0.001)。(本剤の国内承認用量は12.5~50mgを1日1回投与である。) 
薬効薬理
1.
作用機序1)
ヒトトロンボポエチン受容体との特異的な相互作用を介して、トロンボポエチンのシグナル伝達経路の一部を活性化することにより骨髄前駆細胞から巨核球に至る過程における細胞の増殖及び分化を促進させ、その結果として血小板数を増加させる。
2.
血小板産生促進作用1)
(1)
In vitroにおいて、ヒト巨核球系細胞株の増殖を促進させ、ヒト骨髄前駆細胞の巨核球への分化を誘導した。
(2)
チンパンジーへの5日間経口投与により、最終投与の6~10日後に血小板数は約2倍に増加した。
3.
正常血小板機能に及ぼす影響2)
ヒト正常血小板においてアデノシン二リン酸誘発の血小板凝集に影響を及ぼさず、P-セレクチンの発現を誘導しなかった。
有効成分に関する理化学的知見
一般名
エルトロンボパグ オラミン(Eltrombopag Olamine)
化学名
3′-{(2Z)-2-[1-(3,4-Dimethylphenyl)-3-methyl-5-oxo-1,5-dihydro-4H-pyrazol-4-ylidene]hydrazino}-2′-hydroxybiphenyl-3-carboxylic acid bis(2-aminoethanol)
分子式
C25H22N4O4・2(C2H7NO)
分子量
564.63
構造式
性状
赤色~褐色の粉末
分配係数(log P)
4.05
承認条件
国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
包装

レボレード錠12.5mg:70錠(7錠×10)両面アルミニウムPTP
レボレード錠25mg:70錠(7錠×10)両面アルミニウムPTP
主要文献及び文献請求先
主要文献
1)
Erickson-Miller C.L.,et al.:Stem Cells,27,424-430(2009)
2)
Erhardt J.A.,et al.:Exp Hematol,37,1030-1037(2009)
文献請求先
グラクソ・スミスクライン株式会社
〒151-8566 東京都渋谷区千駄ヶ谷4-6-15
カスタマー・ケア・センター
TEL:0120-561-007(9:00~18:00/土日祝日及び当社休業日を除く)
FAX:0120-561-047(24時間受付)
製造販売業者等の氏名又は名称及び住所
グラクソ・スミスクライン株式会社
|