作成又は改訂年月
**2008年6月改訂 (第9版)
*2007年4月改訂
日本標準商品分類番号
873327 87449
日本標準商品分類番号等
再評価結果公表年月(最新)
1977年10月
薬効分類名
抗プラスミン剤
承認等
販売名
トランサミン錠250mg
販売名コード
3327002F1142
承認・許可番号
承認番号
21400AMZ00148
商標名
TRANSAMIN TABLETS
薬価基準収載年月
2002年7月
販売開始年月
2002年9月
貯法・使用期限等
貯法
室温保存
使用期限
包装に表示の使用期限内に使用すること。
基準名
日本薬局方
トラネキサム酸錠
組成
1錠中に次の成分を含有
有効成分
トラネキサム酸(日局) 250mg
添加物
トウモロコシデンプン、ポリビニルアルコール(部分けん化物)、低置換度ヒドロキシプロピルセルロース、ステアリン酸マグネシウム、硬化油
性状
剤形
素錠
色
白色
外形
直径 (mm)
10.0
厚さ (mm)
3.2
重さ (mg)
290
識別コード
 606
販売名
トランサミン錠500mg
販売名コード
3327002F2041
承認・許可番号
承認番号
15300AMZ01211
商標名
TRANSAMIN TABLETS
薬価基準収載年月
1981年9月
販売開始年月
1981年9月
貯法・使用期限等
貯法
室温保存
使用期限
包装に表示の使用期限内に使用すること。
基準名
日本薬局方
トラネキサム酸錠
組成
1錠中に次の成分を含有
有効成分
トラネキサム酸(日局) 500mg
添加物
カルメロースカルシウム、ポリビニルアルコール(部分けん化物)、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール6000、タルク、酸化チタン、ジメチルポリシロキサン、二酸化ケイ素、カルナウバロウ
性状
剤形
フィルムコーティング錠(キャプレット型)
色
白色~淡黄白色
外形
長径 (mm)
17.8
短径 (mm)
7.2
厚さ (mm)
5.0
重さ (mg)
574
識別コード
 608
販売名
トランサミンカプセル250mg
販売名コード
3327002M1303
承認・許可番号
承認番号
**22000AMX01511
商標名
TRANSAMIN CAPSULES
薬価基準収載年月
**2008年6月
販売開始年月
**2008年6月
貯法・使用期限等
貯法
室温保存
使用期限
包装に表示の使用期限内に使用すること。
基準名
日本薬局方
トラネキサム酸カプセル
組成
1カプセル中に次の成分を含有
有効成分
トラネキサム酸(日局) 250mg
添加物
トウモロコシデンプン、ステアリン酸マグネシウム
カプセル: ゼラチン、ラウリル硫酸ナトリウム、黄色5号
性状
剤形
カプセル(2号)
色
キャップ: だいだい色不透明
ボディー: 白色不透明
外形
全長 (mm)
17.8
重さ (mg)
348
識別コード
 605
販売名
トランサミン散50%
販売名コード
3327002B1027
承認・許可番号
承認番号
21400AMZ00141
商標名
TRANSAMIN POWDER
薬価基準収載年月
2002年7月
販売開始年月
2002年8月
貯法・使用期限等
貯法
室温保存
使用期限
包装に表示の使用期限内に使用すること。
組成
散1g中に次の成分を含有
有効成分
トラネキサム酸(日局) 500mg
添加物
D-マンニトール、ポリビニルアルコール(部分けん化物)
性状
剤形
散剤
色
白色
一般的名称
トラネキサム酸
禁忌
(次の患者には投与しないこと)
トロンビンを投与中の患者 (「相互作用」の項参照)
|
効能又は効果
効能又は効果/用法及び用量
○全身性線溶亢進が関与すると考えられる出血傾向
(白血病、再生不良性貧血、紫斑病等、及び手術中・術後の異常出血)
○局所線溶亢進が関与すると考えられる異常出血
(肺出血、鼻出血、性器出血、腎出血、前立腺手術中・術後の異常出血)
○下記疾患における紅斑・腫脹・そう痒等の症状
湿疹及びその類症、蕁麻疹、薬疹・中毒疹
○下記疾患における咽頭痛・発赤・充血・腫脹等の症状
扁桃炎、咽喉頭炎
○口内炎における口内痛及び口内粘膜アフター
トラネキサム酸として、通常成人1日750~2,000mgを3~4回に分割経口投与する。なお、年齢、症状により適宜増減する。
〈参考〉
剤形別用量は次のとおり
| 剤形 |
1日量(3~4回分割投与) |
| トランサミン錠250mg |
3~8錠 |
| トランサミン錠500mg |
2~4錠 |
| トランサミンカプセル250mg |
3~8カプセル |
| トランサミン散50% |
1.5~4g |
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
1.
血栓のある患者(脳血栓、心筋梗塞、血栓性静脈炎等)及び血栓症があらわれるおそれのある患者[血栓を安定化するおそれがある。]
2.
消費性凝固障害のある患者(ヘパリン等と併用すること)[血栓を安定化するおそれがある。]
3.
術後の臥床状態にある患者及び圧迫止血の処置を受けている患者[静脈血栓を生じやすい状態であり、本剤投与により血栓を安定化するおそれがある。離床、圧迫解除に伴い肺塞栓症を発症した例が報告されている。]
4.
腎不全のある患者[血中濃度が上昇することがある。]
5.
本剤の成分に対し過敏症の既往歴のある患者
相互作用
併用禁忌
(併用しないこと)
1.
薬剤名等
トロンビン
臨床症状・措置方法
血栓形成傾向があらわれるおそれがある。
機序・危険因子
血栓形成を促進する作用があり、併用により血栓形成傾向が増大する。
|
併用注意
(併用に注意すること)
1.
薬剤名等
ヘモコアグラーゼ
臨床症状・措置方法
大量併用により血栓形成傾向があらわれるおそれがある。
機序・危険因子
ヘモコアグラーゼによって形成されたフィブリン塊は、本剤の抗プラスミン作用によって比較的長く残存し閉塞状態を持続させるおそれがあると考えられている。
2.
薬剤名等
バトロキソビン
臨床症状・措置方法
血栓・塞栓症を起こすおそれがある。
機序・危険因子
バトロキソビンによって生成するdesAフィブリンポリマーの分解を阻害する。
3.
薬剤名等
凝固因子製剤
エプタコグアルファ等
臨床症状・措置方法
口腔等、線溶系活性が強い部位では凝固系がより亢進するおそれがある。
機序・危険因子
凝固因子製剤は凝固系を活性化させることにより止血作用を発現する。一方、本剤は線溶系を阻害することにより止血作用を発現する。
副作用
副作用等発現状況の概要
総症例数2,954例中報告された主な副作用は食欲不振0.61%(18件)、悪心0.41%(12件)、嘔吐0.20%(6件)、胸やけ0.17%(5件)、そう痒感0.07%(2件)、発疹0.07%(2件) 等であった。[文献集計による(再審査対象外)]
1. 過敏症
0.1%未満
そう痒感、発疹等
2. 消化器
0.1~1%未満
食欲不振、悪心、嘔吐、下痢、胸やけ
3. その他
0.1%未満
眠気
上記の副作用があらわれることがあるので、異常が認められた場合には必要に応じ投与を中止するなど適切な処置を行うこと。
高齢者への投与
一般に高齢者では生理機能が低下しているので減量するなど注意すること。
適用上の注意
薬剤交付時:
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
その他の注意
イヌに長期・大量投与したところ網膜変性があらわれたとの報告がある。
薬物動態
1.
血中濃度1)
健康成人に本剤を単回経口投与した場合、薬物動態パラメータは次のとおりであった。 (表1参照) トラネキサム酸単回経口投与時の血漿中濃度推移  2.
分布
参考(動物実験)
ラットに14C-トラネキサム酸を単回経口投与したところ、大部分の臓器において全血中濃度と同様に投与2時間後に最高濃度を示し、腎、肝では血中より高濃度に、他の臓器では血中より低濃度に分布した。
3.
代謝、排泄1)
健康成人にトラネキサム酸を250mg又は500mg単回経口投与した場合、トラネキサム酸は速やかに吸収され、投与後24時間以内に投与量の約40~70%が未変化体として尿中に排泄された。
表1 単回経口投与におけるトラネキサム酸の薬物動態パラメータ (n=5)
| 投与量 |
250mg (錠) |
500mg (錠) |
500mg (カプセル) |
| Tmax(hr) |
2~3 |
2~3 |
2~3 |
| Cmax(μg/mL) |
3.9 |
6.0 |
5.5 |
| t1/2 (hr) |
3.1 |
3.3 |
3.3 |
臨床成績
1.
抗出血作用
一般臨床試験では、全身性線溶亢進が関与すると考えられる白血病、再生不良性貧血、紫斑病等の出血傾向及び肺出血、性器出血、腎出血、手術中・術後等の異常出血に対する止血効果は2,802例中73.6%(2,063例)に認められている。
2.
抗アレルギー・抗炎症作用
(1)
皮膚疾患
皮膚疾患(湿疹及びその類症、蕁麻疹、薬疹・中毒疹等)の患者223例を対象にした一般臨床試験では、そう痒、腫脹、紅斑等の症状に対する効果は60.5%(135例)に認められている。
皮膚疾患(湿疹及びその類症、薬疹・中毒疹)の患者67例を対象に、そう痒、発赤、腫脹等の症状に対する効果を本剤(35例)とプラセボ(32例)との二重盲検比較試験により検討した結果、有効以上はプラセボ31.3%(10例)に対し本剤62.9%(22例)で、本剤が有意(p<0.05)に優れていた2)。
(2)
耳鼻咽喉科疾患
扁桃炎、咽喉頭炎、口内炎及び歯肉炎等の患者168例を対象にした一般臨床試験では、疼痛、腫脹及び発赤等に対する効果は70.8%(119例)に認められている。
耳鼻咽喉科疾患(急性咽喉頭炎、急性扁桃炎、口内炎等) の患者168例を対象に疼痛、腫脹及び発赤に対する効果を本剤(84例)とプラセボ(84例)との二重盲検比較試験により検討した結果、有効以上はプラセボ26.2%(22例)に対し本剤52.4%(44例)で、本剤が有意(p<0.05)に優れていた3)。
薬効薬理
線維素溶解現象(線溶現象)は生体の生理的ならびに病的状態において、フィブリン分解をはじめ、血管の透過性亢進等に関与し、プラスミンによって惹起される生体反応を含め、種々の出血症状やアレルギー等の発生進展や治癒と関連している。
トラネキサム酸は、このプラスミンの働きを阻止し、抗出血・抗アレルギー・抗炎症効果を示す。
(1)
抗プラスミン作用4~8)
トラネキサム酸は、プラスミンやプラスミノゲンのフィブリンアフィニティー部位であるリジン結合部位(LBS)と強く結合し、プラスミンやプラスミノゲンがフィブリンに結合するのを阻止する。このため、プラスミンによるフィブリン分解は強く抑制される。更に、α2-マクログロブリン等血漿中アンチプラスミンの存在下では、トラネキサム酸の抗線溶作用は一段と強化される。
(2)
止血作用4)
異常に亢進したプラスミンは、血小板の凝集阻止、凝固因子の分解等を起こすが、軽度の亢進でも、フィブリン分解がまず特異的に起こる。したがって一般の出血の場合、トラネキサム酸は、このフィブリン分解を阻害することによって止血すると考えられる。
(3)
抗アレルギー・抗炎症作用9~12)
トラネキサム酸は、血管透過性の亢進、アレルギーや炎症性病変の原因になっているキニンやその他の活性ペプタイド等のプラスミンによる産生を抑制する(モルモット、ラット)。
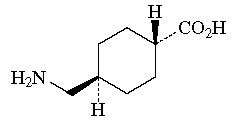
有効成分に関する理化学的知見
1.
一般名
トラネキサム酸(Tranexamic Acid)
2.
化学名
trans -4-(Aminomethyl) cyclohexanecarboxylic acid
3.
分子式
C8H15NO2
4.
分子量
157.21
5.
構造式
6.
*性状
白色の結晶又は結晶性の粉末である。水に溶けやすく、エタノール(99.5)にほとんど溶けない。
包装
トランサミン錠250mg (バラ) 500錠
(日本薬局方トラネキサム酸錠) (PTP) 100錠 500錠
トランサミン錠500mg (PTP) 100錠 500錠
(日本薬局方トラネキサム酸錠)
トランサミンカプセル250mg (バラ) 500cap.
(日本薬局方トラネキサム酸カプセル) (PTP) 100cap. 500cap. 2000cap.
トランサミン散50% (バラ) 100g 500g
(H.S.) 1g×1200
主要文献及び文献請求先
主要文献
1)
佐野光司ほか:臨床薬理 1976; 7(4):375-382
2)
宗像 醇:西日本皮膚科 1969; 31(2):141-146
3)
宮城 平:臨床と研究 1969; 46(1):243-245
4)
安孫子雍史:Medical pharmacy 1976; 10(1):7-11
5)
岩本政博:Thrombos. Diathes. Haemorrh. 1975; 33:573-585
6)
Markus G, et al.:J. Biol. Chem. 1979; 254:1211-1216
7)
安孫子雍史ほか:Biochim. Biophys. Acta. 1969; 185:424-431
8)
安孫子雍史ほか:Biochim. Biophys. Acta. 1970; 214:411-418
9)
山田外春ほか:プラスミン研究会報告集 1974; 14:364-366
10)
木村義民ほか:アレルギー 1966; 15(9):755-763
11)
近藤元治:プラスミン研究会報告集 1966; 6:36-37
12)
山崎英正ほか:日本薬理学雑誌 1967; 63(6):560-571
文献請求先・製品情報お問い合わせ先
*第一三共株式会社 製品情報部
〒103-8426 東京都中央区日本橋本町3-5-1
TEL: 0120-189-132
製造販売業者等の氏名又は名称及び住所
製造販売元
第一三共株式会社
東京都中央区日本橋本町3-5-1
|



 606
606 608
608
 605
605