美国FDA在今年1-6月份批准的新药稍作整理、汇总。列表内容包括商品名、通用名、研发公司、可能的作用机制、适应症以及美国FDA批准的日期。对每一种新药根据个人体会还作了一点简单介绍,如有不准确的地方欢迎批评指正。
美国FDA在2013年1-6月份批准的新药
|
商品名
|
通用名/曾用名
|
研发公司
|
作用机制
|
适应症
|
批准日期
|
|
Nesina
|
Alogliptin(阿格列汀)
|
武田制药
|
DPP4抑制剂
|
II型糖尿病
|
2013年1月25日
|
|
Kynamro
|
Mipomersen(米泊美生钠)
|
健赞/ISIS
|
反译RNA靶向B-阿朴脂蛋白
|
纯合家族高血脂症(HoFH)
|
2013年1月29日
|
|
Pomalyst
|
Pomalidomide(泊利度胺)
|
塞尔基因(Celgene)
|
免疫调节剂
|
多发性骨髓瘤
|
2013年2月8日
|
|
Kadecyla
|
Ado-trastuzumab emtansine (T-DM1)
|
Immunogen/罗氏
|
抗体药物偶联物(ADC)靶向人类表皮生长因子受体
|
HER-2阳性转移性乳腺癌
|
2013年2月22日
|
|
Osphena
|
Ospemifene
|
盐野义制药
|
雌激素激动剂或拮抗剂
|
因绝经而引起的性交疼痛
|
2013年2月26日
|
|
Lymphoseek
|
Technetium Tc-99m tilmanocept
|
Navidea生物制药公司
|
淋巴绘图造影剂
|
乳腺癌/黑色素瘤淋巴结定位
|
2013年3月13日
|
|
Dotarem
|
Gadoterate meglumine(钆特酸葡甲胺)
|
Guerbet公司
|
含钆MRI造影剂
|
脑部、脊柱及相关组织的核磁共振成像
|
2013年3月20日
|
|
Tecfidera
|
Dimethyl fumarate(富马酸二甲酯)
|
Biogen公司
|
核转录因子-kB(NF-kB)抑制剂
|
多发性硬化症
|
2013年3月27日
|
|
Invokana
|
canagliflozin
|
Janssen/强生
|
SGLT2抑制剂
|
II型糖尿病
|
2013年3月29日
|
|
Breo Ellipta
|
Fluticasone furoate+vilanterol trifenatate(糠酸氟替卡松+维兰特罗吸入性粉剂)
|
葛兰素史克
|
糖皮质激素+β2肾上腺素受体激动剂
|
慢性阻塞性肺病
|
2013年5月10日
|
|
Xofigo
|
Radium Ra-223 dichloride(二氯化镭)
|
拜耳公司
|
二氯化镭223
|
晚期前列腺癌
|
2013年5月15日
|
|
Tafinlar
|
Dabrafenib
|
葛兰素史克
|
BRAF抑制剂
|
BRAF突变的晚期黑色素瘤
|
2013年5月29日
|
|
Mekinist
|
Trametinib
|
葛兰素史克
|
MEK1/MEK2抑制剂
|
BRAF突变的晚期黑色素瘤
|
2013年5月29日
|
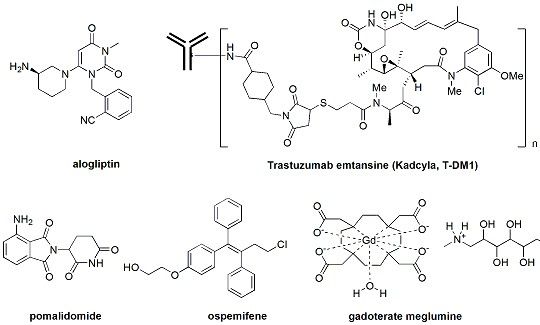
Nesina(通用名:Alogliptin,阿格列汀)
二肽基肽酶-4(Dipeptidyl Peptidase 4,DPP-4)是九十年代末至二十一世纪初最热门的靶点之一。选择性地抑制DPP-4,可以升高内源性胰高血糖素样肽-1(Glucagon-like Peptide-1,GLP-1)和葡萄糖依赖性促胰岛素释放多肽(Glucose-dependent Insulinotropic Peptide,GIP)的水平,从而达到降糖效果。虽然DPP4抑制剂在动物模型的疗效一般,但诺华首次把Vidagliptin推向临床,并显示较好疗效,立即引来无数跟随者。DPP4抑制剂可能是过去十年最受药厂青睐的me-too项目,至少有包括恒瑞的瑞格列汀在内的18个DPP4抑制剂获得药监部门的临床批件。 上市的DPP4抑制剂有Sitagliptin(2006,默克)、Vildagliptin(欧共体2007,诺华)、Saxagliptin(2009,Onglyza)、Linagliptin(2001,礼来和BI)、Anagliptin(日本2012,三和)、和Aligoliptin(2013,武田)。据说默克在2001年才开始DPP4项目,但后来居上并于2006首次在美国上市,堪称me-too药研发的典范。Sitagliptin在2012年的全球销售额高达57亿美元(含Janumet联合用药)。
Nesina 是阿格列汀的单方制剂,于2010 年4月获得日本卫生劳动福利部批准,2010 年6 月在日本上市。武田公司早在2007年就提请美国FDA 审批,但由于该药可能增加心脏和其他器官病变的风险而被否决。随后阿格列汀的申报一波三折终于在今年一月份被FDA放行。即使如此,FDA 还要求针对Nesina 开展包括心血管结局试验、肝脏异常监测、胰腺炎和超敏反应的风险等多项上市后研究把阿格列汀评为过去十年最不幸的新药之一,其崎岖的上市之路堪称电影“活着”。
Kynamro(通用名:Mipomersen,米泊美生钠)
Kynamro(通用名:Mipomersen)是继眼药Formivisen之后第二个上市的反义寡核苷酸,用于治疗一种罕见的纯合家族高血脂症(HoFH),作为降脂药物和饮食的辅助药物,以降低低密度脂蛋白胆固醇、载脂蛋白B、总胆固醇和低密度脂蛋白胆固醇。大多数包括酶抑制剂、受体激动剂或拮抗剂等小分子药物都是在蛋白水平调控生物通路。反译RNA是上个世纪末兴起的技术,针对一些不容易在蛋白水平调控的靶点,在其上游RNA水平调控生物途径。虽然这个技术理论上很吸引人,但实际上比如稳定性较差等困难很多,尤其是做成口服制剂非常难,选择性也不像原来预计的那么好。之前在1998年上市后又因患者太少而退市的只有治疗眼病的Formivisen。后来出现的siRNA更使反译RNA黯然无光,但二者现在都是更广泛地用于动物的靶标验证工作,其成药的难度远大于原来人们的想象。虽然Mipomerson批准的适应症很小,而且是注射剂,但这也是反译RNA甚至所有非蛋白水平药物的一个里程碑,为以后所谓nondruggable靶点的小分子药物开发提供一个另类选择。目前在三期临床的反义RNA项目还有Aganirsen(IRS1抑制剂,Gene Signal)、Belagenpumatucel-L(TGFB2抑制剂,NovaRx)、Drisapersen(DMD调节剂,葛兰素史克)、Custirsen(CLU抑制剂,OncoGenex)、Kappaproct(NFKB1抑制剂,InDex)、Trabedersen(TNFSF13抑制剂,Antisense Pharma)以及Alicaforsen(ICAM1抑制剂,Atlantic Healthcare)。
拒初步统计,从开始反义RNA技术平台的开发一直到mipomersen的上市,总共花了23年的时间和30亿美元的投资,这个数字看起来很大,实际上还远远小于开发单克隆抗体300亿美元的总投资,以及30年的时间。希望在不久的将来三代反义RNA将带来更大的商业成功。
Pomalyst(通用名:pomalidomide,泊利度胺)
Pomalyst(通用名:pomalidomide)由美国塞尔基因(Celgene)开发,是沙利度胺(thalidomide)的衍生物,通过调节T细胞并抑制其增值,发挥免疫调节作用。美国FDA在2013年2月8日批准Pomalyst作为孤儿药用于治疗之前至少接受两种药物治疗(包括来那度胺和硼替佐米)60天内无应答并有进展的多发性骨髓瘤(MM)。一项Ⅲ期头对头的临床研究显示,对于以上所述难治性多发性骨髓瘤患者,包括那些接受了高强度预治疗的患者,与大剂量地塞米松相比,免疫调节药物pomalidomide联合小剂量地塞米松可显著延长生存期。
Kadecyla(通用名:Ado-trastuzumab emtansine,T-DM1)
Kadecyla是美国FDA批准的,治疗固体肿瘤的第一个抗体药物偶联物(ADC)。根据2012年11月发表在新英格兰医学杂志上的EMILIA临床实验结果,kadcyla治疗组的客观应答率为43.6%,显著高于卡培他滨/拉帕替尼对照组的30.8%(P<0.001)。除此之外,kadcyla组的所有二级实验终点都优于对照组。而且,3-4级不良事件的发生率也由卡培他滨/拉帕替尼组的57%降至Kadcyla组的41%。相信在不久的将来,kadcyla将成为HER2阳性乳腺癌的一线标准疗法。Kadcyla由美国ImmunoGen制药公司研制,和罗氏属下的基因泰克公司联合开发。Kadcyla采用ImmunoGen的TAP专利技术把高活性的有丝分裂抑制剂DM1(一种美登素衍生物)用一个稳定的硫醚健接头连接到罗氏公司的曲拓珠单抗上。因为曲妥珠单抗对HER2有较高的亲和力,kadcyla能有效地靶向结合表达HER2的乳腺癌细胞,而后内化并释放细胞毒DM1。Kadcyla把抗乳腺癌药曲拓珠单抗和美登素衍生物DM1完美地结合到一起,充分利用了前者靶向、选择性强,后者活性高,而又消除了前者疗效低和后者副作用大等缺点。
Osphena(通用名:Ospemifene)
Osphena(通用名:Ospemifene)是到目前为止FDA唯一批准的口服或阴道外用雌激素代用品,用于治疗因绝经而引起的性交疼痛。Osphena是一种非甾体的,组织选择性的雌激素激动剂或拮抗剂,也就是说对一部分组织的受体起拮抗作用而又能激活另一些组织的雌激素受体。性交疼痛与绝经期雌激素水平下降有关。雌激素减少能够使阴道组织变薄、干燥和更加脆弱,导致性交时疼痛。美国FDA对Osphena疗效和安全性的评价主要基于三个,总计有1889名外阴和阴道萎缩的症状的绝经后妇女参加的临床实验:经过12周的治疗,使用Osphena不仅显著减轻绝经妇女的性交疼痛,而且明显改善了包括表皮细胞、副基底层细胞以及阴道的pH值等因绝经引起的阴道物理变化。盐野义制药公司在2010年从QuatRx制药公司收购了Osphena的全球销售权。
Lymphoseek注射液(通用名:Technetium Tc-99m tilmanocept)
Lymphoseek注射液(通用名:Technetium Tc-99m tilmanocept)是一种放射性诊断显影剂,用于患有乳腺癌或黑色素瘤且正在接受肿瘤引流区域淋巴结手术治疗患者的淋巴结定位。淋巴结过滤流向身体组织的淋巴液。淋巴液可能含癌细胞,尤其是引流区域的淋巴液含有肿瘤细胞的风险更高。通过手术清扫及探查引流肿瘤部位淋巴液的淋巴结,医生或可判断癌症是否扩散。Lymphoseek是继硫胶体(sulfur colloid)和异硫蓝(isosulfan blue)之后30多年来首个获准用于淋巴结定位的新药。在一项头对头比较Lymphoseek和硫胶体或异硫蓝的临床实验中,Lymphoseek在乳腺癌定位淋巴结及鉴定每位患者淋巴结数量等关键指标上,都具有明显优势。Lymphoseek由只有26年历史和四十余名员工的Navidea生物制药公司研发。该公司虽小,但是专注于医学成像和成像相关平台技术,Lymphoseek是FDA批准的该公司的第一个新药。
Dotarem(Gadoterate meglumine,钆特酸葡甲胺)
Dotarem是一种含钆造影剂,用于成人与大于2岁儿科患者的脑部(颅内)、脊柱及相关组织核磁共振成像,以检测和显现血脑屏障受破坏和(或)异常血管分布的区域。Dotarem注射液的有效成分钆特酸葡甲胺是一种顺磁分子,能在磁场中产生磁矩,提高邻近水质子的弛豫率,从而增加信号强度。Dotarem注射液是继Magnevist、Prohance、Omniscan、Optimark、Multihance、Gadavist之后美国FDA批准用于中枢神经系统的核磁共振成像的第7个含钆造影剂。
Tecfidera(通用名:富马酸二甲酯)
虽然确切的分子机制还不是很清楚,甚至很难想象这么简单的分子结构能起多大作用,但有证据表明Tecfidera能够抑制核转录因子-κB(NF-κB)的活性,激活体内已知的具有防止神经细胞损伤和出现炎症的Nrf2-ARE 抗氧化信号通道,抵抗活性氧对细胞的损害。在一项为期两年的安慰剂对照研究试验中,Tecfidera明显降低多发性硬化症复发患者的比例(49%),使年化复发率降低53%,使12周明确残疾进展减少38%。在今年3月27日,Tecfidera已被美国FDA批准,成为复发型多发性硬化症(MS)的一线口服治疗药物,也是超过100亿美元多发性硬化症医药市场诺华的芬戈莫德以及赛诺菲的特立氟胺的强劲竞争对手。
Invokana(通用名:canagliflozin)
强生旗下Janssen的Invokana(通用名:canagliflozin)是在美国批准的第一个钠葡萄糖协同转运蛋白2(SGLT2)抑制剂,用于治疗II型糖尿病。该药最初由日本三菱旗下的田边三菱制药(Mitsubishi Tanabe Pharma)研发,后转让给Janssen公司。与传统糖尿病治疗药物的补充和诱导胰岛素分泌、改善胰岛素抵抗、促进葡萄糖利用等机制不同,SGLT2抑制剂通过抑制葡萄糖在肾脏近曲小管的重吸收,从尿中排出体内多余的葡萄糖。结构上大部分SGLT2的抑制剂,包括去年11月在欧共体上市的Forxiga(通用名:dapagliflozin,百时美施贵宝/阿斯利康)和empagliflozin(BI/礼来),是糖类的C-芳基、O-芳基、S-糖苷以及N-糖苷的衍生物,因为良好的血糖控制和减肥效果导致SGLT2抑制剂处于研发热点。尽管如此,很多内分泌学家对SGLT2抑制剂的广泛使用还持保留态度,在更多的数据证明其药效和安全性之前,该类药物在很大程度上只能是继胰岛素、DPP4抑制剂等之后充当三线糖尿病用药。SGLT2抑制剂的优势和缺点并存,进一步的临床研究以衡量这类药物的减肥、降血压等优势,相比增加外阴和尿道感染、脱水、高钾血症以及轻微的致癌等风险是SGLT2抑制剂商业成功的关键。Invokana在2013年的销售额估计7千万美元,至2018年达到其8亿美元的销售峰值。
Breo Ellipta(通用名:fluticasone furoate/vilanterol triflenatate,糠酸氟替卡松/维兰特罗吸入性粉剂)
今年5月10日,美国FDA 审批通过葛兰素史克的慢性阻塞性肺病药物Breo Ellipta。该药物为糠酸氟替卡松和维兰特罗的吸入型复方药物粉末,可每日吸入一次。Breo Ellipta中的糠酸氟替卡松是一种吸入型糖皮质激素,维兰特罗是一种长效β2肾上腺素受体激动剂。该药物的安全性和有效性通过一项7700名慢性阻塞性肺病患者参与的临床试验进行了评价。用药组患者相比安慰剂组患者其肺部功能得到了改善,疾病发作次数减少。Breo Ellipta在获批时其标签内容中有一项黑框警告,提示长效β2肾上腺素受体激动剂能增加哮喘有关的死亡风险。Breo Ellipta用药患者报道的最常见副作用有鼻腔炎症(鼻咽炎)、上呼吸道感染、头痛及口腔念珠菌病(鹅口疮)。
Xofigo(Radium Ra-223 dichloride,二氯化镭)
Xofigo的有效成分是二氯化镭223(镭223),可发射α粒子,对骨转移癌症具有抗癌作用。今年5月15日,美国FDA通过优先评审通道批准了拜耳公司的Xofigo(二氯化镭)注射剂,用于治疗晚期前列腺癌。批准Xofigo是依据对809名已扩散到骨头但未扩散到其他器官的男性雄激素抵抗性前列腺癌患者进行的一个单一临床试验。接受Xofigo治疗的男性患者的中位生存期为14个月,相比安慰剂治疗组延长了3个月。
Tafinlar(通用名:Dabrafenib)和Mekinist(通用名:Trametinib)
葛兰素史克的Tafinlar(Dabrafenib)和Mekinist(Trametinib)在今年5月29日同时得到美国FDA的批准,用于治疗转移性或不能行手术治疗的黑色素瘤病人。尽管Tafinlar和Mekinist都是治疗黑色素瘤的新药,且都适用于治疗瘤组织内BRAF V600E基因突变的患者,但作用机理却稍有区别。Dabrafenib为BRAF抑制剂,和首个上市的BRAF抑制剂威罗菲尼(Zelboraf,罗氏公司)同属于一类药物。而Mekinist是细胞外信号调节激酶(MEK)抑制剂,能同时可逆地抑制MEK1和MEK2,调节MAPK/ERK信号通路。单药使用时,Trametinib能使BRAF变异的晚期黑色素瘤患者的无进展生存期和标准疗法相比延长55%。当上述两种皮肤癌药物联合使用时,无进展生存期的中位数能从dabrafenib单独用药的5.8个月延长至9.4个月。尤其令人惊讶的是,这两个药联合使用时还能降低单独用药时的副作用。十几年以来MEK抑制剂的开发进展缓慢,选择性、生物利用度以及毒副作用一直是开发MEK抑制剂的主要障碍。Trametinib的上市是葛兰素史克药物化学家十几年努力的回报,也是MEK抑制剂终于走向临床的开始,尤其是和其它MAPK信号通路内部或外部抗肿瘤制剂的联合用药更具市场开发潜力。
部分上市新药的化学结构
|





