|
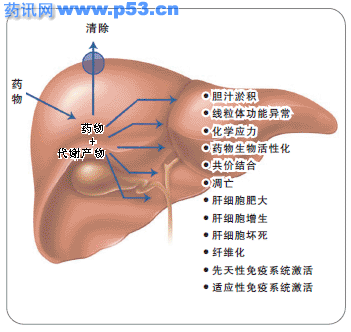
药物性肝损伤(DILI)是药物所致不良反应的严重后果之一,因而备受临床医师、患者、政府管理部门和制药公司的关注。DILI可造成研究药物的不获批准,也可导致上市后加警告(黑框警示),甚至撤市。目前批准上市的药物,由于经过严格的临床前和临床试验,绝大多数是安全的,仅有少数可能产生DILI,这种情况一般称为特异质反应。下面就药物临床试验中肝损伤的相关问题向读者作一介绍。 1 药物试验的终止 停药的依据 丙氨酸氨基转移酶(ALT)是检测肝细胞损伤的特异性指标。药物应用于临床后,ALT水平是评估有无肝损伤和是否停药的重要标志。值得注意的是,血清ALT水平具有易变性,即使对正常人,其ALT水平在一天或几天内也有不同程度的波动。在肝病患者中,1~2次测定结果也不能反映其ALT水平的峰值。故应在短期内多次检测,以界定变异范围。 ALT升高幅度通常采用超过正常值上限(ULN)的倍数来表示,通常可反应肝损伤的程度,但也有例外。在曲格列酮治疗2型糖尿病的临床试验中, ALT水平>3×ULN和>20×ULN者分别为3%和0.2%,在2502例受试者中,仅有2例发生严重肝细胞损伤伴黄疸。然而该药上市后,有65例服用该药的患者死于DILI,8例经肝移植后恢复,该药目前已被撤出市场。 受试者的个体差异 一些患者在用药后可出现ALT升高,如继续用药,ALT又可自行恢复,这种现象被称为适应性。这表明,人群对药物的不良反应并非一致,据此可将人群分为:耐受者、适应者和易感者。用药后发生DILI的个体,多属易感者。 如何看待“正常参考值” 所谓“正常参考值”是根据某一地区或医疗机构对正常或健康人群进行测定,而得出的数据。实际上,在所谓“正常”人群中,常混杂着一些隐匿性肝病患者,如非酒精性脂肪性肝病、非活动性丙型肝炎病毒(HCV)或乙型肝炎病毒(HBV)感染者。此外,应用不同厂商的自动生化仪进行检测,如不作严格的校正,也常会出现偏倚。 因此,目前采用的“正常参考值”可能高于实际的、真正的正常值水平。但是,如将正常参考值水平调低,固然可提高灵敏度,但特异性又会降低。 肝损伤严重程度的评估 一种方法是,将DILI的严重程度分为6级。0级:无不良反应,为耐受者;1级:仅转氨酶升高,大多数适应;2级:检测到肝细胞功能轻度丧失;3级:病情严重,需入院治疗;4级:急性肝衰竭;5级:死亡。 另一种评估方法是依据Hy’s法则。在上世纪60年代,齐默尔曼(Zimmerman)提出,药物诱发肝细胞性黄疸为严重不良事件,患者死亡率≥10%。如为药物所致的肝细胞损伤,黄疸加上转氨酶升高,为严重肝病的标志。以后将此定义称为Hy’s法则,指总胆红素>3 mg/dl,ALT>3×ULN,被认为是严重肝损伤的一种标志。 当应用Hy’s法则时,应注意以下几点:① 黄疸必须是肝细胞性的,而不是淤胆性的;② 须排除急性病毒性肝炎或其他肝病;③ 要有该药物可造成轻度肝损伤的证据。 除了胆红素和ALT水平升高之外,凝血酶时间或国际标准化比值(INR)以及血清白蛋白水平也可作为评估肝损伤严重程度的指标。 2 DILI的生物学标志物 目前确定DILI的生物学标志物主要为血清ALT和总胆红素水平。可靠的DILI生物学标志物应满足以下条件:① 在目标人群中,可预测某种药物是否具有严重、轻度肝毒性或无肝毒性;② 能鉴别用药过程中发生DILI的易感者、适应者或耐受者。一旦怀疑某种药物可能导致DILI,即可采用此类生物学标志物,在样本较少、时间较短的情况下发现易感者。目前认为,对DILI的易感至少部分程度上与遗传因素有关。
3 关于再激发试验 再激发试验是指,患者出现不良反应停药并完全恢复后,审慎地再度给予相同的药物,观察是否再度出现类似的不良反应。 再激发试验要考虑其必要性、合理性、收益及风险。通常来说是不符合伦理的,因为当患者再次暴露于可疑药物时,可能发生更严重的不良反应。有时是由于治疗上疏忽,患者在停药且不良反应消失后,再度用药,从而导致再激发。 再激发试验可能出现阳性结果,也可能出现阴性结果。对于前者,可明确不良反应系该药所致,但如为阴性结果,其解释可能较为复杂。例如,实施他克林和异烟肼再激发时,不一定出现ALT异常。 葛兰素史克(GSK) 公司对收集的临床试验和上市后监测报告的数据分析认为,再激发试验后发生的肝损伤不良事件比激发前的首次反应更严重。 大多数制药公司不主张在临床试验中实施再激发试验。除非确实对患者有益,而且没有可替代的治疗,经相关的学术委员会讨论后,方可实施。 4 肝病患者能否被纳入临床试验 在临床试验的研究对象中,是否可以有肝病患者,一直存在争议。一般来说,由于肝脏是药物代谢的重要器官,将肝病患者纳入临床试验可能导致研究结果混乱。另一方面,肝病患者较健康人群更易发生DILI。 资料显示,慢性HBV感染合并HCV或人免疫缺陷病毒(HIV)感染者,当应用抗HIV反转录酶药物时,更易发生DILI,此外,还可使原有疾病加重。当慢性乙肝患者应用免疫抑制剂或糖皮质激素时,当自身免疫性肝炎患者应用干扰素时,当脂肪肝患者应用他莫昔芬或甲氨蝶呤时,均可使原有疾病加重。 因此,通常认为,肝病患者不宜被纳入临床试验。但在肝病患者伴有其他疾病需要治疗时,是否可以应用已上市的药物,尚无明确限制,但要注意适应证的把握,且治疗过程中要密切监测DILI的发生。 |
|
当前位置:药品说明书与价格首页 >> 用药警示 >> 药物临床试验中的肝损伤
药物临床试验中的肝损伤简介:
药物性肝损伤(DILI)是药物所致不良反应的严重后果之一,因而备受临床医师、患者、政府管理部门和制药公司的关注。DILI可造成研究药物的不获批准,也可导致上市后加警告(黑框警示),甚至撤市。目前 ... 关键字:药物临床试验中的肝损伤
责任编辑:admin |
最新文章更多
推荐文章更多
热点文章更多 |