| 美国迈阿密大学糖尿病研究所所长、胰岛移植中心外科专家里科尔迪(Ricordi)教授,因设计发明自动分离胰岛细胞的整套设备而著名。Ricordi教授在2008年欧洲糖尿病研究学会(EASD)年会上作了开幕式演讲,现简介如下。 跨越半个世纪的探索 胰岛移植的历史 ● 上世纪50年代末已有关于胰岛移植的报告,但多限于动物试验。 ● 上世纪70年代中期到80年代初,胰岛移植应用于1型糖尿病的临床治疗(图1)。 ● 2002年,沙皮罗(Shapiro)等报告了埃德蒙顿(Edmonton)胰岛移植方案。该移植方案不使用类固醇,而是应用西罗莫司、他克莫司和达利珠单抗作为免疫抑制剂。该方案的问世为胰岛移植奠定了基础。在此基础上,一些胰岛移植改良方案相继出台。 ● 2005年,加拿大埃德蒙顿市、美国迈阿密和明尼苏达州三地共有118例糖尿病患者接受了胰岛细胞移植。随访1年,82%的患者不依赖外源胰岛素。 ● 截至2007年,全球50多家医疗机构实施了逾700例胰岛细胞移植。 安全性引发争议 胰岛移植的不足 胰岛移植虽然给1型糖尿病治疗带来了希望,但也存在不足之处,例如Edmonton方案可能导致高血压、高胆固醇血症和蛋白尿等,并且免疫抑制剂可能具有一定的神经毒性和肾毒性。 2006年,Shapiro等发表在《新英格兰医学杂志》上的一项研究在胰岛移植领域引起了不小的波澜。该研究对36例1型糖尿病患者应用Edmonton方案进行胰岛细胞移植后,16例达到一级终点。10例患者在移植1年后,移植胰岛细胞完全丧失功能。36例患者中,仅有5例在移植后2年不依赖外源胰岛素。 2008年,拉格伦提(Ruggenenti)等在《柳叶刀》杂志上发表文章认为,鉴于胰岛细胞移植的安全性等问题,摒弃这种治疗方法可能更符合患者利益。 亟待解决的问题 胰岛移植免疫抑制剂的选择 针对Ruggenenti的观点,Ricordi教授提出,制定胰岛细胞移植决策的关键应该是由“谁”来执行移植,研究者不应低估胰岛移植和免疫学的复杂性。胰岛移植需要解决的主要问题是免疫抑制剂的毒性及并发症,其次是同种致敏反应。 近年来,免疫抑制剂有了长足进展。上世纪50年代,免疫抑制剂主要是糖皮质激素和环磷酰胺。80年代,西罗莫司和他克莫司成为免疫抑制剂的主流。90年代以后,白细胞介素2受体抗体等更多的免疫抑制剂问世。 哺乳类动物西罗莫司靶蛋白(mTOR)激酶是调节某些细胞功能(例如细胞生长和分化)的关键因子,可导致成纤维细胞、平滑肌细胞和内皮细胞增生。最近研究表明,西罗莫司和他克莫司等mTOR抑制剂在抑制排斥反应的同时,对胰岛细胞功能也有一定的损害作用,可能会损害移植β细胞再生。一些专家提出,可以采用其他类型的免疫抑制剂来代替具有mTOR抑制作用的药物。 1999年,一项研究将抗白细胞分化抗原154(CD154)抗体应用于胰岛移植,取得了较好的效果。此外,单克隆抗体抗CD40、抗淋巴细胞功能相关抗原1(LFA-1)和LFA-3等也被用于预防胰岛移植后的排斥反应。 近来,环孢素、吗替麦考酚酯和FTY720(一种新型免疫抑制剂)等代替他克莫司,被应用于胰岛移植。抗胸腺细胞球蛋白(ATG)、肿瘤坏死因子阻滞剂如依他西普特(etanercept)等也逐渐被应用于胰岛移植。Ricordi教授建议,胰岛细胞移植治疗时,免疫抑制剂应首选ATG。 一项关于胰岛移植对肾脏影响的研究发现,接受胰岛移植后患者的肾功能保持稳定,合并微量白蛋白尿的患者在胰岛移植后可出现短暂的蛋白尿。该研究提示,虽然有胰岛移植肾毒性的个案报道,但这并不是阻止胰岛移植开展的主要原因。 联合应用免疫抑制剂可更好地保护移植胰岛细胞生存。EP1013(一种新制剂)联合细胞毒T淋巴细胞相关抗原4 (CTLA-4)可以阻止同种过敏反应,显著改善移植胰岛细胞生存。 前景光明 道路不平 胰岛移植的未来 Ricordi 等人完成的一项研究将人胚胎干细胞培养分化为胰腺内皮细胞植入小鼠体内,在活体经过3个月成熟后成为分泌胰岛素的细胞。这项研究给异种移植开创了新的途径。此外,人体胰腺外分泌细胞、肝细胞和胚胎干细胞等也可以转化为β细胞,分泌胰岛素。 采用纳米技术和胶囊包裹胰岛细胞的移植方法,可减少免疫抑制剂带来的不良反应。目前,一些学者已经开始应用微囊包裹胰岛细胞的移植方法来避免同种过敏反应的发生(图2)。 总之,胰岛移植的前景是广阔的,但通往光明的道路是崎岖的。完善胰岛移植并使之更具临床价值,仍需要长时间的临床研究。
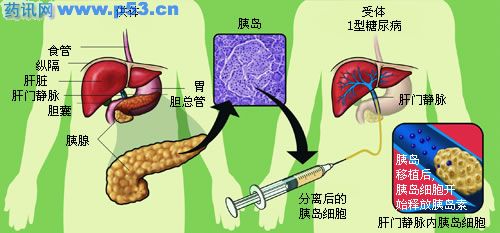
图1 胰岛移植示意图
图2 微囊包裹胰岛移植细胞 |