| 口服抗凝血药Lixiana®在日本上市 4月22日,日本厚生省批准了第一三共的Lixiana®(甲苯磺酸依度沙班水合物) 15 mg和30 mg用于预防骨科大手术后静脉血栓栓塞,这是Lixiana®获得的首个上市许可。
Lixiana®系每日1次的口服抗凝血药,其活性成分依度沙班(Edoxaban)能直接抑制凝血因子Xa,临床结果显示,Lixiana®对全膝关节置换术、全髋关节置换术和髋骨折手术患者有良好的治疗益处。
2010年3月,第一三共递交了Lixiana®用于静脉血栓栓塞适应症的上市申请,12月,公司公开了最新III期临床试验(Stars J-V)的正面结果,发现依度沙班能预防全髋关节置换术后静脉血栓栓塞事件,且有效性优于依诺肝素。
依度沙班还在进行多个全球临床试验,适应症有预防房颤患者中风,以及预防和治疗静脉血栓栓塞复发。正在进行的III期AF-TMI试验,共入组21,000例患者,评估依度沙班对房颤患者预防中风和全身性栓塞事件的作用。正在进行的VTE试验,共入组7,500例患者,评估依度沙班对复方静脉血栓栓塞的预防和治疗作用。

 |
Information is based on approvals granted in Japan. In some cases, the approved details may vary in countries other than Japan.
In deciding to use a medicine, the risk (side effects) of taking the medicine must be weighed against the benefit (effects) it will do. The patient's cooperation is indispensable here.
Brand name : LIXIANA TABLETS 30 mg
Active ingredient: Edoxaban tosilate hydrate
Dosage form: slightly red tablet, φ: 8.6 mm, thickness: 3.8 mm
Printings on wrapping: 甲苯磺酸依度沙班片 30mg DSC472 LIXIANA 30mg
Effects of this medicine
This medicine suppresses coagulation by inhibiting active blood coagulation factor X in the process of coagulation. After surgery, coagulation tends to occur because of hemostatic action, and with vascular injury and bedrest, blood is more likely to come coagulated. Especially, when blood clots (thrombi) are formulated on the leg and move through vessels to lung, they may become stuck in the lung vessels. The medicine suppresses thrombus formation.
It is used for suppression of venous thrombosis in patients who underwent surgery for total knee replacement, total hip replacement or hip fracture.
Before using this medicine, tell your doctor/pharmacist
•If you ever experienced any allergic reaction (itch, rash etc.) to any medicine.
If you are patients with bleeding (intracranial hemorrhage, retroperitoneal hemorrhage or other hemorrhage from vital organs, etc.).
If you have a bleeding tendency or difficulty in stopping bleeding.
If you are a patient with acute bacterial endocarditis or peptic ulcer.
If you recently have intracranial hemorrhage, eye surgery or cerebrospinal surgery.
If you are a patient with renal or hepatic dysfunction.
If your weight is less than 40 kg.
•If you are pregnant or breastfeeding.
•If you are using any other prescription or nonprescription (OTC) medicine. (It is important to reduce the risk of drug interactions.)
Dosage regimen (proper use of this medicine)
•Your dosage regimen is:(order of your doctor)
•General dosage regimen: For adults, take 1 tablet (30 mg of edoxaban) at a time, once daily. Strictly follow the instructions of your doctor/pharmacist.
•Missed dose: Take a dose as soon as possible. However, if it is almost time for the next dose, skip the missed dose and continue your regular dosing schedule. DO NOT take double doses to make up for the missed dose.
•Overdose: If you took too much of the medicine (more than ordered), check with your doctor/pharmacist.
•Others: Do not stop taking the medicine without the instructions of your doctor.
Precautions while using this medicine
•Side effects of this medicine
Common side effects are reported as below. If any of them occurs, check with your doctor/pharmacist: anemia, hematuria, subcutaneous bleeding, wound bleeding, nasal bleeding, rash, etc.
In rare cases, symptoms described below may be the sign of side effects indicated in brackets [ ]. If they occur, stop taking your medicine and check with your doctor immediately.
•subcutaneous bleeding, nasal bleeding, gum bleeding, black stool, melena, hematuria[bleeding]
Other side effects not listed here may occur. Check with your doctor/pharmacist if you have any worrisome symptom.
Storage and other information
•Keep out of the reach of children. Store away from direct sunlight, heat and moisture.
•Discard the remainder. Do not store them.
リクシアナ錠15mg/リクシアナ錠30mg
商標名
LIXIANA TABLETS
組成
1錠中に次の成分を含有
有効成分
エドキサバントシル酸塩水和物 40.4mg
(エドキサバンとして30mg)
添加物
D-マンニトール、部分アルファー化デンプン、クロスポビドン、ヒドロキシプロピルセルロース、ステアリン酸マグネシウム、ヒプロメロース、酸化チタン、タルク、マクロゴール6000、三二酸化鉄、カルナウバロウ
性状
剤形
フィルムコーティング錠(割線入)
一般的名称
エドキサバントシル酸塩水和物錠
|
警告
脊椎・硬膜外麻酔あるいは腰椎穿刺等との併用により、穿刺部位に血腫が生じ、神経の圧迫による麻痺があらわれるおそれがある。併用する場合には神経障害の徴候及び症状について十分注意し、異常が認められた場合には直ちに適切な処置を行うこと(「用法及び用量に関連する使用上の注意」の項参照) |
|
禁忌
(次の患者には投与しないこと)
1. 本剤の成分に対し過敏症の既往歴のある患者
2. 出血している患者(頭蓋内出血、後腹膜出血又は他の重要器官における出血等)[出血を助長するおそれがある。]
3. 高度の腎機能障害(クレアチニンクリアランス30mL/min未満)のある患者[使用経験が少ない。また、静脈血栓塞栓症発症抑制効果を上回る出血のリスクを生じるおそれがある。]
4. 急性細菌性心内膜炎の患者[血栓剥離に伴う血栓塞栓様症状を呈するおそれがある。] |
効能又は効果
効能又は効果/用法及び用量
下記の下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制 膝関節全置換術、股関節全置換術、股関節骨折手術
通常、成人には、エドキサバンとして30mgを1日1回経口投与する。
用法及び用量に関連する使用上の注意
1.
原則として、術後の入院中に限って使用すること。
2.
本剤の投与期間については、患者個々の静脈血栓塞栓症及び出血のリスクを考慮して決定すべきであり、静脈血栓塞栓症のリスク低下後に漫然と継続投与しないこと。なお、国内臨床試験において、下肢整形外科手術施行患者を対象として15日間以上投与した場合の有効性及び安全性は検討されていない。
3.
本剤の初回投与は、手術後12時間を経過し、手術創等からの出血がないことを確認してから行うこと。
4.
本剤の初回投与は、硬膜外カテーテル抜去あるいは腰椎穿刺から少なくとも2時間を経過してから行うこと。また、初回投与以降にこれらの処置を行う場合には、前回投与から12時間以上の十分な時間をあけ、かつ、予定している次回の投与の少なくとも2時間以上前に実施すること。
5.
腎機能障害のある患者では本剤の血中濃度が上昇し、出血の危険性が増大するおそれがあるので、中等度の腎機能障害(クレアチニンクリアランス30mL/min以上50mL/min未満)のある患者では、個々の患者の静脈血栓塞栓症発現リスク及び出血リスクを評価した上で、15mg1日1回に減量することを考慮すること(「慎重投与」、「薬物動態」及び「臨床成績」の項参照)。
6.
プロトロンビン時間-国際標準比(PT-INR)や活性化部分トロンボプラスチン時間(APTT)等の通常の凝固能検査は、本剤の薬効をモニタリングする指標とはならないので、臨床症状を十分に観察し、出血等がみられた場合には投与を中止するなど適切な処置を行うこと。
使用上の注意
慎重投与(次の患者には慎重に投与すること)
1.
出血する可能性が高い患者(出血傾向のある患者、消化管潰瘍の患者、頭蓋内出血後又は脳脊髄や眼の手術後日の浅い患者等)[出血を生じるおそれがある。]
2.
高度の肝機能障害のある患者[凝固因子の産生が低下していることがあるので、出血の危険性が増大するおそれがある。]
3.
腎機能障害のある患者[本剤は腎臓を介して排泄されるので、血中濃度が上昇し、出血の危険性が増大するおそれがある(「用法及び用量に関連する使用上の注意」及び「薬物動態」の項参照)。]
4.
高齢者(「高齢者への投与」の項参照)
5.
体重40kg未満の患者[国内臨床試験において使用経験がない。低体重の患者では出血の危険性が増大するおそれがある。]
重要な基本的注意
1.
本剤の使用にあたっては、観察を十分に行い、出血又は出血の増悪がみられた場合には投与を中止すること(「副作用」の項参照)。
2.
出血等の副作用を生じることがあるので、必要に応じて血算(ヘモグロビン値及び血小板数)及び便潜血検査等の臨床検査を実施することが望ましい(「副作用」の項参照)。
相互作用
併用注意
(併用に注意すること)
1.
薬剤名等
抗凝固剤
ヘパリンナトリウム、ワルファリンカリウム、エノキサパリンナトリウム、フォンダパリヌクスナトリウム等
臨床症状・措置方法
これらの薬剤との併用により、出血の危険性を増大させるおそれがある。併用する場合には、患者の状態を十分に観察するなど注意すること。
機序・危険因子
相互に抗血栓作用を増強することが考えられる。
2.
薬剤名等
血小板凝集抑制作用を有する薬剤
アスピリン、ジピリダモール、チクロピジン塩酸塩、クロピドグレル硫酸塩、非ステロイド性消炎鎮痛剤等
臨床症状・措置方法
これらの薬剤との併用により、出血の危険性を増大させるおそれがある。併用する場合には、患者の状態を十分に観察するなど注意すること。
機序・危険因子
相互に抗血栓作用を増強することが考えられる。
3.
薬剤名等
血栓溶解剤
ウロキナーゼ、t-PA製剤等
臨床症状・措置方法
これらの薬剤との併用により、出血の危険性を増大させるおそれがある。併用する場合には、患者の状態を十分に観察するなど注意すること。
機序・危険因子
相互に抗血栓作用を増強することが考えられる。
4.
薬剤名等
P糖蛋白阻害作用を有する薬剤
キニジン硫酸塩水和物、ベラパミル塩酸塩、アミオダロン塩酸塩、エリスロマイシン、イトラコナゾール等
臨床症状・措置方法
本剤の血中濃度を上昇させ、出血の危険性を増大させるおそれがある。併用する場合には、本剤15mg1日1回に減量することを考慮すること。
機序・危険因子
消化管のP糖蛋白を阻害することにより、本剤のバイオアベイラビリティを上昇させると考えられる。
副作用
副作用等発現状況の概要
国内、並びに国内及び台湾で実施した第III相試験において、総症例716例(国内685例、台湾31例)中、278例(38.8%)に副作用(臨床検査値異常を含む)が認められた。主な副作用は、出血(尿中血陽性35例、皮下出血35例、創傷出血20例等)120例(16.8%)、γ-GTP上昇71例(9.9%)、ALT(GPT)上昇46例(6.4%)等であった(承認時)。
重大な副作用
出血:
2g/dLを超えるヘモグロビン量の低下を伴う創傷出血等の出血(1.1%)を生じることがあり、また、頭蓋内出血、後腹膜出血を生じるおそれがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
その他の副作用
1. 血液
1~10%未満
貧血、血小板数増加
2. 血液
1%未満
好酸球増多
3. 出血傾向
1~10%未満
血尿(尿中血陽性等)、皮下出血、創傷出血、鼻出血
4. 出血傾向
1%未満
関節内血腫
5. 肝臓
1~10%未満
γ-GTP上昇、ALT(GPT)上昇、AST(GOT)上昇、ALP上昇、ビリルビン上昇
6. 肝臓
1%未満
LDH上昇
7. 精神神経系
1%未満
頭痛
8. 消化器
1%未満
下痢
9. 過敏症
1~10%未満
発疹
10. 過敏症
1%未満
そう痒
11. その他
1%未満
トリグリセリド上昇、浮腫、尿酸上昇、発熱
上記の副作用があらわれることがあるので、異常が認められた場合には必要に応じ投与を中止するなど適切な処置を行うこと。
高齢者への投与
一般的に高齢者では生理機能が低下しているので、患者の状態を観察しながら慎重に投与すること。
妊婦、産婦、授乳婦等への投与
1.
妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[妊娠中の投与に関する安全性は確立していない。動物実験(ラット)で胎児への移行が報告されている。]
2.
授乳中の婦人には本剤投与中は授乳を避けさせること。[動物実験(ラット)で乳汁中に移行することが報告されている。]
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない(使用経験がない)。
過量投与
症状:
本剤を過量投与した場合、出血性の合併症を引き起こすおそれがある。
処置:
本剤の抗凝固作用を選択的に中和する薬剤は知られていない。出血が認められた場合には、適切な処置を行うこと。症状に応じて、外科的止血、新鮮凍結血漿輸注、血漿交換等の適切な治療の開始を検討すること。
適用上の注意
薬剤交付時:
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
薬物動態
1. 血漿中濃度1, 2)
(1) 単回投与
健康成人男性にエドキサバン30mgを空腹時単回経口投与したときの血漿中濃度推移及び薬物動態パラメータは以下のとおりであった。また、食後に投与したときCmaxは13%上昇したが、AUCに影響は認められなかった。
(2) 反復投与
健康成人男性9例にエドキサバン120mgを8日間反復経口投与したとき、蓄積性は認められなかった。
2. 血漿蛋白結合率(外国人データ)
健康成人男性18例にエドキサバン90mg及び120mgを単回経口投与したとき、投与2、6、及び12時間後のex vivo 血漿蛋白結合率は40.0~58.9%であった。
3. 代謝・排泄
健康成人男性45例にエドキサバン30~150mgを単回経口投与したとき、投与後48時間までのエドキサバンの尿中排泄率は、投与量に対し32.9~35.0%であった。
健康成人男性6例にエドキサバン60mgを単回経口投与したマスバランス試験において、投与後168時間までに投与された放射能の35.4%及び62.2%が、それぞれ尿中及び糞中へ排泄され、その大部分(それぞれ23.8%、53.4%)はエドキサバンであった。(外国人データ)
4. 腎機能障害患者における薬物動態(外国人データ)3)
腎機能障害患者24例にエドキサバン15mgを単回経口投与したとき、クレアチニンクリアランス(CLCR)の低下に伴いt1/2の遅延とAUC0-infの上昇が認められた。
(表2 参照)
5. 肝機能障害患者における薬物動態(外国人データ)4)
軽度及び中等度の肝機能障害患者16例にエドキサバン15mgを単回経口投与したとき、健康成人と比較し薬物動態に大きな差異は認められなかった。
6. 高齢者における薬物動態(外国人データ)
健康高齢男性(平均年齢70歳)9例にエドキサバン90mgを1日1回8日間反復経口投与したとき、健康成人男性と比較しAUCtauは28%高値を示した。
7. 薬物相互作用
エドキサバンは臨床用量で想定される血漿中濃度で主要なヒトCYP分子種を阻害あるいは誘導しなかった。エドキサバンはP糖蛋白(P-gp)の基質であることが示唆された。(in vitro 試験データ)
(1)
エドキサバン60mgとP-gp基質のジゴキシン0.25mgを併用したとき、ジゴキシン及びエドキサバンの薬物動態への影響はわずかであった。
(2)
P-gp阻害作用を有する薬剤であるケトコナゾール、キニジン、ベラパミル又はエリスロマイシンを併用したとき、エドキサバンのCmax及びAUCは約1.5~2倍に上昇した。(外国人データ)
(3)
アスピリン(100mg/日あるいは325mg/日)を併用したとき、単独投与時に比べて出血時間が1.3~1.6倍に延長した。(外国人データ)
注)本剤の承認用量は30mgである。
表1 単回経口投与時のエドキサバンの薬物動態パラメータ(空腹時)
| 投与量 |
n |
Cmax
(ng/mL) |
Tmaxa)
(h) |
t1/2
(h) |
AUC0-24h
(ng・h/mL) |
| 30mg |
34 |
218.9
(34.1) |
1.0
(0.5~3.0) |
4.9
(19.2) |
1187.0
(21.7) |
幾何平均値(幾何CV%)、a:中央値(最小値~最大値)
表2 腎機能障害患者に15mgを単回経口投与したときの薬物動態パラメータ
| パラメータ |
腎機能障害程度(CLCR:mL/min)
CLCR>80 |
腎機能障害程度(CLCR:mL/min)
80≧CLCR≧50
(軽度) |
腎機能障害程度(CLCR:mL/min)
50>CLCR≧30
(中等度) |
腎機能障害程度(CLCR:mL/min)
30>CLCR
(高度) |
Cmax
(ng/mL) |
81.2
(31.7) |
104
(46.7) |
108
(38.5) |
87.4
(34.1) |
C24h
(ng/mL) |
2.34
(28.1) |
3.44
(62.5) |
5.90
(38.4) |
6.88
(36.2) |
AUC0-inf
(ng・h/mL) |
443
(22.3) |
620
(24.5) |
794
(25.6) |
835
(25.1) |
t1/2a)
(h) |
8.60
(3.83) |
8.15
(2.82) |
9.44
(2.12) |
16.9
(10.4) |
CL/F
(mL/min) |
564
(22.3) |
403
(24.5) |
315
(25.6) |
299
(25.1) |
CLr
(mL/min) |
197
(16.5) |
121
(37.8) |
67.4b)
(37.8) |
32.5
(49.3) |
幾何平均値(幾何CV%)、n=8 a:算術平均値(SD) b:n=7
臨床成績
1. 人工膝関節全置換術施行患者を対象とした臨床試験成績5, 6, 7)
国内で実施した第II相二重盲検試験において、人工膝関節全置換術施行患者(有効性評価445例、安全性評価520例)に、エドキサバン5、15、30、又は60mg、もしくはプラセボを1日1回、11~14日間経口投与した。静脈血栓塞栓症の発現抑制は用量依存的であり、すべてのエドキサバン群においてプラセボ群よりも有意に静脈血栓塞栓症の発現を抑制した。大出血又は臨床的に重要な出血の発現率には、投与群間の有意な差は認められなかった。大出血はエドキサバン60mg群の1例に認められ、ヘモグロビン量が2g/dLを超えて低下した症例であった。
(表3 参照)
日本及び台湾で実施した第III相二重盲検試験において、人工膝関節全置換術施行患者(有効性評価594例、安全性評価703例)に、エドキサバン30mgを1日1回、11~14日間経口投与、又は対照薬としたエノキサパリンナトリウム(以下、エノキサパリン)2000IUを1日2回、11~14日間皮下注射した。静脈血栓塞栓症の発現率について、対照薬群に対するエドキサバン群の非劣性が検証された。大出血又は臨床的に重要な出血の発現率には、投与群間の有意な差は認められなかった。エドキサバン群で大出血は4例に発現し、その内訳は、ヘモグロビン量が2g/dLを超えて低下した症例が3例、4単位を超える輸血を必要とし、かつ、ヘモグロビン量が2g/dLを超えて低下した症例が1例であった。
(表4 参照)
2. 人工股関節全置換術施行患者を対象とした臨床試験成績8, 9)
日本及び台湾で実施した第II相試験において、人工股関節全置換術施行患者(有効性評価224例、安全性評価261例)に、エドキサバン15又は30mgを二重盲検下で1日1回、11~14日間経口投与、もしくはエノキサパリン2000IUをオープンラベルで1日2回、11~14日間皮下注射した。15mg群と30mg群の静脈血栓塞栓症の発現率に有意な差は認められなかった。また、大出血又は臨床的に重要な出血の発現率についても、投与群間に有意な差は認められなかった。大出血はエドキサバン30mg群の1例に認められ、ヘモグロビン量が2g/dLを超えて低下した症例であった。
(表5 参照)
国内で実施した第III相二重盲検試験において、人工股関節全置換術施行患者(有効性評価503例、安全性評価604例)に、エドキサバン30mgを1日1回、11~14日間経口投与、又は対照薬としたエノキサパリン2000IUを1日2回、11~14日間皮下注射した。静脈血栓塞栓症の発現率について、対照薬群に対するエドキサバン群の非劣性が検証された。大出血又は臨床的に重要な出血の発現率には、投与群間の有意な差は認められなかった。エドキサバン群で大出血は2例に発現し、いずれもヘモグロビン量が2g/dLを超えて低下した症例であった。
(表6 参照)
3. 股関節骨折手術施行患者を対象とした臨床試験成績10)
国内で実施した第III相試験において、股関節骨折手術施行患者(有効性評価73例、安全性評価88例)に、オープンラベルでエドキサバン30mgを1日1回、11~14日間経口投与、もしくはエノキサパリン2000IUを1日2回、11~14日間皮下注射した。静脈血栓塞栓症の発現率と、大出血又は臨床的に重要な出血の発現率は、下表のとおりであった。エドキサバン群で大出血は1例に発現し、ヘモグロビン量が2g/dLを超えて低下した症例であった。
(表7 参照)
表3 人工膝関節全置換術施行患者における静脈血栓塞栓症及び大出血又は臨床的に重要な出血の発現率(国内第II相試験)
| |
プラセボ群 |
エドキサバン群
5mg |
エドキサバン群
15mg |
エドキサバン群
30mg |
エドキサバン群
60mg |
静脈血栓塞栓症発現率(例数)
[95%信頼区間] |
48.3%
(43/89)
[37.9~58.7] |
29.5%
(26/88)
[20.0~39.1] |
26.1%
(24/92)
[17.1~35.1] |
12.5%
(11/88)
[5.6~19.4] |
9.1%
(8/88)
[3.1~15.1] |
大出血又は臨床的に重要な出血発現率(例数)
[95%信頼区間] |
3.9%
(4/102)
[1.5~9.7] |
2.9%
(3/103)
[1.0~8.2] |
3.8%
(4/106)
[1.5~9.3] |
3.9%
(4/103)
[1.5~9.6] |
4.7%
(5/106)
[2.0~10.6] |
表4 人工膝関節全置換術施行患者における静脈血栓塞栓症及び大出血又は臨床的に重要な出血の発現率(日台第III相試験)
| |
|
エドキサバン群 |
エノキサパリン群 |
| 全体集団 |
静脈血栓塞栓症発現率(例数)
[95%信頼区間] |
7.4%
(22/299)
[4.9~10.9] |
13.9%
(41/295)
[10.4~18.3] |
| 全体集団 |
静脈血栓塞栓症発現率の群間差
[95%信頼区間] |
-6.5%
[-11.6~-1.6] |
-6.5%
[-11.6~-1.6] |
| 全体集団 |
大出血又は臨床的に重要な出血の発現率(例数)
[95%信頼区間] |
6.2%
(22/354)
[4.1~9.2] |
3.7%
(13/349)
[2.2~6.3] |
| 日本人集団 |
静脈血栓塞栓症発現率(例数)
[95%信頼区間] |
7.3%
(20/273)
[4.8~11.0] |
12.2%
(33/270)
[8.8~16.7] |
| 日本人集団 |
静脈血栓塞栓症発現率の群間差
[95%信頼区間] |
-4.9%
[-10.0~0.1] |
-4.9%
[-10.0~0.1] |
| 日本人集団 |
大出血又は臨床的に重要な出血の発現率(例数)
[95%信頼区間] |
6.2%
(20/323)
[4.0~9.4] |
4.0%
(13/323)
[2.4~6.8] |
非劣性の許容限界値は5%と設定した。
表5 人工股関節全置換術施行患者における静脈血栓塞栓症及び大出血又は臨床的に重要な出血の発現率(日台第II相試験)
| |
エドキサバン群
15mg |
エドキサバン群
30mg |
エノキサパリン群a) |
静脈血栓塞栓症発現率(例数)
[95%信頼区間] |
3.8%
(3/78)
[1.3~10.7] |
2.8%
(2/72)
[0.8~9.6] |
4.1%
(3/74)
[1.4~11.3] |
大出血又は臨床的に重要な出血の発現率(例数)
[95%信頼区間] |
2.2%
(2/89)
[0.6~7.8] |
1.2%
(1/85)
[0.2~6.4] |
2.3%
(2/87)
[0.6~8.0] |
a:参考として設定した群であり、統計学的な比較対照群ではない。
表6 人工股関節全置換術施行患者における静脈血栓塞栓症及び大出血又は臨床的に重要な出血の発現率(国内第III相試験)
| |
エドキサバン群 |
エノキサパリン群 |
静脈血栓塞栓症発現率(例数)
[95%信頼区間] |
2.4%
(6/255)
[1.1~5.0] |
6.9%
(17/248)
[4.3~10.7] |
静脈血栓塞栓症発現率の群間差
[95%信頼区間] |
-4.5%
[-8.6~-0.9] |
-4.5%
[-8.6~-0.9] |
大出血又は臨床的に重要な出血の発現率(例数)
[95%信頼区間] |
2.6%
(8/303)
[1.3~5.1] |
3.7%
(11/301)
[2.1~6.4] |
非劣性の許容限界値は8%と設定した。
表7 股関節骨折手術施行患者における静脈血栓塞栓症及び大出血又は臨床的に重要な出血の発現率(国内第III相試験)
| |
エドキサバン群 |
エノキサパリン群a) |
静脈血栓塞栓症発現率(例数)
[95%信頼区間] |
6.5%
(3/46)
[2.2~17.5] |
3.7%
(1/27)
[0.7~18.3] |
大出血又は臨床的に重要な出血の発現率(例数)
[95%信頼区間] |
3.4%
(2/59)
[0.9~11.5] |
6.9%
(2/29)
[1.9~22.0] |
a:参考として設定した群であり、統計学的な比較対照群ではない。
薬効薬理
1. 作用機序11)
エドキサバンはin vitro でヒトの活性化血液凝固第X因子(FXa)を競合的かつ選択的に阻害した。トロンビンなど、他の凝固関連因子のセリンプロテアーゼに対する阻害活性は弱かった。
2. 抗凝固作用11)
エドキサバンはin vitro でヒト血漿におけるプロトロンビン時間(PT)、活性化部分トロンボプラスチン時間(APTT)及びトロンビン時間(TT)を延長した。その凝固時間延長作用の強さはPT>APTT>TTの順であった。
3. 血栓モデルにおける抗血栓作用12)
ラットの静脈血栓モデル、静脈うっ血血栓モデル、動静脈シャントモデル、及び組織因子誘発DICモデルにおいて、エドキサバンは単回経口投与により用量依存的に血栓形成を抑制した。ラット静脈血栓モデルにおいて、エドキサバンは抗血栓作用を示す用量でAPTTに影響せずにPTを延長した。
4. 止血に及ぼす影響13)
ラット尾出血モデルにおいて、抗血栓用量よりも高い用量のエドキサバン及びエノキサパリンは出血時間を有意に延長した。出血時間2倍延長用量(BT2)とラットの静脈血栓モデルにおける血栓形成50%抑制用量(ED50)との比(BT2/ED50)は、エドキサバンが10.5より大きく、エノキサパリンは3.4であった。
5. 血液凝固因子製剤による抗凝固作用のリバース14)
ヒト血漿でのエドキサバンによるin vitro PT延長作用は、遺伝子組換え活性化血液凝固第VII因子、血液凝固因子抗体迂回活性複合体、及び血液凝固第IX因子複合体により抑制された。
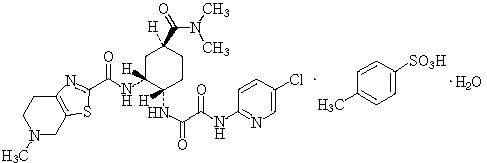
有効成分に関する理化学的知見
1. 一般名
エドキサバントシル酸塩水和物(Edoxaban Tosilate Hydrate)
2. 化学名
N -(5-Chloropyridin-2-yl)-N '-[(1S ,2R ,4S )-4-(dimethylcarbamoyl)-2-(5-methyl-4,5,6,7-tetrahydro[1,3]thiazolo[5,4-c ]pyridine-2-carboxamido)cyclohexyl]oxamide mono(4-methylbenzenesulfonate)monohydrate
3. 分子式
C24H30ClN7O4S・C7H8O3S・H2O
4. 分子量
738.27
5. 構造式
6. 性状
白色~微黄白色の粉末である。
ジメチルスルホキシドに溶けやすく、メタノールにやや溶けやすく、水又はエタノール(99.5)に溶けにくい。
7. 融点
約249℃(分解)
8. 分配係数
1-オクタノール/Britton-Robinson緩衝液(pH4.0);-0.91
1-オクタノール/Britton-Robinson緩衝液(pH8.0);1.72
包装
リクシアナ錠15mg (バラ)100錠
(PTP)100錠 140錠(14錠×10)
リクシアナ錠30mg (バラ)100錠
(PTP)100錠 140錠(14錠×10)
Information is based on approvals granted in Japan. In some cases, the approved details may vary in countries other than Japan.
In deciding to use a medicine, the risk (side effects) of taking the medicine must be weighed against the benefit (effects) it will do. The patient's cooperation is indispensable here.
Brand name : LIXIANA TABLETS 30 mg
Active ingredient: Edoxaban tosilate hydrate
Dosage form: slightly red tablet, φ: 8.6 mm, thickness: 3.8 mm
Printings on wrapping: リクシアナ錠 30mg DSC472 LIXIANA 30mg |