| 英文药名: SONIAS (Pioglitazone/Glimepiride Tablets)
中文药名: 吡格列酮格列美脲片
药品介绍
成分:盐酸吡格列酮和格列美脲;
适应症
盐酸吡格列酮+格列美脲复方片剂用于治疗2型糖尿病。吡格列酮可减小胰岛素抵抗,磺酰脲类药物格列美脲可刺激胰腺产生更多的胰岛素,这两种药的作用互相配合可更好的控制2型糖尿病患者。
【原产地英文商品名】SONIAS HD(ソニアス) (30/3)mg/tab 100tabs/box
【原产地英文药品名】PIOGLITAZONE HCL/GLIMEPIRIDE
【中文参考商品译名】
注:以下产品不同规格和不同价格,购买时请以电话咨询为准!
·SONIAS LD(ソニアス) (15/1)毫克/片 100片/盒
·SONIAS HD(ソニアス) (30/3)毫克/片 100片/盒
【中文参考药品译名】盐酸吡格列酮/格列美脲
【生产厂家中文参考译名】武田
【生产厂家英文名】TAKEDA

Launch of SONIAS® LD and SONIAS® HD in Japan
– Fixed dose combination tablet of ACTOS® and sulfonylurea for treatment of type 2 diabetes –
Osaka, Japan June 6 2011 – Takeda Pharmaceutical Company Limited (“Takeda”) announced today that it launched SONIAS®, a fixed dose combination tablet of ACTOS® (generic name: pioglitazone HCl) and sulfonylurea (generic name: glimepiride) for treatment of type 2 diabetes in Japan.
SONIAS is a tablet taken orally once daily and has two dosage strengths, “SONIAS LD” and “SONIAS HD” which contain 15mg pioglitazone/1mg glimepiride, and 30mg pioglitazone/3mg glimepiride respectively.
ACTOS, which was discovered by Takeda, is in the thiazolidinedione (TZD) class of oral antidiabetic medications and targets insulin resistance, which is a characteristic symptom associated with type 2 diabetes. Sulfonylurea primarily acts on beta cells of the pancreas and increasing the amount of insulin secretion by the pancreas. It is expected that by combining these two medications which have differing mechanisms of action, patients will be able to avoid missing a dose due to the greater ease of administration, thereby allowing patients with type 2 diabetes to better control their blood glucose levels.
“Adding SONIAS to our broad line-up of treatment for type2 diabetes will allow us to offer more appropriate treatment options to each patient,” said Yasuhiko Yamanaka, Director and Senior Vice President of Pharmaceutical Marketing Division. “SONIAS is a fixed dose combination tablet of ACTOS and sulfonylurea, which has been most commonly prescribed as a co-administrative regime in Japan for treatment of type 2 diabetes so that it is expected to contribute to the treatment of many patients with type 2 diabetes.”
Predicted FY2011 sale of ACTOS including SONIAS is ¥44 billion and has been included in the projected consolidated results for FY2011, which was disclosed on May 15, 2011.
About SONIAS
| Brand Name: |
SONIAS® LD (pioglitazone 15mg / glimepiride 1mg)
SONIAS® HD (pioglitazone 30mg / glimepiride 3mg)
|
| Generic Name: |
pioglitazone HCl / glimepiride |
| Indications: |
type 2 diabetes
In patients appropriate to the treatment by concomitant therapy of pioglitazone HCl and glimepiride.
|
| Dosage and Usage: |
SONIAS is orally administered to adults once daily as pioglitazone / glimepiride, 15mg/1mg or 30mg/3mg before or after breakfast. |
ソニアス配合錠LD/ソニアス配合錠HD
薬効分類名
チアゾリジン系薬/スルホニルウレア系薬配合剤 -2型糖尿病治療剤-
商標名
SONIAS Combination Tablets LD
一般的名称
ピオグリタゾン塩酸塩/グリメピリド配合錠
警告
重篤かつ遷延性の低血糖症を起こすことがある。用法及び用量、使用上の注意に特に留意すること。
|
禁忌
(次の患者には投与しないこと)
1.
心不全の患者及び心不全の既往歴のある患者
[ピオグリタゾンでは、動物試験において循環血漿量の増加に伴う代償性の変化と考えられる心重量の増加がみられており、また、臨床的にも心不全を増悪あるいは発症したとの報告がある。]
2.
重篤な肝又は腎機能障害のある患者
[低血糖を起こすおそれがある。また、ピオグリタゾンは主に肝臓で代謝されるため、重篤な肝機能障害のある患者では蓄積するおそれがある。]
3.
重症ケトーシス、糖尿病性昏睡又は前昏睡、1型糖尿病の患者
[輸液、インスリンによる速やかな高血糖の是正が必須となる。]
4.
重症感染症、手術前後、重篤な外傷のある患者
[インスリン注射による血糖管理が望まれるので本剤の投与は適さない。]
5.
下痢、嘔吐等の胃腸障害のある患者
[低血糖を起こすおそれがある。]
6.
妊婦又は妊娠している可能性のある婦人(「妊婦、産婦、授乳婦等への投与」の項参照)
7.
本剤の成分又はスルホンアミド系薬剤に対し過敏症の既往歴のある患者
|
効能又は効果
2型糖尿病
ただし、ピオグリタゾン塩酸塩及びグリメピリドの併用による治療が適切と判断される場合に限る。
効能又は効果に関連する使用上の注意
1.
糖尿病の診断が確立した患者に対してのみ適用を考慮すること。糖尿病以外にも耐糖能異常・尿糖陽性等、糖尿病類似の症状(腎性糖尿、甲状腺機能異常等)を有する疾患があることに留意すること。
2.
本剤を2型糖尿病治療の第一選択薬として用いないこと。
3.
本剤LD(ピオグリタゾン/グリメピリドとして15mg/1mg)については、原則として、既にピオグリタゾンとして1日15mg及びグリメピリド1日1mgを併用し状態が安定している場合、あるいはピオグリタゾンとして1日15mg又はグリメピリド1日1mgの単剤の治療により効果不十分な場合に、使用を検討すること。
4.
本剤HD(ピオグリタゾン/グリメピリドとして30mg/3mg)については、原則として、既にピオグリタゾンとして1日30mg及びグリメピリド1日3mgを併用し状態が安定している場合、あるいはグリメピリド1日3mgの単剤の治療により効果不十分な場合に、使用を検討すること。
5.
ピオグリタゾン塩酸塩の治療により効果不十分な場合の本剤使用に関する臨床試験を実施しておらず、有効性及び安全性に関する成績は限られている。
6.
本剤投与中において、本剤の投与がピオグリタゾン塩酸塩及びグリメピリドの各単剤の併用よりも適切であるか慎重に判断すること。
用法及び用量
通常、成人には1日1回1錠(ピオグリタゾン/グリメピリドとして15mg/1mg又は30mg/3mg)を朝食前又は朝食後に経口投与する。
用法及び用量に関連する使用上の注意
ピオグリタゾンによる浮腫やグリメピリドによる低血糖等の副作用が発現するおそれがあるので、ピオグリタゾン及びグリメピリドの各単剤の用法・用量及び以下を考慮して、患者毎に本剤の用量を決めること。
(1)
ピオグリタゾンの投与により浮腫が比較的女性に多く報告されているので、グリメピリド1日1mg単剤の治療により効果不十分な女性に投与する場合は、浮腫の発現に留意し、ピオグリタゾン/グリメピリドとして1日1回15mg/1mgから投与を開始することが望ましい。
(2)
一般に高齢者では生理機能が低下しているので、グリメピリド1日1mg単剤の治療により効果不十分な高齢者に投与する場合は、ピオグリタゾン/グリメピリドとして1日1回15mg/1mgから投与を開始することが望ましい。
(3)
グリメピリド1日3mg単剤の治療により効果不十分な場合は、浮腫、低血糖等に注意し、ピオグリタゾンとして1日30mgを上乗せすることが適切であるか慎重に検討すること。
(4)
ピオグリタゾンとして1日30mg単剤の治療により効果不十分な場合は、原則としてグリメピリドの開始用量(1日0.5~1mg)から各単剤の併用療法を行うこと。
使用上の注意
慎重投与(次の患者には慎重に投与すること)
1.
心不全発症のおそれのある心筋梗塞、狭心症、心筋症、高血圧性心疾患等の心疾患のある患者
[循環血漿量の増加により心不全を発症させるおそれがある。](「重要な基本的注意」、「重大な副作用」の項参照)
2.
次に掲げる低血糖を起こすおそれのある患者又は状態
(1)
肝又は腎機能障害(【禁忌】の項参照)
(2)
脳下垂体機能不全又は副腎機能不全
(3)
栄養不良状態、飢餓状態、不規則な食事摂取、食事摂取量の不足又は衰弱状態
(4)
激しい筋肉運動
(5)
過度のアルコール摂取者
(6)
高齢者(「高齢者への投与」の項参照)
3.
他の糖尿病用薬を投与中の患者(「相互作用」、「重大な副作用」の項参照)
重要な基本的注意
1.
循環血漿量の増加によると考えられる浮腫が短期間に発現し、また心不全が増悪あるいは発症することがあるので、下記の点に留意すること。(【禁忌】、「慎重投与」の項参照)
(1)
心不全の患者及び心不全の既往歴のある患者には投与しないこと。
(2)
投与中は観察を十分に行い、浮腫、急激な体重増加、心不全症状等がみられた場合には投与中止、ループ利尿剤(フロセミド等)の投与等適切な処置を行うこと。
(3)
服用中の浮腫、急激な体重増加、症状の変化に注意し、異常がみられた場合には直ちに本剤の服用を中止し、受診するよう患者を指導すること。
2.
心電図異常や心胸比増大があらわれることがあるので、定期的に心電図検査を行うなど十分に観察し、異常が認められた場合には投与を一時中止するかあるいは減量するなど慎重に投与すること。(「その他の副作用」の項参照)
3.
重篤かつ遷延性の低血糖を起こすことがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
また、低血糖に関する注意及び対処方法について、患者及びその家族に十分徹底させること。
4.
**海外で実施した糖尿病患者を対象とした疫学研究において、ピオグリタゾンを投与された患者で膀胱癌の発生リスクが増加するおそれがあり、また、投与期間が長くなるとリスクが増える傾向が認められているので、以下の点に注意すること。(「その他の注意」の項参照)
(1)
**膀胱癌治療中の患者には投与を避けること。また、特に、膀胱癌の既往を有する患者には本剤の有効性及び危険性を十分に勘案した上で、投与の可否を慎重に判断すること。
(2)
**投与開始に先立ち、患者又はその家族に膀胱癌発症のリスクを十分に説明してから投与すること。また、投与中に血尿、頻尿、排尿痛等の症状が認められた場合には、直ちに受診するよう患者に指導すること。
(3)
**投与中は、定期的に尿検査等を実施し、異常が認められた場合には、適切な処置を行うこと。また、投与終了後も継続して、十分な観察を行うこと。
5.
本剤の適用においては、あらかじめ糖尿病治療の基本である食事療法、運動療法を十分に行うこと。
6.
本剤を使用する場合は、インスリン抵抗性が推定される患者に限定すること。インスリン抵抗性の目安は肥満度(Body Mass Index=BMI kg/m2)で24以上あるいはインスリン分泌状態が空腹時血中インスリン値で5μU/mL以上とする。
7.
投与する場合には、血糖、尿糖を定期的に検査し、薬剤の効果を確かめ、効果が不十分な場合には、速やかに他の治療薬への切り替えを行うこと。
8.
投与の継続中に、投与の必要がなくなる場合や、減量する必要がある場合があり、また、患者の不養生、感染症の合併等により効果がなくなったり、不十分となる場合があるので、食事摂取量、体重の推移、血糖値、感染症の有無等に留意のうえ、常に投与継続の可否、投与量、薬剤の選択等に注意すること。
9.
急激な血糖下降に伴い、糖尿病性網膜症が悪化する例があるので留意すること。
10.
本剤と他の糖尿病用薬の併用における安全性は確立していない(使用経験はない)。
相互作用
ピオグリタゾンは主として肝薬物代謝酵素CYP2C8で代謝され、他に複数の分子種が代謝に関与する。また、グリメピリドは主としてCYP2C9で代謝される。
併用注意
(併用に注意すること)
1.
薬剤名等
糖尿病用薬
スルホニルウレア剤 グリベンクラミド、グリクラジド、トルブタミド 等
速効型インスリン分泌促進薬 ナテグリニド、ミチグリニドカルシウム水和物
α-グルコシダーゼ阻害剤 ボグリボース、アカルボース、ミグリトール
ビグアナイド系薬剤 メトホルミン塩酸塩、ブホルミン塩酸塩
DPP-4阻害薬 アログリプチン安息香酸塩、シタグリプチンリン酸塩水和物、ビルダグリプチン
GLP-1アナログ製剤 リラグルチド 等
インスリン製剤
糖尿病用薬の血糖降下作用を増強する薬剤
β-遮断薬、モノアミン酸化酵素阻害薬、フィブラート系の高脂血症治療薬、ワルファリン、プロベネシド、ピラゾロン系消炎薬、サリチル酸製剤、プロピオン酸系消炎薬、アリール酢酸系消炎薬、オキシカム系消炎薬、クラリスロマイシン、サルファ剤、クロラムフェニコール、テトラサイクリン系抗生物質、シプロフロキサシン、レボフロキサシン水和物、グアネチジン、アゾール系抗真菌薬、シベンゾリンコハク酸塩、ジソピラミド、ピルメノール塩酸塩水和物 等
臨床症状・措置方法・機序等
上記の糖尿病用薬又は血糖降下作用を増強する薬剤と併用すると、低血糖症状が起こることがあるので、併用する場合には、血糖値等の患者の状態を十分に観察しながら、低用量から投与を開始するなど慎重に投与すること。
特にβ-遮断薬と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。
α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはショ糖ではなくブドウ糖を投与すること。(「副作用」の項参照)
2.
薬剤名等
糖尿病用薬の血糖降下作用を減弱する薬剤
アドレナリン、副腎皮質ホルモン、甲状腺ホルモン、卵胞ホルモン、利尿薬、ピラジナミド、イソニアジド、リファンピシン、ニコチン酸、フェノチアジン系薬剤、フェニトイン、ブセレリン酢酸塩 等
臨床症状・措置方法・機序等
上記の薬剤と併用すると、血糖降下作用の減弱による高血糖症状(嘔気・嘔吐、脱水、呼気のアセトン臭等)が起こることがあるので、併用する場合には、血糖値等の患者の状態を十分に観察しながら投与すること。
3.
薬剤名等
リファンピシン等のCYP2C8を誘導する薬剤
臨床症状・措置方法・機序等
リファンピシンと併用するとピオグリタゾンのAUCが54%低下するとの報告があるので、リファンピシンと併用する場合は血糖管理状況を十分に観察し、必要な場合には本剤を増量すること。
副作用
副作用等発現状況の概要
承認時までに行われた試験でピオグリタゾン/グリメピリドとして15mg/1mg又は30mg/3mgを1日1回投与された62例中15例(24.2%)に臨床検査値の異常を含む副作用が認められている。
以下の副作用は、上記の試験あるいはピオグリタゾン、グリメピリドの各薬剤で認められているものである。
重大な副作用
1.
心不全が増悪あるいは発症することがあるので、投与中は観察を十分に行い、浮腫、急激な体重増加、心不全症状・徴候(息切れ、動悸、心胸比増大、胸水等)がみられた場合には投与を中止し、ループ利尿剤等を投与するなど適切な処置を行うこと。特に心不全発症のおそれのある心疾患の患者には注意すること。(「慎重投与」、「重要な基本的注意」の項参照)
2.
低血糖(初期症状:脱力感、高度の空腹感、発汗等)(0.1~5%未満)があらわれることがある。なお、徐々に進行する低血糖では、精神障害、意識障害等が主である場合があるので注意すること。
また、本剤の投与により低血糖症状(脱力感、高度の空腹感、発汗、動悸、振戦、頭痛、知覚異常、不安、興奮、神経過敏、集中力低下、精神障害、意識障害、痙攣等)が認められた場合には通常はショ糖を投与するが、α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはブドウ糖を投与すること。なお、低血糖症状が認められた場合、本剤あるいは併用している糖尿病用薬を一時的に中止するかあるいは減量するなど慎重に投与すること。
また、低血糖は投与中止後、臨床的にいったん回復したと思われる場合でも数日間は再発することがある。
3.
循環血漿量の増加によると考えられる浮腫(8.1%)があらわれることがあるので、観察を十分に行い、浮腫が認められた場合には、減量あるいは中止するなど適切な処置を行うこと。これらの処置によっても症状が改善しない場合には、必要に応じてループ利尿剤(フロセミド等)の投与等を考慮すること。
なお、女性においてピオグリタゾンによる浮腫の発現が多くみられている[ピオグリタゾン国内臨床試験:男性4.2%(29/687例)、女性12.2%(83/681例)]。また、ピオグリタゾンによる浮腫の発現頻度は、糖尿病性網膜症合併例で10.4%(44/422例)、糖尿病性神経障害合併例で11.4%(39/342例)、糖尿病性腎症合併例で10.6%(30/282例)であり、糖尿病性合併症発症例は非発症例に比べ高い傾向にある。これらの症例にあっては浮腫の発現に特に留意すること。(<用法・用量に関連する使用上の注意>の項参照)
4.
AST(GOT)、ALT(GPT)、AL-P等の著しい上昇を伴う肝機能障害、黄疸(頻度不明)があらわれることがあるので、基礎に肝機能障害を有するなど必要な場合には定期的に肝機能検査を実施し、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
5.
溶血性貧血、無顆粒球症、汎血球減少(いずれも頻度不明)があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
6.
筋肉痛、脱力感、CK(CPK)上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症(頻度不明)があらわれることがあるので、このような場合には投与を中止し、適切な処置を行うこと。
7.
間質性肺炎(頻度不明)あらわれることがあるので、発熱、咳嗽、呼吸困難、肺音の異常(捻髪音)等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施し、異常が認められた場合には、投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
8.
胃潰瘍が再燃した例が報告されている。
重大な副作用(類薬)
再生不良性貧血があらわれることが他のスルホニルウレア剤で報告されているので、観察を十分に行い、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
その他の副作用
承認時までに行われた試験で認められた主な副作用は浮腫、体重増加であった。なお、ピオグリタゾン、グリメピリドそれぞれの成分で認められている副作用は以下のとおりである。
ピオグリタゾン
血液注2)
0.1~5%未満
貧血、白血球減少、血小板減少
循環器
0.1~5%未満
血圧上昇、心胸比増大注3)、心電図異常注3)、動悸、胸部圧迫感、顔面潮紅
過敏症注4)
0.1~5%未満
発疹、湿疹、そう痒
消化器
0.1~5%未満
悪心・嘔吐、胃部不快感、胸やけ、腹痛、腹部膨満感、下痢、便秘、食欲亢進、食欲不振
肝臓注5)
0.1~5%未満
AST(GOT)、ALT(GPT)、AL-P、γ-GTPの上昇
精神神経系
0.1~5%未満
めまい、ふらつき、頭痛、眠気、倦怠感、脱力感、しびれ
その他
5%以上
LDH及びCK(CPK)の上昇注6)
その他
0.1~5%未満
BUN及びカリウムの上昇、総蛋白及びカルシウムの低下、体重及び尿蛋白の増加、息切れ
その他
0.1%未満
関節痛、ふるえ、急激な血糖下降に伴う糖尿病性網膜症の悪化
その他
頻度不明
骨折注7)
グリメピリド
血液
頻度不明
白血球減少、貧血、血小板減少
肝臓
頻度不明
AST(GOT)、ALT(GPT)、AL-P、LDH、γ-GTPの上昇
腎臓
頻度不明
BUNの上昇
消化器
頻度不明
嘔気、嘔吐、心窩部痛、下痢、便秘、腹部膨満感、腹痛
過敏症
頻度不明
発疹、そう痒感、光線過敏症
精神神経系
頻度不明
めまい、頭痛
その他
頻度不明
電解質異常(血清カリウム上昇、ナトリウム低下等)、倦怠感、CK(CPK)の上昇、浮腫、脱毛、一過性視力障害、味覚異常
その他の副作用の注意
注2)血液検査を定期的(3ヵ月に1回程度)に行うこと。
注3)「重要な基本的注意(2)」の項参照
注4)このような場合には投与を中止すること。
注5)発現頻度:AST(GOT) 0.86%(11/1,272例)、ALT(GPT) 0.94%(12/1,276例)、AL-P 0.47%(6/1,272例)、γ-GTP 0.95%(12/1,263例)
注6)LDH上昇(5.63%、71/1,261例)やCK(CPK)上昇(5.00%、61/1,221例)があらわれることがあるので、異常が認められた場合には、再検査を行うなど観察を十分に行うこと。
注7)外国の臨床試験で、女性において骨折の発現頻度上昇が認められている。
高齢者への投与
一般に高齢者では生理機能が低下しており、低血糖があらわれやすいので、ピオグリタゾン/グリメピリドとして1日1回15mg/1mgから投与を開始するなど、副作用発現に留意し、経過を十分に観察しながら慎重に投与すること。
妊婦、産婦、授乳婦等への投与
1.
妊婦又は妊娠している可能性のある婦人には投与しないこと。[ピオグリタゾンについては、ラット器官形成期投与試験では、40mg/kg以上の群で胚・胎児死亡率の高値、出生児の生存率の低値が、ウサギ器官形成期投与試験では、160mg/kg群で親動物の死亡又は流産がそれぞれ1例、胚・胎児死亡率の高値がみられている。また、スルホニルウレア剤は胎盤を通過することが報告されており、新生児の低血糖、巨大児が認められている。グリメピリドの動物試験(ラット、ウサギ)では催奇形作用が報告されている。]
2.
授乳中の婦人に投与することを避け、やむを得ず投与する場合は授乳を中止させること。
[ピオグリタゾン1)及びスルホニルウレア剤でラット乳汁中への移行が報告されている。]
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない(使用経験がない)。
過量投与
1. 徴候・症状
低血糖が起こることがある。(「副作用」の項参照)
2. 処置
(1)
飲食が可能な場合:ブドウ糖(5~15g)又は10~30gの砂糖の入った吸収の良いジュース、キャンディなどを摂取させる。
(2)
意識障害がある場合:ブドウ糖液(50% 20mL)を静注し、必要に応じて5%ブドウ糖液点滴により血糖値の維持を図る。
(3)
血糖上昇ホルモンとしてのグルカゴン投与もよい。
適用上の注意
薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。[PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている。]
その他の注意
1.
スルホニルウレア剤(トルブタミド1日1.5g)を長期間継続使用した場合、食事療法単独の場合と比較して心臓・血管系障害による死亡率が有意に高かったとの報告がある。
2.
イヌにグリメピリドを投与した慢性毒性試験において、最高用量の320mg/kg投与群の雌雄各1例に白内障を認めた。ウシの水晶体を用いたin vitro試験とラットを用いた検討結果では、白内障を発症させる作用や発症増強作用の可能性は認められなかった。
3.
ラット及びマウスにピオグリタゾンを24ヵ月間強制経口投与した試験では、ラット雄の3.6mg/kg/日以上の群に膀胱腫瘍がみられた。
4.
**海外で実施した糖尿病患者を対象とした疫学研究の中間解析において、全体解析では膀胱癌の発生リスクに有意差は認められなかったが(ハザード比 1.2 [95%信頼区間 0.9-1.5])、層別解析でピオグリタゾンの投与期間が2年以上で膀胱癌の発生リスクが有意に増加した(ハザード比 1.4 [95%信頼区間 1.03-2.0])。2)
また、別の疫学研究において、ピオグリタゾンを投与された患者で膀胱癌の発生リスクが有意に増加し(ハザード比 1.22 [95%信頼区間 1.05-1.43])、投与期間が1年以上で膀胱癌の発生リスクが有意に増加した(ハザード比 1.34 [95%信頼区間 1.02-1.75])。
5.
家族性大腸腺腫症(familial adenomatous polyposis:FAP)のモデル動物であるMinマウスに類薬(トログリタゾン及びロシグリタゾン)を経口投与したところ、結腸腫瘍の数及び大きさを増大させたとの報告がある。3,4)
6.
ピオグリタゾン等のチアゾリジン系薬剤を投与したところ(糖尿病性)黄斑浮腫が発症又は増悪したとの報告がある。視力低下があらわれた場合には黄斑浮腫の可能性を考慮すること。
7.
インスリン又は経口血糖降下剤の投与中にアンジオテンシン変換酵素阻害剤を投与することにより、低血糖が起こりやすいとの報告がある。
薬物動態
1. 血中濃度
健康成人(71例)に対し、ピオグリタゾン/グリメピリドとして30mg/3mg配合錠とピオグリタゾンとして30mgとグリメピリド3mg(単剤併用投与)をクロスオーバー法により1日1回絶食下で単回経口投与した時のピオグリタゾン未変化体、グリメピリド未変化体の血漿中濃度推移は下図のとおりであり、生物学的同等性が認められた。5)
配合錠投与時のピオグリタゾン未変化体、活性代謝物(M-II~IV)及びグリメピリド未変化体の薬物動態学的パラメータは表1のとおりであった。
なお、Wistar fattyラットで調べた血糖低下作用において、ピオグリタゾンの代謝物M-II~IVの活性は未変化体より弱い。
また、2型糖尿病患者を対象に1日1回グリメピリド1mg又は3mgの4週間反復投与時と1日1回ピオグリタゾン/グリメピリドとして15mg/1mg又は30mg/3mg配合錠の2週間反復投与時のグリメピリド血漿中トラフ濃度を比較したところ、ピオグリタゾンはグリメピリドの薬物動態に影響を与えないと考えられた。6)
2. 食事の影響(外国人データ)
健康成人(24例)を対象としたクロスオーバー試験で、ピオグリタゾン/グリメピリドとして45mg/4mg配合錠を高脂肪食摂取開始の約30分後に投与した時、絶食下投与と比較してピオグリタゾン未変化体のAUC及びCmax、グリメピリド未変化体のAUCのそれぞれの幾何平均比(高脂肪食摂取後投与/絶食下投与)90%信頼区間は0.8~1.25の範囲内であったが、グリメピリド未変化体のCmaxの幾何平均比(高脂肪食摂取後投与/絶食下投与)90%信頼区間は1.12~1.33であった。7)
(本剤の国内承認用量は15mg/1mg及び30mg/3mgである。)
2. 蛋白結合率
[14C]ピオグリタゾンをヒトの血清、4%ヒト血清アルブミン溶液に添加した時の蛋白結合率は、いずれも98%以上であった(in vitro)。1)
3. 代謝
ピオグリタゾンは主にCYP2C8で代謝され、他に1A1、1A2、2C9、2C19、2D6、3A4の複数の分子種が代謝に関与しエーテル部の開裂、エチレン部分の酸化、エチル基の酸化などを受けてM-I~IVに代謝される。8)また、ピオグリタゾンはCYP1A1、1A2、2A6、2B6、2C8、2C9、2C19、2D6、2E1、3A4にほとんど影響を与えなかった(in vitro)。9)
グリメピリドは主にCYP2C9の関与により、シクロヘキシル環メチル基の水酸化を受ける。10)
参考:ラット肝細胞分画を用いて代謝酵素を検討した結果、グリメピリドは主にCYP2Cサブファミリーの関与によりシクロヘキシル環メチル基の水酸化を受け、引き続いてサイトゾールの酵素によってカルボン酸体に変換されることが示唆されている。11)
4. 尿中排泄
(1)
健康成人(14例)に空腹時にピオグリタゾンとして1回30mgを単回経口投与した時、尿中には主としてM-IV~VIが排泄され、投与後48時間までの累積尿中排泄率は約30%であった。12)
(2)
健康成人男子6例にグリメピリド1mgを朝食直前に単回経口投与した時、尿中にはグリメピリド代謝物のみが検出された。この代謝物は、シクロヘキシル環のメチル基の水酸化体及びカルボン酸体で、投与後24時間までに投与量の44.9%が尿中に排泄された。13)
表1 30mg/3mg配合剤投与時の薬物動態学的パラメータ
| 測定物質 |
Cmax
(ng/mL) |
Tmax
(h) |
AUC0-inf
(ng・h/mL) |
T1/2
(h) |
| ピオグリタゾン |
1,183.2±364.4 |
2.6±1.4 |
11,842.2±3,607.7 |
8.9±9.3 |
| M-II |
37.3±15.4 |
6.8±2.2 |
1,075.1±465.4 |
15.5±9.2 |
| M-III |
254.4±84.9 |
12.6±4.8 |
12,757.7±4,104.0 |
28.3±10.2 |
| M-IV |
508.3±136.9 |
13.3±6.3 |
28,422.2±6,984.2 |
27.3±9.0 |
| グリメピリド |
222.5±64.7 |
2.2±0.7 |
1,269.7±426.1 |
7.5±5.5 |
(平均値±標準偏差)
表2 血漿中グリメピリド未変化体トラフ濃度(ng/mL)
| グリメピリド単独投与時 |
グリメピリド単独投与時 |
配合錠投与時 |
配合錠投与時 |
| 1mg投与 |
7.01±19.71 |
15mg/1mg錠投与 |
6.18±19.87 |
| 3mg投与 |
18.07±46.87 |
30mg/3mg錠投与 |
13.22±27.90 |
(平均値±標準偏差)
臨床成績
グリメピリド使用中の2型糖尿病患者を対象に、グリメピリドに代えて1日1回ピオグリタゾン/グリメピリドとして15mg/1mg配合錠(31例)又は30mg/3mg配合錠(31例)を朝食前又は朝食後に8週間経口投与した結果、HbA1C及び空腹時血糖値の投与前からの変化量は、両群ともに有意な差が認められた。6)
表3 配合錠投与前からの変化量(8週間投与)
| |
HbA1C |
HbA1C |
HbA1C |
空腹時血糖値 |
空腹時血糖値 |
空腹時血糖値 |
| |
投与前値(%) |
変化量(%) |
一標本t検定 |
投与前値(mg/dL) |
変化量(mg/dL) |
一標本t検定 |
| 15mg/1mg錠投与群 |
7.96±0.76 |
-0.59±0.56 |
p<0.0001 |
166.0±30.2 |
-12.5±21.7 |
p=0.0032 |
| 30mg/3mg錠投与群 |
8.41±0.68 |
-0.55±0.64 |
p<0.0001 |
190.8±36.9 |
-29.1±35.4 |
p<0.0001 |
(平均値±標準偏差)
薬効薬理
ピオグリタゾン
(1) 作用機序
ピオグリタゾンはインスリン受容体のインスリン結合部以降に作用してインスリン抵抗性を軽減し、肝における糖産生を抑制し、末梢組織における糖利用を高め血糖を低下させる。この作用は、インスリン抵抗性の主因である細胞内インスリン情報伝達機構を正常化することによると推測される。
(2) インスリン抵抗性改善作用
1)
インスリン抵抗性を有し、肥満型糖尿病であるWistar fattyラット及び肥満であるZucker fattyラットにピオグリタゾンを14日間投与し、20時間絶食後にインスリンを投与したところ、インスリン投与後の血糖低下の増強が認められた。14,15)
2)
肥満型糖尿病であるKKAyマウスの横隔膜のグリコーゲン画分及び副睾丸周囲脂肪組織の総脂肪画分へのインスリン刺激時の糖取り込みを増加させた。14)
3)
肥満型糖尿病であるWistar fattyラットの肝からの糖産生を抑制し、末梢組織における糖の利用を高めた。16)
(3) 末梢組織におけるインスリン作用増強
Wistar fattyラットの後肢ヒラメ筋において、インスリンの作用(グリコーゲン合成及び解糖亢進作用)を増強した(ex vivo)。また、Wistar fattyラットの副睾丸周囲脂肪組織由来の単離脂肪細胞において、インスリンの作用(グルコース酸化及び総脂質合成亢進作用)を増強した(ex vivo)。15)
(4) 肝におけるインスリン作用増強
Wistar fattyラットにおいて、肝におけるグルコキナーゼの活性を亢進し、グルコース-6-ホスファターゼの活性を低下させ、糖産生を抑制した(in vivo)。16)
(5) インスリン受容体作用増強
Wistar fattyラットの骨格筋において、低下したインスリン受容体及びインスリン受容体基質のリン酸化を正常化し、ホスファチジルイノシトール-3-キナーゼの活性を亢進させた(in vivo)。17)
(6) TNF-α産生抑制作用
Wistar fattyラットに認められる骨格筋TNF-α産生亢進を抑制し、これと並行して高血糖を軽減した(in vivo)。18)
(7) 糖代謝改善作用
1)
食事療法、運動療法に加えてスルホニルウレア剤を使用中の2型糖尿病患者に1日1回ピオグリタゾンとして30mgを12週間併用投与した二重盲検比較試験において、空腹時血糖、HbA1Cの下降、1,5-AGの上昇、血中インスリンの下降が認められている。19)
2)
インスリン抵抗性を有する肥満型2型糖尿病モデル動物(KKAyマウス、Wistar fattyラット)において、高血糖及び高インスリン血症を軽減した。一方、インスリン欠乏の1型糖尿病モデル動物(ストレプトゾシン糖尿病ラット)の高血糖、正常ラット(Sprague-Dawleyラット)の正常血糖には作用を示さなかった。14,15)
(8) 耐糖能改善作用
インスリン抵抗性を有し、耐糖能異常を示すWistar fattyラット及びZucker fattyラットにピオグリタゾンを10~12日間投与し、20時間絶食後にグルコースを経口投与したところ、グルコース投与後の血漿グルコース上昇の抑制及びインスリン過剰分泌の軽減が認められた。14,15)
グリメピリド
(1) 作用機序
グリメピリドは主に膵β細胞の刺激による内因性インスリン分泌の促進(膵作用)により、血糖降下作用を発現するものと考えられる。また、in vitro試験において糖輸送担体の活性化等の関与が示されている。
(2) 血糖降下作用及びインスリン分泌作用
1)
健康成人男子9例にグリメピリド1mgを朝食直前に単回投与した時、プラセボ投与時と比べ、朝食後の血中グルコース濃度はグリメピリド投与時において有意に低下した。この時の血清中インスリン濃度のCmaxは、プラセボ投与時と比べグリメピリド投与時では有意差は認められなかったが、朝食後4時間までのAUCはプラセボ投与時と比べ有意に増加した。20)
2)
ウサギ、ラット、イヌを用いた経口投与試験において、グリメピリドの血糖降下作用は投与1時間後から認められた。グリベンクラミドとの比較では同等もしくはそれ以上の血糖降下作用を示した。21)
(3) インスリン作用の増強
人工膵島を用いたイヌ正常血糖インスリンクランプ試験で、グリメピリドの投与により末梢組織での糖取り込み促進と、肝糖処理能の増加を認めた。22,23)また、グリメピリドはインスリン抵抗性KKAyマウスへの長期経口投与により、高血糖及び高インスリン血症を改善した。24)
筋肉・脂肪組織を用いたin vitro試験において、糖輸送担体の活性化や糖輸送の増加等の機序による膵外作用の関与が報告されている。25)
有効成分に関する理化学的知見
一般名
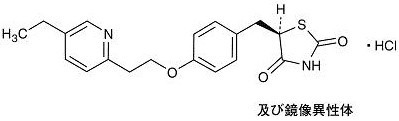
ピオグリタゾン塩酸塩(Pioglitazone Hydrochloride)〔JAN〕
化学名
(5RS)-5-{4-[2-(5-Ethylpyridin-2-yl)ethoxy]benzyl}thiazolidine-2, 4-dione monohydrochloride
分子式
C19H20N2O3S・HCl
分子量
392.90
融点
193℃(分解点)
性状
ピオグリタゾン塩酸塩は白色の結晶又は結晶性の粉末である。N,N-ジメチルホルムアミド又はメタノールにやや溶けやすく、エタノール(99.5)に溶けにくく、水にほとんど溶けない。0.1mol/L塩酸試液に溶ける。N,N-ジメチルホルムアミド溶液(1→20)は旋光性を示さない。
グリメピリド
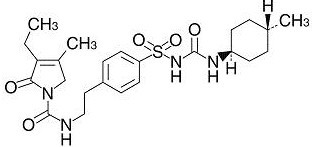
化学構造式
一般名
グリメピリド(Glimepiride)〔JAN〕
化学名
1-{4-[2-(3-Ethyl-4-methyl-2-oxo-3-pyrroline-1-carboxamido)ethyl]phenylsulfonyl}-3-(trans-4-methylcyclohexyl)urea
分子式
C24H34N4O5S
分子量
490.62
融点
205~208℃
性状
グリメピリドは白色の粉末である。N,N-ジメチルホルムアミドにやや溶けやすく、ジクロロメタンにやや溶けにくく、メタノールに溶けにくく、水にほとんど溶けない。
製造販売元
武田薬品工業株式会社 |