原发性脑肿瘤虽然列于人体恶性肿瘤第九或第十位,但在儿童是仅次于白血病的第二大常见恶性肿瘤。近年来,其发病率有增加趋势,估计我国每年有20万左右的新发病例。
胶质瘤约占所有原发性脑肿瘤的60%,其中胶质母细胞瘤及星形细胞瘤约占胶质瘤的一半。以手术为主的综合治疗使胶质瘤的疗效有了显著提高,低度恶性的星形细胞瘤和少突胶质细胞瘤患者的平均生存期已达到6~10年,但高度恶性的胶质母细胞瘤患者的平均生存时间只有12~15个月。肿瘤干细胞学说的问世,为攻克这一顽疾打开了希望之门。
胶质瘤干细胞
2001年,雷亚(Reya)等首次提出肿瘤发生发展与肿瘤干细胞相关的假设。至今除了在血液系统肿瘤中,还在脑、肺、消化道、乳腺、前列腺等多种器官的实体瘤中证实了肿瘤干细胞的存在。在胶质瘤,体外培养的细胞系、神经上皮细胞来源的多种肿瘤组织中都克隆出了肿瘤干细胞。
笔者研究发现,胶质瘤干细胞与神经干细胞,虽都有无限增殖和多向分化潜能,但逆向分化是胶质瘤干细胞所特有的,这是肿瘤细胞永生化的根本原因。
据此,我们已在国际上首次建立了体外永生、源于同一病例、原发与复发胶质瘤干细胞系。
胶质瘤干细胞与肿瘤治疗
有研究发现,胶质瘤干细胞与临床病理分级相关;胶质瘤耐放射与胶质瘤干细胞优先修复DNA损伤有关;肿瘤耐药与肿瘤干细胞相关,特别是与干细胞高表达ABC转运蛋白相关。
笔者研究发现,胶质瘤体外细胞系和实体瘤组织中,少数高表达ABCG2蛋白(ABC家族的主要成员)的细胞就是紧紧围绕血管、甚至是组成血管壁的肿瘤干细胞。
在缺氧条件下,肿瘤干细胞容易向血管内皮细胞转化,而局部坏死出血所致的缺血缺氧是高度恶性胶质母细胞瘤必然发生的事件(见图)。
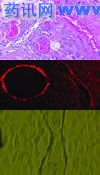
有鉴于此,针对组成肿瘤血管的细胞的治疗可能成为一种新的靶向治疗策略,而ABCG2是这类细胞特有的转运蛋白,能在化疗时将药物转运出细胞,因而高表达ABCG2蛋白的细胞优先被保存下来,成为日后复发的种子。
抑制ABC转运体的药物有望克服肿瘤干细胞耐药。伐司朴达(Valspodar)、比立考达(biricodar)和XR9576都是ABCB1抑制剂,在体外试验中可增加肿瘤细胞内的化疗药物浓度,但因毒性反应大等原因尚未用于临床。
目前为止,有研究证实钙通道阻滞剂尼卡地平有抑制ABCG2的功能,可提高化疗药米托蒽醌等进入肿瘤细胞的浓度。
笔者在上述自建的人脑胶质瘤干细胞系、多形性胶质母细胞瘤细胞系及其荷瘤鼠体内,证实尼卡地平加米托蒽醌或尼莫司汀可显著提高化疗效果,并已经开始临床Ⅳ期试用,疗效有待总结。
多形性胶质母细胞瘤寄托于丰富的血管供血才能维持其快速生长的恶性肿瘤生物学特征
图1~2 HE染色示肿瘤血管横、纵切面;图3~4 ABCG2免疫组化染色示肿瘤血管横、纵切面;图5 缺氧条件下培养在生物胶上的肿瘤细胞,已有一群首尾连接、扁长的深色细胞形成拟态血管。

