|
美药管局批准一种治疗晚期前列腺癌新药
美国食品和药物管理局29日宣布,一种治疗晚期前列腺癌的新药Degarelix获准在美国上市,这是美药管局7年来首次批准治疗前列腺癌的新药上市。
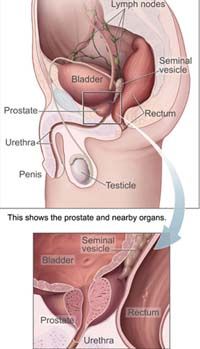
这种新型注射药剂主要针对晚期前列腺癌患者,它属于“促性腺激素释放激素(GnRH)”受体抑制剂类药物,通过抑 制睾丸激素来延缓前列腺癌病程发展。
美药管局负责肿瘤学药物产品的官员理查德·帕兹杜尔当天在新闻公报中说,前列腺癌是美国男性的第二大“癌症杀手”,“这些患者需要更多的治疗选择”。
据美国媒体报道,此前一些激素疗法的特点是“先升后降”,即在治疗初期,某些疗法会导致患者的睾丸激素水平激增,然后才会显现疗效,降低睾丸激素水平。这意味着在治疗初期,肿瘤可能非但未被抑制,反而会刺激生长。而Degarelix从一开始就能抑制前列腺癌。
前列腺癌是男性中最常见的癌症类型之一。据美媒体报道,在2004年,美国有近19万名男性被诊断患上前列腺癌,另有2.9万名患者死于这种疾病。目前治疗前列腺癌的疗法除激素疗法外,还有前列腺切除术、放疗和化疗等。
批准日期:2008年12月24日;公司“Ferring Pharmaceuticals, USA
一般描述:TRADENAME是一种为注射用消毒冻干粉,含地盖瑞利(为醋酸盐)和甘露醇。地盖瑞利是一种合成的线性十肽含7个非天然氨基酸,其中5个是D-氨基酸。地盖瑞利的醋酸盐是冻干得到的白至淡白色低密度无定形粉末。地盖瑞利的化学名是D-Alaninamide, N-acetyl-3-(2-naphthalenyl)-D -alanyl-4-chloro-Dphenylalanyl-3-(3-pyridinyl)-D-alanyl-L-seryl-4-[[[(4S)-hexahydro-2,6-dioxo-4-pyrimidinyl]carbonyl]amino]-Lphenylalanyl-4-[(aminocarbonyl)amino]-D-phenylalanyl-Lleucyl-N6–(1-methylethyl)-L- lysyl -L-prolyl。经验式是C82H103N18O16Cl和相对分子量1632.3 Da。地盖瑞利结构式如下:
适应证:TRADENAME是一种GnRH受体拮抗剂适用于治疗晚期前列腺癌患者。
剂量和用法:
TRADENAME是只为皮下给药和,不可静脉给药。
治疗开始量240 mg,各120 mg 2次注射。
接着开始剂量是每28天单次给药80 mg的维持剂量。
剂型和规格:
65岁患者应接受修改给药方案。
有全身疾病(ASA P3或P4) 患者应接受修改给药方案。
禁忌证:
既往对TRADENAME超敏性反应患者。
妊娠类别X。当给予怀孕妇女时胎儿可能受伤害。
警告和注意事项:
长期雄激素剥脱治疗延长QT间隔。考虑风险和获益。
不良反应:TRADENAME治疗期间最常见不良反应(≥10%)包括注射部位反应(如,疼痛、红斑、肿胀或硬结)、潮热、体重增加、和血清转氨酶和γ-谷氨酰转移酶(GGT)水平增高。
药物相互作用:不可能有临床意义的细胞色素P450药物-药物相互作用。
特殊人群中的使用:
对老年人或有轻度或中度肝或肾功能障碍患者无需调整剂量。尚未研究有严重肝或肾功能障碍患者因而应谨慎。
日期:09/2010
 |
Firmagon
Company: Ferring Ireland Ltd.
Legal category: Prescription. Sport permitted.
Active ingredient: Degarelix (as acetate) 80mg, 120mg.
Description: Powder and solvent for solution for injection.
Presentation: 80mg-1; 120mg-2. Prices available on request.
Indication: Treatment of adult male patients with advanced hormone-dependent prostate cancer.
Pharmacology: Degarelix is a selective gonadotrophin releasing-hormone (GnRH) antagonist that competitively and reversibly binds to the pituitary GnRH receptors, thereby rapidly reducing the release of the gonadotrophins, luteinizing hormone (LH) and follicle stimulating hormone (FSH), and thereby reducing the secretion of testosterone (T) by the testes. Prostatic carcinoma is known to be androgen sensitive and responds to treatment that removes the source of androgen. Unlike GnRH agonists, GnRH antagonists do not induce a LH surge with subsequent testosterone surge/tumour stimulation and potential symptomatic flare after the initiation of treatment.
Dosage: Adult:Initially, 240mg as 2 subcutaneous injections of 120mg each. Monthly maintenance dose: 80mg administered as one subcutaneous injection. First maintenance dose to be given one month after initial dose. Monitor clinical effect by clinical parameters and prostate specific antigen (PSA) serum levels. Elderly: As per adults.
Contraindications: Hypersensitivity to the active substance or to any of the excipients.
Special precautions: Assess benefit vs risk: History of a corrected QT interval over 450msec, history of or risk factors for torsades de pointes. Caution: Known or suspected hepatic disorder (monitor liver function), severe renal impairment, diabetes. Long-term treatment may affect bone density.
Drug interactions:Assess benefit vs risk: Medicinal products known to prolong the QTc interval or medicinal products able to induce torsades de pointes such as class IA (e.g. quinidine, disopyramide) or class III (e.g. amiodarone, sotalol, dofetilide, ibutilide)antiarrhythmicmedicinalproducts,methadone,cisapride,moxifloxacine,antipsychotics.
Adverse drug reactions: Hot flush, injection site adverse events, insomnia, dizziness, headache, nausea, increased liver transaminases, hyperhidrosis, chills, pyrexia, asthenia, fatigue, influenza-like illness, increased weight.
A support service is available to Healthcare Professionals for the administration of the first two doses of Firmagon.
美国食品药物管理局(FDA)核准degarelix注射剂两种新剂量,用于治疗末期前列腺癌。
【Degarelix核准用于治疗末期前列腺癌】
2008年12月24日,FDA核准degarelix (Ferring药厂) 80-mg和120-mg注射剂,用于治疗末期前列腺癌病患。Degarelix是新的促性腺激素释放荷尔蒙受体拮抗剂,可逆性结合到脑垂体促性腺激素释放荷尔蒙受体,减少睪固酮之释出。
Degarelix之核准是根据一个开放标籤、多中心随机平行小组研究,对象是前列腺癌病患(N = 620);随机指派接受两种degarelix剂量之一或者leuprolide,为期一年:degarelix开始剂量240 mg、之后每月剂量160 mg、皮下给药,degarelix开始剂量240 mg、之后每月剂量80 mg、皮下给药,或者每月leuprolide 7.5 mg肌肉注射给药。
研究的初级目标是检视degarelix 在12个月治疗期间,达到维持睪固酮抑制到去势程度(≦ 50 ng/dL)的效果。结果显示,平均去势率:degarelix 240/160-mg组为98.3% (95%信心区间94.8% - 99.4%) ,degarelix 240/80-mg组为 97.2% (95%信心区间93.5% - 98.8%) ,leuprolide 7.5-mg组为 96.4% (95%信心区间92.5% - 98.2%)。degarelix组没有测得睪固酮波,96%病患在初次degarelix剂量之后3天达到去势 ,leuprolide组是0%。
以degarelix治疗的1,325名病患中,最常见的不良反应包括暂时性注射位置反应、热潮红、体重增加、转胺酶与珈玛麩胺酸转胜酵素(gamma-glutamyltransferase) 值增加。
Degarelix 的疗效应以週期性监测血清前列腺特定抗原值来监控,此外,长期雄性素去除疗法会延长QT 间隔。对于先天QT间隔长的病患、电解质异常病患、或者先天性心衰竭与服用IA类 (例如quinidine procainamide)或第三类(例如amiodarone) 抗心律不整药物者,医师应考量长期雄性素去除疗法之治疗利益与风险。
Degarelix只可以皮下给药。建议剂量是开始剂量240 mg、分开以120 mg给予,接著是每28天给予一次80mg维持剂量.
前列腺癌新药degarelix在III期临床中表现良好
有专家表示,III期临床试验结果显示,Ferring公司的新型前列腺癌治疗药degarelix取得了突破性效果。
在该药的III期临床试验中,对比了degarelix(每月用药一次)和标准药物(leuprorelin)的疗效,疗程为期12个月,两组受试者病情情况等同。结果表明,degarelix能更快控制血清睾酮水平和前列腺特异抗原(PSA),并且该药能在12个月的观察期内保持上述疗效。
有负责人称,degarelix临床试验终点数据还未出来,但就该药对PSA水平的快速控制可以延长患者的存活时间。试验也证实,这种新药的耐受性至少与目前标准治疗药物相当。值得指出的是,患者用药后,它未引起严重的全身性不良反应.

规格:
Degarelix80MG VIAL
DEGARELIX INJ 240MG 2X120MG 120MG VIALDegarelixDegarelix(注射剂)

| 
