| 中文品名:依诺他滨
药效类别:抗肿瘤药>安西他滨衍生物类
通用药名:ENOCITABINE
别 名:依诺胞苷, 山萮阿糖啶, Sunrabin, AS-18s,BH-AC, NSC-239336,BH阿糖胞苷N4,散癌星,散瘤星
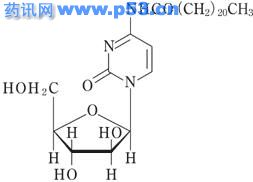
化学名称:Docosanamide, N-(1-β-Arabinofuranosyl-1,2-dihydro-2-oxo-4-pyrimidinyl)-
N4-山嵛酰-1-B-D-阿拉伯呋喃糖基胞嘧啶。
药理作用
少量本品对试验肿瘤细胞L-1210白血病细胞及人白血病细胞都有良好的抗肿瘤作用,起作用取决于总给药量,其最适有效量与最小有效量的比值大,由此推测可安全用于临床。其次本品对B-16黑色素瘤、路易斯肺癌、S-180肉瘤等实体瘤试验模型也明显的有抑制作用。
药动学
本品给药时血药浓度升高,以后慢慢减少,在血中的阿糖胞苷浓度较使用阿糖胞苷维持时间长、浓度高。脏器中浓度除脑内无分布外,在脾、骨髓、心、肝、肾内依次降低。本品主要在脾、肝、肾代谢为阿糖胞苷,并可由乳汁中排出。
适应证
急性白血病。
注意事项
对本品有严重过敏反应的患者禁用。肝功能障碍者、并发感染症患者慎用。治疗期间需经常检查外周血象和骨髓血象。本品对哺乳动物有致畸作用,所以孕妇只有治疗效益远超过危险性时才可应用。哺乳妇女使用本品应停止授乳。
不良反应
消化系统:食欲不振、恶心,有时呕吐、腹泻、口炎等;神经系统:有时困倦、腰痛;肝脏:肝功能障碍;皮肤:有时出现红斑、瘙痒等;变态反应:有时浮肿;过敏症:有时开始使用本品后立即出现皮疹、胸部压迫感、皮肤潮红等严重过敏症,需停药处理;休克:有时开始使用本品后立即出现与临床过敏反应类似的反应(血压下降、嗳气、皮疹、发绀等);其他:发热、有时感染、脱毛。
制剂规格
注射剂:150mg/支,200mg/支,250mg/支。
贮 藏:密闭、干燥、阴凉处保存。
用法用量
1天量3.5~6.0mg/kg,与果糖、葡萄糖、木糖醇、生理盐水、林格溶液或糖电解质注射液混合,每天1次或分2次在2~4h内静脉滴注。一般连续使用10~14天,或连用6~10天后终止给药,以后以同样的方法给药。
专家点评
单独应用本品于初治病例,完全缓解率为34%,部分缓解率为26%。经治病例的完全缓解率为14.8%,部分缓解率为25.9%。与其他药物合用可提高疗效。

【原产地英文商品名】SUNRABIN 250mg/vial 10vials/box
【原产地英文药品名】ENOCITABINE
【原产地英文化合物名称】Docosanamide, N-(1-β-Arabinofuranosyl-1,2-dihydro-2-oxo-4-pyrimidinyl)-
【中文参考商品译名】
注:以下产品不同规格和不同价格,购买时请以电话咨询为准!
·SUNRABIN 150毫克/瓶 10瓶/盒
·SUNRABIN 200毫克/瓶 10瓶/盒
·SUNRABIN 250毫克/瓶 10瓶/盒
【中文参考药品译名】依诺他滨
【生产厂家中文参考译名】旭化成工业株式会社
【生产厂家英文名】Asahi Kasei Pharmaceuticals

SPECIFICATIONS
Offered as 25 mg (sc-205310) and 100 mg (sc-205310A) sizes
CAS Number: 55726-47-1
Molecular Weight: 565.78
Molecular Formula: C31H55N3O6
Physical Appearance: Crystals
Solubility: Soluble in DMSO.
SMILES: CCCCCCCCCCCCCCCCCCCCCC(=O)NC1=NC(=O)N(C=C1)[C@@H]1
O[C@H](CO)[C@H](O)[C@H]1O
DESCRIPTION
Anti-tumor agent potentially for anti-leukemia treatment.An antineoplastic. A derivative of Cytarabine.
FOR RESEARCH USE ONLY

サンラビン点滴静注用150mg/サンラビン点滴静注用200mg/サンラビン点滴静注用250mg
商標名
SUNRABIN for Injection
一般名
エノシタビン(Enocitabine)
化学名
N4-behenoyl-1-β-D-arabinofuranosylcytosine
略号
BH-AC
分子式
C31H55N3O6
構造式
分子量
565.78
融点
145~150℃(分解)
性状
本品は白色の結晶性の粉末である。
本品はテトラヒドロフランに溶けにくく、エタノールに極めて溶けにくく、水又はエーテルにほとんど溶けない。
効能又は効果
用法及び用量
通常、1日量、体重1kg当り3.5~6.0mgを5%ブドウ糖注射液、5%果糖注射液、5%キシリット注射液、生理食塩液、リンゲル液又は糖電解質注射液に混合し、静脈内に2~4時間で1日1回又は2回に分割し点滴注射する。通常10~14日間連続投与を行うか、又は6~10日間連続投与後休薬期間をおいて同様の投与をくり返す。
用量及び投与期間については患者の末梢血及び骨髄の状態により適宜増減する。
使用上の注意
慎重投与(次の患者には慎重に投与すること)
1. 骨髄機能抑制のある患者[骨髄機能抑制を増悪させるおそれがある。]
2. 感染症を合併している患者[骨髄機能抑制により、感染を増悪させるおそれがある。]
3. 本人又は両親、兄弟に気管支喘息、発疹、蕁麻疹等のアレルギーを起こしやすい体質を持つ患者
4. 薬物過敏症の既往歴のある患者
5. 肝障害のある患者[肝障害を悪化させるおそれがある。]
重要な基本的注意
1. 骨髄機能抑制等の重篤な副作用が起こることがあるので、頻回に臨床検査(血液検査、肝機能・腎機能検査等)を行うなど、患者の状態を十分に観察すること。異常が認められた場合には減量・休薬等の適切な処置を行うこと。またこれらの副作用は、遷延性に推移することがあるので、投与は慎重に行うこと。
2. 感染症・出血傾向の発現又は増悪に十分注意すること。
3. 本剤の投与により、ときにショック等の重篤な過敏反応の発現がみられるので、使用に際しては少量注入後患者の状態をよく観察し、異常が認められた場合には、速やかに投与を中止し、適切な処置を行うこと。
4. ショック等を予測するため、投与に際してはアレルギー既往歴、薬物過敏症等について十分な問診を行うこと。
5. 小児及び生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。
6. 本剤の使用に際しては、「注射液の調製・保存方法」に従い、調製すること。
7. 本剤の添加物であるポリオキシエチレン硬化ヒマシ油を含有する医薬品でショックの発現が報告されているので、上記注意事項に留意すること。また、ポリオキシエチレン硬化ヒマシ油を含有する他の製剤で高脂血症がみられたとの報告がある。
相互作用
併用注意
(併用に注意すること)
薬剤名等
他の抗悪性腫瘍剤
臨床症状・措置方法
骨髄機能抑制等の副作用が増強することがある。
機序・危険因子
副作用が相互に増強される。
副作用
副作用等発現状況の概要
承認時及び使用成績調査における総症例3,007例中1,893例(63.0%)に副作用がみられた。主な副作用は悪心857例(28.5%)、嘔吐584例(19.4%)、食欲不振627例(20.9%)、肝機能障害468例(15.6%)、貧血418例(13.9%)、発熱407例(13.5%)等であった。
重大な副作用
1. ショック
(0.4%)
ショックを起こすことがあるので、観察を十分に行い、異常が認められた場合には、直ちに投与を中止し、適切な処置を行うこと。
2. 重篤な過敏症
(0.1%)
胸部圧迫感、発疹、皮膚の潮紅等の重篤な過敏症状があらわれることがあるので、このような症状があらわれた場合には、直ちに投与を中止し、適切な処置を行うこと。
3. 血液障害
(頻度不明)
汎血球減少、白血球減少、血小板減少、貧血、また、骨髄に巨赤芽球様細胞を認めることがあるので、定期的に血液検査を行うなど観察を十分に行い、異常が認められた場合には減量、休薬等の適切な処置を行うこと。
その他の副作用
1. 消化器
10%以上
食欲不振、悪心・嘔吐
2. 消化器
1~10%未満
下痢、腹痛、腹部膨満感、口内炎
3. 精神神経系
1~10%未満
けん怠感、頭痛
4. 精神神経系
1%未満
腰痛、眩暈、しびれ感
5. 肝臓
10%以上
ビリルビン、AST(GOT)、ALT(GPT)、Al-Pの上昇
6. 泌尿器
1~10%未満
BUN、クレアチニンの上昇
7. 泌尿器
1%未満
蛋白尿、頻尿
8. 皮膚
1~10%未満
脱毛
9. 皮膚
1%未満
紅斑、そう痒
10. その他
10%以上
発熱
11. その他
1%未満
浮腫、心悸亢進
高齢者への投与
高齢者では、一般に生理機能(造血機能、肝機能、腎機能等)が低下しているので、用量並びに投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。
妊婦、産婦、授乳婦等への投与
1. 妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[動物実験(ラット、ウサギ)の催奇形作用(胎児の骨格異常・外形異常)が報告されている。]
2. 授乳中の婦人に投与することを避け、やむを得ず投与する場合には授乳を中止させること。[動物実験(ウサギ)で母乳中へ移行することが報告されている。]
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していないので、慎重に投与すること。
適用上の注意
1. 注射液の調製・保存方法
本剤は、可溶化剤としてポリオキシエチレン硬化ヒマシ油60を使用しており、下記の調製・保存方法を必ず守ること。
(1) 調製方法
1) エノシタビン10mgに対し、日局注射用水を1mLの割合で加える。
2) バイアルを溶解ラックに入れ、あらかじめ沸騰させた水浴中で約10分間加熱する。その間、3回沸騰水浴中から取り出し、強く振り混ぜる(各回10秒間に10~15回程度)。
注意
本剤溶解操作時に溶解鍋の空焚きをしないこと。[空焚きによりバイアルが破裂し、内容液とガラス片が飛散するおそれがある。]
3) 沸騰水浴中から取り出し、小さな塊あるいは透明なゲル状物のない均一な乳白色の液が得られたことを確認する。
注意
乳白色の液が得られない場合は、再度上記(2)の操作を行う。
4) バイアルを熱い溶解ラックごと、好ましくは氷水中(流水中でも可)で約3分間振り混ぜながら急冷すると無色澄明な液が得られる。この溶液1.1mLには約10mgのエノシタビンが含まれる。
注意
無色澄明な液を得るためには、急冷することが最も重要なポイントであるため、放置しないこと。(急冷操作前にバイアルを放置する等により冷ましたような場合には、再度沸騰水浴中で加熱後、ただちに急冷操作を行う。)
5) 本剤の水溶液を輸液で希釈する際には、泡立ちを極力抑え、注入後の撹拌は穏やかに行う。(輸液容器の液中に本剤の水溶液を注入する針を浸けて注入するか、または壁を伝わせてゆっくり注入する。)
<詳細は別添「サンラビン点滴静注用の調製方法」を参照>
(2) 保存方法
本剤の水溶液(輸液希釈前)をやむを得ず保存する場合は、5℃以下で保存し、48時間以内に使用すること。
注意
輸液希釈前に、無色澄明であることを確認する。無色澄明でない場合は「1.調製方法(2)~(4)」に準じて再度調製すること。
2. 投与時
(1) 静脈内投与により、ときに静脈炎等を起こすことがあるので注射部位、注射方法等に十分注意すること。
(2) 静脈内投与に際し、薬液が血管外に漏れると、注射部位に疼痛、発赤、腫脹等の炎症を起こすことがあるので、慎重に投与すること。
3. その他
ポリ塩化ビニール製の点滴セット、カテーテル等から、可塑剤であるDEHP〔di-(2-ethylhexyl)phthalate:フタル酸ジ-(2-エチルヘキシル)〕が溶出するので、ポリ塩化ビニール製の点滴セット、カテーテル等の使用を避けること。
その他の注意
1. 本剤と他の抗悪性腫瘍剤を併用した患者に、急性白血病(前白血病相を伴う場合もある)、骨髄異形成症候群(MDS)が発生したとの報告がある。
2. マウスに静脈内投与した小核試験において、変異原性が認められている。
薬物動態
1. 血中濃度1)
急性白血病患者に注射用サンラビン200mgの1.5時間点滴静注を行い、血漿、血球中エノシタビン濃度を測定した。
血漿中エノシタビンの濃度変化は二相性を示し、その半減期は第一相で0.37±0.25時間、第二相で5.3±4.8時間であった。
一方、血球中のエノシタビン濃度は投与終了時までは血漿中と同じであったが、投与開始24時間後には血漿中の約10倍を示した。また、骨髄液中エノシタビン濃度は投与開始4時間後では血漿中とほぼ同じであったが、12時間後には血漿中より有意に高値を示した。
2. 代謝及び排泄1,2)
急性白血病患者に注射用サンラビン200mgを点滴静注したところ、血液中にはエノシタビンの他に代謝産物としてシタラビン及びウラシルアラビノシドが検出された。
尿中にはエノシタビンとしては排泄されず、投与開始24時間後までにシタラビンとして0.5%、ウラシルアラビノシドとして72%が排泄された。
臨床成績
1. 臨床効果3)
全国19施設において急性骨髄性白血病、急性前骨髄球性白血病、急性単球性白血病、急性リンパ性白血病、慢性骨髄性白血病の急性転化等を対象に注射用サンラビンの臨床試験を実施した。
注射用サンラビン 2.0~8.0mg/kgを6~35日間単独投与した場合の治療成績は未治療症例50例中、完全寛解17例(34.0%)、部分寛解13例(26.0%)であり、また既治療症例27例中、完全寛解4例(14.8%)、部分寛解7例(25.9%)であった。
多剤併用療法としては、BH-AC・DMP療法、BH-AC・AMP療法、BH-AC・DVP療法等が試みられたが、このうちBH-AC・DMP療法の治療成績は未治療症例141例中、完全寛解103例(73.0%)、部分寛解8例(5.7%)であった。
2. その他
小児科領域の急性白血病に対しては、現時点では十分に評価しうるデータは得られていない。
薬効薬理
1. 抗腫瘍作用4~6)
L1210及びヒトリンパ性白血病細胞(市川株)等の担癌マウスに対して延命効果を示す。
2. 作用機序7~11)
ヒトの肝、脾、腎及び白血病細胞で活性物質(シタラビン等)に徐々に変換・代謝されDNA合成阻害により抗腫瘍作用を示す
包装
**サンラビン点滴静注用 150mg:10バイアル
**サンラビン点滴静注用 200mg:10バイアル
**サンラビン点滴静注用 250mg:10バイアル
|