柠檬酸铁片剂Riona(Ferric Citrate Hydrate)
药品名称:ferric citrate
商品名称:FDA:FERRIC CITRATE® 日本 Riona®
中文药名:柠檬酸铁片剂
规格:日本250mg(柠檬酸铁)
适应症:
控制慢性肾疾病患者透析过程中血清磷水平的磷酸盐结合剂。
用法用量:
起始剂量为500mg,饭后立即给药,一天3次,此后根据症状、血磷浓度进行调整,最高剂量为1日6000mg。
作用机制
通过集中在磷酸铁(Fe3+的)的结合作用,在胃肠道内的膳食中通过偶联以形成不溶性的(磷酸铁)沉淀,是磷酸盐结合剂,抑制磷的新的胃肠道吸收。
国内外生产使用情况
日本2014年1月17日批准

リオナ錠250mg
作成又は改訂年月
**2016年1月改訂(第5版)
*2015年5月改訂
日本標準商品分類番号
87219
日本標準商品分類番号等
- 国際誕生年月
2014年1月
薬効分類名
高リン血症治療剤
承認等
- 販売名
リオナ錠250mg
販売名コード
2190033F1022
承認・許可番号
- 承認番号
22600AMX00005000
- 商標名
Riona Tab.250mg
薬価基準収載年月
2014年4月
販売開始年月
2014年5月
貯法・使用期限等
- 貯法
気密容器,室温保存(「取扱い上の注意」参照)
- 使用期限
3年(外箱等に表示の使用期限を参照のこと)
規制区分
- 処方箋医薬品注1)
注1)注意-医師等の処方箋により使用すること
組成
- 有効成分(1錠中)
クエン酸第二鉄水和物を無水物として(クエン酸第二鉄として)250mg含有
- 添加物
セルロース,ポリビニルアルコール・ポリエチレングリコール・グラフトコポリマー,ポリビニルアルコール・アクリル酸・メタクリル酸メチル共重合体,ヒドロキシプロピルセルロース,クロスポビドン,ステアリン酸Ca,ヒプロメロース,酸化チタン,タルク,ポリエチレングリコール
性状
- 性状・剤形
白色のフィルムコーティング錠
- 外形・上面

- 外形・側面
- サイズ
長径 約14.9mm,短径 約6.9mm,厚さ 約4.6mm
- 識別コード
JTP 751
一般的名称
クエン酸第二鉄水和物錠
禁忌
(次の患者には投与しないこと) - 本剤の成分に対し過敏症の既往歴のある患者
|
効能又は効果
慢性腎臓病患者における高リン血症の改善
用法及び用量
- 通常,成人には,クエン酸第二鉄として1回500mgを開始用量とし,1日3回食直後に経口投与する。以後,症状,血清リン濃度の程度により適宜増減するが,最高用量は1日6,000mgとする。
用法及び用量に関連する使用上の注意
・本剤投与開始時又は用量変更時には,1~2週間後に血清リン濃度の確認を行うことが望ましい。
- ・増量を行う場合は,増量幅をクエン酸第二鉄として1日あたりの用量で1,500mgまでとし,1週間以上の間隔をあけて行うこと。
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
- 1. 消化性潰瘍,炎症性腸疾患等の胃腸疾患のある患者[病態を悪化させるおそれがある。]
- 2. ヘモクロマトーシス等の鉄過剰である患者[病態を悪化させるおそれがある。]
- 3. C型慢性肝炎等の肝炎患者[病態を悪化させるおそれがある。]
- 4. 血清フェリチン等から鉄過剰が疑われる患者[鉄過剰症を引き起こすおそれがある。]
- 5. 他の鉄含有製剤投与中の患者[鉄過剰症を引き起こすおそれがある。]
- 6. 発作性夜間血色素尿症の患者[溶血を誘発し病態を悪化させるおそれがある。]
重要な基本的注意
- 1. 本剤は,血中リンの排泄を促進する薬剤ではないので,食事療法等によるリン摂取制限を考慮すること。
- 2. 本剤は,定期的に血清リン,血清カルシウム及び血清PTH濃度を測定しながら投与すること。血清リン,血清カルシウム及び血清PTH濃度の管理目標値及び測定頻度は,学会のガイドライン等,最新の情報を参考にすること。低カルシウム血症の発現あるいは悪化がみられた場合には,活性型ビタミンD製剤やカルシウム製剤の投与を考慮し,カルシウム受容体作動薬が使用されている場合には,カルシウム受容体作動薬の減量等も考慮すること。また,二次性副甲状腺機能亢進症の発現あるいは悪化がみられた場合には,活性型ビタミンD製剤,カルシウム製剤,カルシウム受容体作動薬の投与あるいは他の適切な治療法を考慮すること。
- 3. 本剤は消化管内で作用する薬剤であるが,本剤の成分である鉄が一部吸収されるため,血清フェリチン等を定期的に測定し,鉄過剰に注意すること。また,ヘモグロビン等を定期的に測定し,特に赤血球造血刺激因子製剤と併用する場合には,過剰造血に注意すること。
相互作用1)~7)
併用注意
(併用に注意すること)
- 1. 薬剤名等
甲状腺ホルモン剤
レボチロキシン等 - 臨床症状・措置方法
これら薬剤の作用を減弱させるおそれがあるので,併用する場合にはこれらの薬剤の作用を観察すること。
- 機序・危険因子
これら薬剤と結合し,吸収を減少させるおそれがある。
- 2. 薬剤名等
キノロン系抗菌剤
シプロフロキサシン等 - 臨床症状・措置方法
これら薬剤の作用を減弱させるおそれがあるので,併用する場合にはこれらの薬剤の作用を観察すること。
- 機序・危険因子
これら薬剤と結合し,吸収を減少させるおそれがある。
- 3. 薬剤名等
テトラサイクリン系抗生物質
テトラサイクリン等 - 臨床症状・措置方法
これら薬剤の作用を減弱させるおそれがあるので,併用する場合にはこれらの薬剤の作用を観察すること。
- 機序・危険因子
これら薬剤と結合し,吸収を減少させるおそれがある。
- 4. 薬剤名等
セフジニル - 臨床症状・措置方法
これら薬剤の作用を減弱させるおそれがあるので,併用する場合にはこれらの薬剤の作用を観察すること。
- 機序・危険因子
これら薬剤と結合し,吸収を減少させるおそれがある。
- 5. 薬剤名等
抗パーキンソン剤
ベンセラジド・レボドパ等 - 臨床症状・措置方法
これら薬剤の作用を減弱させるおそれがあるので,併用する場合にはこれらの薬剤の作用を観察すること。
- 機序・危険因子
これら薬剤と結合し,吸収を減少させるおそれがある。
- 6. 薬剤名等
エルトロンボパグ オラミン - 臨床症状・措置方法
これら薬剤の作用を減弱させるおそれがあるので,併用する場合にはこれらの薬剤の作用を観察すること。
- 機序・危険因子
これら薬剤と結合し,吸収を減少させるおそれがある。
- 7. 薬剤名等
経口アルミニウム製剤注2)
水酸化アルミニウムゲル
合成ケイ酸アルミニウム - 臨床症状・措置方法
他のクエン酸製剤との併用で血中アルミニウム濃度が上昇したとの報告があるので,同時に服用させないなど注意すること。
- 機序・危険因子
クエン酸との併用により,吸収が促進されるとの報告がある。
注2)透析療法を受けている患者へは投与禁忌である。
副作用
副作用等発現状況の概要
- 国内における本剤の主要な臨床試験において,801例中204例(25.5%)に副作用が認められた。主な副作用は,下痢,便秘,腹部不快感,血清フェリチン増加であった。(承認時)
その他の副作用
下記の副作用があらわれることがあるので,観察を十分に行い,異常が認められた場合は適切な処置を行うこと。
- 胃腸障害
2%以上
下痢(10.1%),便秘(3.2%),腹部不快感(2.5%)
- 胃腸障害
2%未満
腹部膨満,腹痛,十二指腸潰瘍,排便回数増加,胃腸障害,悪心,嘔吐,便通不規則
- 臨床検査
2%以上
血清フェリチン増加(2.7%)
- 臨床検査
2%未満
血中アルミニウム増加,γ-グルタミルトランスフェラーゼ増加,ヘマトクリット増加,ヘモグロビン増加
- その他
2%未満
赤血球増加症,肝機能異常,食欲減退,そう痒症,高血圧
高齢者への投与
- 一般に高齢者では生理機能が低下しているので,患者の状態を観察しながら慎重に投与すること。
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人,産婦及び授乳婦には,治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[これら患者への投与に関する安全性は確立していない。]
小児等への投与
小児等に対する安全性は確立していない(使用経験がない)。
適用上の注意
- 薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により,硬い鋭角部が食道粘膜に刺入し,更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
その他の注意
- 1. 本剤の投与により便が黒色を呈することがある。
- 2. 腹部のX線又はMRI検査で,本剤が存在する胃腸管の画像に未消化錠が写る可能性がある。
- 3. イヌを用いた長期反復投与毒性試験において,最大臨床用量の鉄として約5倍に相当する用量より,鉄の過剰蓄積に伴う肝臓の組織障害(慢性炎症巣,細胆管の増生及び肝実質の線維化)が認められた。これらの変化は休薬による回復性はなく,休薬期間中に病態の進行が認められた。
薬物動態
クエン酸第二鉄水和物に含まれる3価鉄は大部分が吸収されずに便中に排泄される。3価鉄は腸上皮細胞の還元酵素により一部が2価鉄に還元され吸収される8)。
なお,主な臨床試験において,本剤投与後に血清鉄濃度の上昇が認められている。
臨床成績
- 1. 血液透析患者
- (1) 比較試験9)
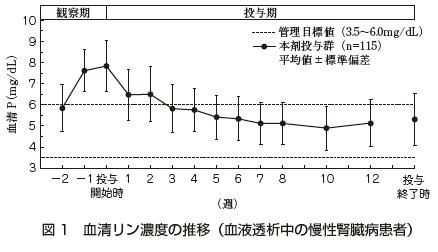
高リン血症を呈する血液透析中の慢性腎臓病患者225例(本剤115例,セベラマー塩酸塩110例)を対象とした比較試験において,本剤の投与を1日1,500mgから開始し,1日6,000mgまでの範囲で適宜増減し12週間投与した。その結果,血清リン濃度(平均値±標準偏差)は,投与開始時の7.84±1.19mg/dLに対して,投与終了時では5.31±1.23mg/dLと低下が認められた(図1)。
また,血清フェリチン(平均値±標準偏差)は,投与開始時の76.79±72.42ng/mLに対して,投与終了時では147.62±104.68ng/mLであった。
- (2) 長期投与試験10)
高リン血症を呈する維持血液透析施行中の慢性腎臓病患者180例を対象とし,本剤の投与を1日1,500mgから開始し,1日6,000mgまでの範囲で適宜増減し52週間投与した。その結果,血清リン濃度は,投与開始時5.53±1.24mg/dLに対して,投与終了時では5.42±1.32mg/dLと低下が維持された。
また,血清フェリチンは,投与開始時85.65±81.01ng/mL,28週時239.30±162.78ng/mL及び投与終了時246.71±169.30ng/mLであった。
- 2. 腹膜透析患者11)
高リン血症を呈する腹膜透析施行中の慢性腎臓病患者56例を対象として本剤の投与を1日1,500mgから開始し,1日6,000mgまで適宜増減し12週間投与した。その結果,血清リン濃度は,投与開始時6.75±1.09mg/dLに対して,投与終了時では4.49±0.94mg/dLと低下が認められた。
このうち19例を対象に,本剤を最長52週間継続投与した結果,投与終了時の血清リン濃度は,5.18±0.95mg/dLと低下が維持された。
また,継続投与例における血清フェリチンは,投与開始時138.64±81.60ng/mL,28週時472.28±161.79ng/mL及び投与終了時488.74±152.05ng/mLであった。
- 3. 保存期慢性腎臓病患者12),13)
高リン血症を呈する透析導入前の保存期慢性腎臓病患者86例(本剤57例,プラセボ29例)を対象とし,本剤の投与を1日1,500mgから開始して1日6,000mgまでの範囲で適宜増減し,プラセボを対照に12週間投与した。その結果,血清リン濃度は,投与開始時5.66±0.75mg/dLに対して,投与終了時では4.37±1.27mg/dLと低下が認められた(図2)。

本剤投与群のうち18例を対象に,本剤を最長52週間継続投与した結果,投与終了時の血清リン濃度は,4.63±1.06mg/dLと低下が維持された。
また,継続投与試験における血清フェリチンは,投与開始時72.33±61.86ng/mL,28週時334.00±172.46ng/mL及び投与終了時373.39±166.04ng/mLであった。
薬効薬理
- 1. 作用・効果
- (1) 血清リン濃度,カルシウム×リン積及び血清PTH濃度の低下作用14)
アデニン誘発腎不全ラットにおいて,クエン酸第二鉄水和物の混餌投与(1%又は3%)により,血清リン濃度,カルシウム×リン積及び血清PTH濃度の低下作用が認められた。
- (2) 異所性石灰化,二次性副甲状腺機能亢進症及び腎性骨異栄養症の進展抑制作用14)
アデニン誘発腎不全ラットにおいて,クエン酸第二鉄水和物の混餌投与(1%又は3%)により,腎臓及び大動脈におけるカルシウム沈着量が減少し,大動脈における石灰化(鉱質沈着)の抑制,副甲状腺過形成の抑制,並びに骨組織の多孔,線維化及び類骨形成の抑制が認められた。
- 2. 作用機序14)
クエン酸第二鉄水和物は,消化管内でリン酸と結合して消化管からのリン吸収を抑制することにより,血清リン濃度低下作用を示す。
有効成分に関する理化学的知見
- 一般名
クエン酸第二鉄水和物
Ferric Citrate Hydrate
- 化学名
クエン酸鉄(III)水和物
Iron(III)citrate hydrate
- 分子式
C6H8O7・xFe・yH2O
- 性 状
微褐色~褐色の粉末。塩酸に溶けやすく,水に極めて溶けにくく,エタノール(99.5)にほとんど溶けない。
取扱い上の注意
- アルミピロー開封後は湿気を避けて保存すること。
包装
リオナ錠250mg:100錠(10錠×10 PTP包装)
リオナ錠250mg:500錠(10錠×50 PTP包装)
リオナ錠250mg:1,000錠(10錠×100 PTP包装)
主要文献及び文献請求先
主要文献
1) Campbell NR, et al.. Ferrous sulfate reduces thyroxine efficacy in patients with hypothyroidism. Ann Intern Med. 1992, 117, 1010-1013
- 2) Lehto P, et al.. The effect of ferrous sulphate on the absorption of norfloxacin, ciprofloxacin and ofloxacin. Br J Clin Pharmacol. 1994, 37, 82-85
- 3) 宮崎浩行ほか. シプロフロキサシンの消化管吸収に及ぼすクエン酸第一鉄ナトリウムの影響. 病院薬学. 1995, 21, 488-494
- 4) 石橋丸應ほか. 薬の生体内動態(12). 薬局. 1987, 38, 1807-1813
- 5) Gothoni G, et al.. Iron-tetracycline interaction: effect of time interval between the drugs. Acta Med Scand. 1972, 191, 409-411
- 6) Neuvonen PJ, et al.. Inhibitory effect of various iron salts on the absorption of tetracycline in man. Eur J Clin Pharmacol. 1974, 7, 357-360
- 7) 新岡琢也ほか. 血清直接注入HPLC法による血清中Cefdinir(CFDN)測定法の確立と薬物相互作用解析への応用. 臨床薬理. 1995, 26, 145-146
- 8) Donovan A, et al.. The ins and outs of iron homeostasis. Physiology. 2006, 21, 115-123
- 9) JTT-751第III相臨床試験-血液透析患者を対象としたJTT-751のセベラマー塩酸塩との比較試験-(日本たばこ産業株式会社社内資料)
- 10) JTT-751第III相臨床試験-血液透析患者を対象としたJTT-751の長期投与における安全性及び有効性についての検討(2)-(日本たばこ産業株式会社社内資料)
- 11) JTT-751第III相臨床試験-腹膜透析患者を対象とした一般臨床試験-(日本たばこ産業株式会社社内資料)
- 12) JTT-751第III相臨床試験-透析導入前のCKD患者を対象としたJTT-751の有効性及び安全性についての検討(二重盲検比較試験)-(日本たばこ産業株式会社社内資料)
- 13) JTT-751第III相臨床試験-透析導入前のCKD患者を対象としたJTT-751の安全性及び有効性についての検討(継続投与試験)-(日本たばこ産業株式会社社内資料)
- 14) Iida A, et al.. Ferric Citrate Hydrate, a New Phosphate Binder, Prevents the Complications of Secondary Hyperparathyroidism and Vascular Calcification. Am J Nephrol. 2013, 37, 346-358
文献請求先
主要文献に記載の社内資料につきましても下記にご請求下さい。
鳥居薬品株式会社 お客様相談室
〒103-8439 東京都中央区日本橋本町3-4-1
TEL 0120-316-834
FAX 03-3231-6890
日本たばこ産業株式会社 医薬事業部 医薬情報部
**〒103-0023 東京都中央区日本橋本町3-4-1
製造販売業者等の氏名又は名称及び住所
- 製造販売元
日本たばこ産業株式会社
東京都中央区日本橋本町3-4-1
- 販売元
鳥居薬品株式会社
東京都中央区日本橋本町3-4-1
|







