派罗欣(聚乙二醇干扰素α-2a注射液)属于长效干扰素,即聚乙二醇干扰素α-2a,由上海罗氏制药有限公司研发生产,具有提高机体免疫和抗病毒作用。与普通干扰素相比,派罗欣代谢时间长,抗病毒作用持久,疗效也更显著。此外,派罗欣毒副作用明显减少,病人耐受性更好。
药理学试验与临床实践均证明,慢性乙肝、慢性丙肝患者使用派罗欣能获得良好疗效。
【药品名称】
商品名:派罗欣
通用名:聚乙二醇干扰素α-2a注射液
【成份】派罗欣主要成分为聚乙二醇干扰素α-2a
【性状】派罗欣为透明无色至淡黄色液体。
【作用机制】聚乙二醇干扰素α-2a(以下称本品)是聚乙二醇(PEG)与重组干扰素α-2a(以下称普通干扰素)结合形成的长效干扰素。干扰素可与细胞表面的特异性α受体结合,触发细胞内复杂的信号传递途径并激活基因转录,调节多种生物效应,包括抑制感染细胞内的病毒复制,抑制细胞增殖,并具有免疫调节作用。本品具有非聚乙二醇结合的α-干扰素(普通干扰素)的体外抗病毒和抗增殖活性。
药效学: 本品的药效学特点与天然的或普通的人α-干扰素相似,而药代动力学差别很大。40 KD的PEG部分的结构直接影响临床药理学特点,因为PEG部分的大小和支链结构决定了药物的吸收、分布和消除特点。
健康人单次皮下注射本品180 ug后3-6小时,抗病毒活性指标即血清2,5-寡腺苷酸合成酶(2,5-OAS)活性迅速升高。本品所诱导的2,5-OAS血清活性可维持1周以上,且比单次皮下注射3或18 MIU普通干扰素的活性高。与年轻人相比,62岁以上的老年人单次皮下注射本品180 ug,所产生的血清2,5-OAS活性强度和持续时间降低大约25%。
对明显肾功能不全的患者(肌酐清除率为20-40 mL/分),单次皮下注射本品90 ug后对2,5-OAS活性的反应弱于肌酐清除率在40-100 mL/分以上的患者,尽管两组的药物暴露量(AUC和Cmax)类似(见"注意事项"和"药代动力学")。
慢性丙型肝炎患者接受本品180 ug治疗会出现双相的HCV RNA滴度下降。在表现为持续病毒应答的患者及一些无持续病毒应答的患者中,第一相出现在开始用药后24-36小时。第二相出现在接下来的4-16周内。与普通α-干扰素相比,本品180 ug治疗增加了病毒清除和提高了治疗的病毒应答率。
【药代动力学】
吸收: 在健康受试者人群中,180 ug单次皮下注射后,血清浓度可在3-6小时内检测到。在24小时内,可达到血清浓度峰值的80%。注射后72-96小时可测到血清峰浓度(AUC 1743±459 ng/小时/mL,Cmax 14±2.5 ng/mL)。本品的绝对生物利用度是61-84%,与普通干扰素α-2a相似。
分布 :本品静脉注射后的稳态分布容积(Vd)为8-14 L,表明本品主要分布在血液和细胞外液中。在大鼠的物料平衡、组织学分布和全身放射自显影试验中,显示本品除了血液浓度较高外,还分布在肝脏、肾脏和骨髓中。
代谢: 本品的代谢机制尚未完全阐明。大鼠试验显示本品主要在肝脏中代谢,代谢物主要通过肾脏排出体外。
清除 男性对本品的系统清除率较内源性干扰素α低约100倍。静脉给药后,终末半衰期大约是60-80小时,而干扰素α一般仅3-4小时。皮下注射给药后,其终末半衰期更长(50-130小时)。皮下注射后的半衰期可能不仅反映该化合物的清除相,而且还反映了吸收相延长。
在健康人群和慢性乙型或丙型肝炎患者中每周给药1次血清中本品浓度与剂量成比例增长。
在慢性乙型或丙型肝炎患者中,每周给药1次,连续6-8周后,本品血清浓度可达单次给药的2-3倍。但8周后无进一步增长。使用48周后的峰谷比约为1.5-2.0。本品的血清浓度能够维持1周(168小时)。
特殊人群的药代动力学 :
肾功能不全患者 对23例肌酐清除率在高于100 mL/分(肾功能正常)到20 mL/分(严重肾功能不全)的患者的研究显示,本品的药代动力学与肌酐清除率无显著相关。肾功能受损对本品药代动力学影响很小,因此肾功能不全患者无需调整剂量(肌酐清除率>20 mL/分 ;见“用法用量”和“注意事项”)。
对进行血液透析的终末期肾病患者,本品的清除降低了25-40%,首剂135 ug剂量产生的暴露量与肾功能正常患者180 ug剂量产生的暴露量类似。
性别差异 本品单次皮下注射的药代动力学特点在健康男性和女性中相似。
老年患者 62岁以上的老年受试者在给予单次皮下注射180 ug后对本品的吸收较年轻受试者延迟,但仍呈持续吸收。两者达峰时间分别为115小时和82小时 ;AUC轻度增加(分别为1663和1295 ng/小时/mL) ;但峰浓度相似(分别为9.1和10.3 ng/mL)。根据药物利用度、药效学应答和药物耐受性特点,老年患者不需要降低剂量(见“用法用量”)。
无肝硬化和肝硬化患者 本品在健康受试者中和在慢性乙型或丙型肝炎患者中的药代动力学特点均类似。丙型肝炎代偿期肝硬化患者(代偿期,Child-Pugh A级)和无肝硬化患者的血浆浓度和药代动力学参数具有可比性。
目前尚无用于肝功能失代偿患者的资料。
注射部位 本品皮下注射部位应限于腹部和大腿。研究表明与注射腹部和大腿相比,注射在上肢时本品的生物利用度下降(见“用法用量”)。
【适应症】
1.慢性乙型肝炎 :本品适用于治疗成人慢性乙型肝炎。患者不能处于肝病失代偿期,慢性乙型肝炎必须经过血清标志物(转氨酶升高、HBsAg,HBV DNA)确诊。通常也需获取组织学证据。
2.慢性丙型肝炎 :本品适用于治疗之前未接受过治疗的慢性丙型肝炎成年患者。患者必须无肝脏失代偿表现,慢性丙型肝炎须经血清标记物确证(抗HCV抗体和HCV RNA)。通常诊断要经组织学确证。
3.治疗本病时本品最好与利巴韦林联合使用。
4.在对利巴韦林不耐受或禁忌时可以采用本品单药治疗。尚未对转氨酶正常的患者进行本品单药治疗的研究。
【不良反应】派罗欣的不良反应的频率和严重性与普通干扰素α-2a相似。只是与其相比,派罗欣的血液学不良反应更常见。
1、血液和淋巴系统异常:淋巴结肿大、贫血和血小板减少。
2、内分泌异常:甲状腺功能减退和甲状腺功能亢进。
3、精神和神经系统异常:记忆力障碍、味觉改变、感觉异常、感觉迟钝、震颤、情感障碍、情绪改变、神经过敏、攻击意识、性欲减退、阳痿。
4、眼部异常:视物模糊、眼干、眼部炎症、眼痛(参见“注意事项”)。
5、心脏异常:心悸。
6、呼吸、胸部和纵膈异常:上呼吸道感染、咽痛、鼻炎、鼻咽炎、鼻窦充血、肺充血、胸部紧缩感、劳累性呼吸困难、鼻出血。
7、胃肠道异常:胃炎、腹胀、口干、口腔溃疡、牙龈出血、牙龈炎、唇炎、便秘。
8、皮肤和皮下组织异常:皮肤疾病、皮疹、湿疹、牛皮癣、荨麻疹、光过敏反应、多汗、盗汗。
9、骨骼肌、结缔组织和骨骼异常:骨痛、背痛、颈部疼痛、肌肉痉挛、肌肉无力、骨骼肌疼痛。
10、全身异常和注射局部反应:流感样疾病、不适、嗜睡、寒颤、潮热、虚弱、单纯疱疹、胸痛。
与其他干扰素相同,临床试验中派罗欣与利巴韦林联合或派罗欣单药治疗观察到的罕见或孤立的不良事件包括:下呼吸道感染、注射部位坏死、皮肤感染、外耳炎、心内膜炎、抑郁、自杀企图、药物过量、肝功能障碍、脂肪肝、胆管炎、肝癌、消化道溃疡、胃肠道出血、可逆性胰腺反应(包括淀粉酶和脂肪酶升高,伴或不伴腹痛)、心律失常、房颤、心包炎、眩晕、自身免疫现象(包括特发性血小板减少性紫癜、甲状腺炎、牛皮癣、类风湿性关节炎、系统性红斑狼疮)、肌痛、骨痛、肌炎、外周神经病、结节病、致死性间质性肺炎、肺栓塞、角膜溃疡、视网膜病变、视神经病变、视力丧失、昏迷和脑出血。
【注意事项】已有使用α干扰素治疗导致自身免疫性疾病加重的报道。对伴有自身免疫性疾病的患者应慎用本品。与其它干扰素一样,已观察到使用本品导致的低血糖症和高血糖症。使用α-干扰素可引起牛皮癣的加重。伴有牛皮癣的患者应慎用,如果使用中出现牛皮癣复发和恶化征象,应考虑停药。与其它α-干扰素一样,已有用药期间出现肺部症状的报道,包括呼吸困难、肺浸润、肺炎、局限性肺炎包括死亡。如果肺浸润持续存在或出现原因不明的肺功能异常,应停用。目前已有个别使用α干扰素导致眼科疾患的报道,包括视网膜出血、盲点、视网膜静脉或动脉阴塞。任何使用派罗欣的患如出现视力下降或视野缺失必须进行眼科检查。
【用法与用量】本品须由有经验的治疗慢性乙型和丙型肝炎的内科医师开始治疗。与利巴韦林联合使用时请同时参阅利巴韦林的说明书。
慢性乙型肝炎 用于慢性乙型肝炎患者时本品的推荐剂量为每次180 ug,每周1次,共48周,腹部或大腿皮下注射。其他剂量和疗程尚未进行充分的研究。
慢性丙型肝炎 本品单药或与利巴韦林联合应用时的推荐剂量为每次180 ug,每周1次,腹部或大腿皮下注射。联合治疗时同时口服利巴韦林。
与本品联合治疗的利巴韦林的剂量取决于病毒的基因型 :基因型2或3型剂量为每日口服800 mg ;基因型1型剂量为根据体重每日口服1000-1200 mg。
利巴韦林应在进餐时服用。
慢性丙型肝炎的治疗疗程 :与利巴韦林联合治疗慢性丙型肝炎的疗程决定于病毒基因型。HCV基因型1型不论病毒载量如何均应治疗48周,HCV基因型2/3型不论病毒载量如何应治疗24周。
丙型肝炎患者联合治疗的推荐剂量和疗程 :
基因型1型 :本品每周剂量为180 ug ;利巴韦林剂量为<75 kg=1000 mg/日,≥ (greater than or equal to) 75 kg=1200 mg/日 ;疗程48周。
基因型2/3型 :本品每周剂量为180 ug ;利巴韦林剂量为800 mg/日,疗程24周。
通常HCV基因型4型感染的患者治疗困难,有限的研究数据(n=66)中所用剂量与HCV基因型1型的治疗剂量一致。因为目前缺乏可用的数据,所以HCV基因型5或6型的治疗也考虑使用同样的剂量。
不论病毒基因型如何,本品单药治疗的推荐疗程为48周。
12周后丙型肝炎病毒应答的预测 本品单药或与利巴韦林联合治疗12周内未出现病毒应答[HCV RNA未下降到50 IU/mL以下,相当于100拷贝/mL,或至少未下降到基线的1%以下(2 log10)]的HCV基因型1型患者应考虑终止治疗。
HCV基因型2/3型96例患者中93例在12周内出现病毒应答。因此HCV基因型2/3型患者不论12周时病毒应答与否都应治疗24周。
本品治疗12周尚未出现早期病毒应答的患者继续治疗时很少能获得持续的病毒应答(<5%)。
发生不良反应时的剂量调整
剂量调整的原则 :对于由于中度和重度不良反应(包括临床表现和/或实验室指标异常)必须调整剂量的患者,初始一般减至135 ug,但有些病例需要将剂量减至90 ug或45 ug。随着不良反应的减轻,可以考虑逐渐增加或恢复到初始剂量(见“注意事项”及“不良反应”)。
(见表6)
当中性粒细胞计数(ANC)<750个/mm3时,应考虑减量 ;当中性粒细胞计数(ANC)<500个/mm3时,应考虑暂时停药,直到ANC恢复到大于1000个/mm3时,可再恢复治疗。重新治疗开始应使用90 ug,并应监测中性粒细胞计数。
当血小板计数<5万个/mm3时,应将本品剂量减低至90 ug ;当血小板计数低于25000个/mm3时,应考虑停药。
在丙型肝炎患者治疗中出现治疗相关的贫血时特别推荐采取下列步骤处理 :患者无明显心血管疾病,出现血红蛋白<10 g/dl和≥ (greater than or equal to) 8.5 g/dl ;或当患者心血管疾病稳定,在治疗期间的任意4周内血红蛋白下降≥ (greater than or equal to) 2 g/dl时利巴韦林应减量至600 mg/日(早晨200 mg,晚上400 mg)。不推荐恢复至最初的用药剂量。出现下列情况时利巴韦林应暂停使用 :患者无明显心血管疾病,血红蛋白确实下降至8.5 g/dl以下 ;或者患者心血管疾病稳定,在减量治疗4周后血红蛋白仍持续低于12 g/dl。当恢复正常值后可重新开始使用利巴韦林600 mg/日,经主治医师决定可以进一步增加到800 mg/日,但不推荐恢复至最初的剂量。
如果对利巴韦林不耐受,可以继续本品单药治疗(见“用法用量”)。
当本品和利巴韦林联合使用时,请参阅利巴韦林发生不良反应时剂量调整的说明书。
肝脏功能 慢性肝炎患者肝功能经常出现波动。与其它α干扰素相同,使用本品治疗后,也会发生ALT升高,包括病毒应答改善的患者。当丙型肝炎患者出现ALT持续升高时,应考虑将剂量减至135 ug。减量后,如ALT仍持续升高,或发生胆红素升高或肝功能失代偿时,应考虑停药。
慢性乙型肝炎患者常见到ALT一过性升高,峰值超过正常上限的10倍。出现峰值提示发生了免疫清除(血清转换)。在峰值后继续治疗时应考虑增加肝功能监测次数。如果本品剂量减小或暂时停止了治疗,当ALT水平正常后可以继续恢复常规治疗(见“注意事项”)。
【规格】0.5ml:180μg
【贮存】密封、避光、2-8°C保存在原包装中。请勿冷冻
【有效期】两年
【批准文号】国药准字J20070055
【生产企业】上海罗氏制药有限公司
|
编号 |
药品名称 |
通用名 |
产地 |
规格 |
单位 |
参考价 |
| 8805 | 维拉克 | 利巴韦林胶囊 | 浙江诚意药业有限公司 | 0.15g*20粒 | 盒 | 6.30 |
| 8806 | 佩乐能 | 聚乙二醇干扰素α-2b注射剂 | SP(brinny) Company | 50μg | 支 | 1000 |
| 8807 | 佩乐能 | 聚乙二醇干扰素α-2b注射剂 | SP(brinny) Company | 80μg | 支 | 1300 |
| 8808 | 佩乐能 | 聚乙二醇干扰素α-2b注射剂 | SP(brinny) Company | 100μg | 支 | 1600 |
| 8809 | 派罗欣 | 聚乙二醇干扰素α-2a注射液 | 上海罗氏制药有限公司 | 180μg/0.5ml | 盒 | 1350 |
丙肝是临床常见的传染性肝病,主用通过血液或血液制品传播。慢性丙肝临床表现通常无特异性,病程进展缓慢,后期多发展为肝硬化甚至肝细胞性肝癌。干扰素是目前治疗慢性丙型肝炎最有效药物,干扰素能清除或抑制慢性丙型肝炎患者体内的HCV复制,减少肝细胞的损伤。
派罗欣--药效更持久的长效干扰素
派罗欣(聚乙二醇干扰素)是一种新型抗病毒治疗药物,是聚乙二醇(PEG)与重组干扰素α-2a结合形成的长效干扰素,具有适用范围广,疗效较好,治疗手段简单等特点。
1、属于长效干扰素,具有提高机体免疫和抗病毒作用。与普通干扰素相比,派罗欣代谢时间长,抗病毒作用持久,疗效也更显著,此外,它毒副作用明显减少,病人耐受性更好。
2、本品与核苷类抗乙肝病毒药物相比,疗程可控(一般半年或一年),停药后仍有较长时间的后续疗效,且具有明显提高乙肝治愈率的作用。
3、是目前国际公认治疗丙肝的“金标准”。
派罗欣较阿德福韦可更明显降低HBeAg阳性拉米夫定耐药慢性乙肝患者的HBsAg水平:一项来自多中心随机对照临床研究的结果
研究目的
通过随机对照临床研究比较派罗欣和阿德福韦在HBeAg阳性拉米夫定耐药患者中的疗效及安全性
研究方法
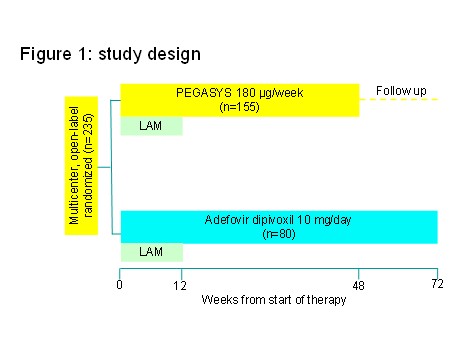
来自于中国13个临床研究中心的235例病人参加了这项随机、开放、对照研究
经过检查证实存在YMDD变异的HBeAg阳性慢性乙肝患者按2:1的比例随机分配到两组:派罗欣组或阿德福韦组。派罗欣组患者接受派罗欣180 µg/周治疗48周,停药后继续随访24周;阿德福韦组患者接受阿德福韦10mg/日治疗72周,所有患者在研究开始的前12周同时接受拉米夫定100mg/日治疗 (图1)
在基线、24周、48周用Architect方法对HBsAg水平进行定量检测(Abbott Diagnostics)
研究终点包括:
§ HBeAg血清学转换
§ HBeAg清除
§ HBsAg清除
§ HBV DNA<400 copies/mL
本次报告的是中期分析(48周)的研究结果
结果
基线人口学资料
235例符合入组条件的慢乙肝患者随机后有155例接受派罗欣治疗48周,80例接受阿德福韦治疗72周
所有完成48周治疗的患者均包括在中期分析报告中(按合格病例统计)
两组患者的基线资料具有可比性((表1)
|
表1: 患者基线资料 | |||
|
派罗欣 (n=155) |
阿德福韦 (n=80) | ||
|
年龄 (岁) |
均数± 标准差 |
34.4 ± 9.2 |
33.9 ± 8.8 |
|
男性 |
n (%) |
130 (83.9) |
67 (83.8) |
|
Anti HBe阴性 |
n (%) |
149 (96.1) |
79 (98.8) |
|
Anti HBs阴性 |
n (%) |
154 (99.4) |
79 (98.8) |
|
HBV DNA (log10) |
均数± 标准差 |
7.35 ± 0.97 |
7.39 ± 1.17 |
|
HBsAg (log10) |
均数± 标准差 |
4.07 ± 0.56 |
3.97 ± 0.74 |
|
ALT (U/L) |
中位数 (最小值, 最大值 |
74.0 (9.0, 1776) |
61.5 (7.0, 698) |
|
肝功能异常* |
n (%) |
115 (74.2) |
57 (71.3) |
* ALT正常值定义为8-45 U/L
HBsAg水平的变化
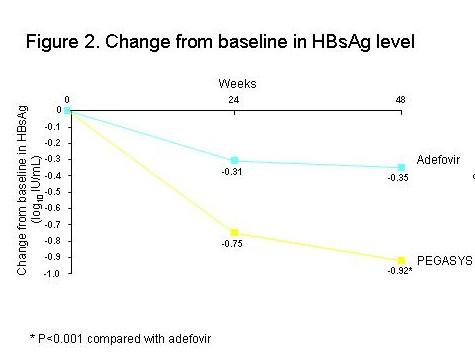
基线HBsAg水平在两组患者中无明显差别(表1)。与基线相比,治疗48周时HBsAg水平在派罗欣组较阿德福韦组下降更显著(分别为-0.94 IU/mL和-0.35 IU/mL, P<0.001)(图2)
派罗欣组有6例患者在48周时出现HBsAg消失,而阿德福韦组患者没有出现HBsAg消失病例(P=0.098)
派罗欣组有1例患者在48周时取得HBsAg血清学转换,而阿德福韦组没有出现HBsAg血清学转换
HBV DNA水平的变化
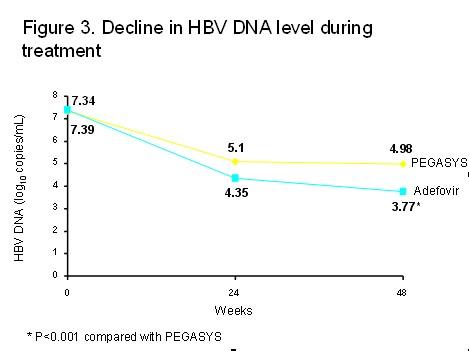
与基线相比,48周时HBV DNA水平的下降在阿德福韦组较派罗欣组更加显著 (P<0.001) (图3)。 但有趣的是,两组患者中取得HBV DNA低于400 copies/ml的患者比例无明显差别(派罗欣组和阿德福韦组分别为28.4%和28.8%, P=NS)
HBeAg应答情况
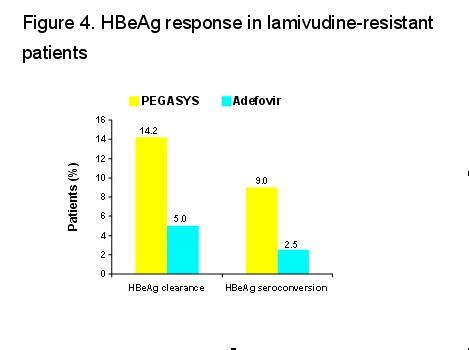
治疗48周时,派罗欣组患者发生HBeAg消失和HBeAg血清学转换的比例要高于阿德福韦组(图4)
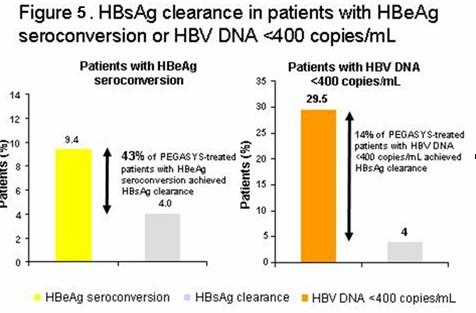
派罗欣组发生HBsAg消失的6例患者均取得了HBeAg血清学转换,因此发生HBeAg血清学转换的患者中43%出现HBsAg消失(图5)
48周时,派罗欣治疗组取得HBV DNA<400 copies/ml的患者中,发生HBsAg消失的比例达到14%(图5)
小结
本研究中期分析报告显示派罗欣在治疗拉米夫定耐药患者方面有一定优势
尽管阿德福韦治疗组HBV DNA下降幅度更大,但取得HBV DNA<400 copies/ml的患者比例两组间无明显差别
与阿德福韦治疗相比,派罗欣治疗可取得更高的HBeAg消失和HBeAg血清学转换率
与基线相比,48周时HBsAg定量水平的下降在派罗欣组较阿德福韦组更加明显
相比阿德福韦组,派罗欣组有一部分患者取得HBsAg消失,而且在发生HBeAg血清学转换的患者中HBsAg消失比例较高
本研究中派罗欣治疗48周的效果与过去的研究结果类似,而且停药后应答率可能会继续提高