一般的名称
ブロナンセリン錠、ブロナンセリン散
禁忌
(次の患者には投与しないこと)
1.
昏睡状態の患者〔昏睡状態が悪化するおそれがある。〕
2.
バルビツール酸誘導体等の中枢神経抑制剤の強い影響下にある患者〔中枢神経抑制作用が増強される。〕
3.
アドレナリン、アゾール系抗真菌剤、HIVプロテアーゼ阻害剤を投与中の患者〔「相互作用」の項参照〕
4.
本剤の成分に対し過敏症の既往歴のある患者
|
効能又は効果/用法及び用量
統合失調症
通常、成人にはブロナンセリンとして1回4mg、1日2回食後経口投与より開始し、徐々に増量する。維持量として1日8~16mgを2回に分けて食後経口投与する。
なお、年齢、症状により適宜増減するが、1日量は24mgを超えないこと。
用法及び用量に関連する使用上の注意
1.
本剤の吸収は食事の影響を受けやすく、有効性及び安全性は食後投与により確認されているため、食後に服用するよう指導すること。〔空腹時に投与すると、食後投与と比較して吸収が低下し、作用が減弱するおそれがある。また空腹時で投与を開始し、食後投与に切り替えた場合には血中濃度が大幅に上昇するおそれがある。「薬物動態」、「臨床成績」の項参照〕
2.
本剤の投与量は必要最小限となるよう、患者ごとに慎重に観察しながら調節すること。
**使用上の注意
慎重投与
(次の患者には慎重に投与すること)
1.
心・血管系疾患、低血圧、又はそれらの疑いのある患者〔一過性の血圧降下があらわれることがある。〕
2.
パーキンソン病のある患者〔錐体外路症状が悪化するおそれがある。〕
3.
てんかん等の痙攣性疾患、又はこれらの既往歴のある患者〔痙攣閾値を低下させるおそれがある。〕
4.
自殺企図の既往及び自殺念慮を有する患者〔症状を悪化させるおそれがある。〕
5.
肝障害のある患者〔血中濃度が上昇するおそれがある。〕
6.
糖尿病又はその既往歴のある患者、あるいは糖尿病の家族歴、高血糖、肥満等の糖尿病の危険因子を有する患者〔血糖値が上昇することがある。〕
7.
高齢者〔「高齢者への投与」の項参照〕
8.
低出生体重児、新生児、乳児、幼児又は小児〔「小児等への投与」の項参照〕
9.
薬物過敏症の患者
10.
脱水・栄養不良状態等を伴う身体的疲弊のある患者〔悪性症候群(Syndrome malin)が起こりやすい。〕
重要な基本的注意
1.
眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。
2.
興奮、誇大性、敵意等の陽性症状を悪化させる可能性があるので観察を十分に行い、悪化がみられた場合には他の治療法に切り替えるなど適切な処置を行うこと。
3.
本剤は肝酵素により代謝を受けやすく、血中濃度が大幅に上昇するおそれがあるため、CYP3A4を強く阻害する薬剤(アゾール系抗真菌剤、HIVプロテアーゼ阻害剤)を投与中の患者に本剤を投与しないこと(「相互作用」の項参照)。また、それ以外でも肝障害のある患者(「慎重投与」の項参照)、高齢者(「高齢者への投与」の項参照)、CYP3A4阻害作用を有する薬剤を併用している患者では、血中濃度が高くなる可能性があるので、観察を十分に行い慎重に投与すること。
4.
本剤の投与により血糖上昇が認められており、また、類薬において高血糖や糖尿病の悪化があらわれ、糖尿病性ケトアシドーシス、糖尿病性昏睡に至ることがあるとの報告があるので、本剤投与中は、口渇、多飲、多尿、頻尿等の症状の発現に注意するとともに、特に糖尿病又はその既往歴あるいはその危険因子を有する患者については、血糖値の測定等の観察を十分に行うこと。〔「慎重投与」、「重大な副作用(類薬)」の項参照〕
5.
本剤の投与に際し、あらかじめ上記(4)の副作用が発現するおそれがあることを、患者及びその家族に十分説明し、口渇、多飲、多尿、頻尿等の異常に注意し、このような症状があらわれた場合には、直ちに投与を中止し、医師の診察を受けるよう、指導すること。〔「慎重投与」、「重大な副作用(類薬)」の項参照〕
6.
抗精神病薬において、肺塞栓症、静脈血栓症等の血栓塞栓症が報告されているので、不動状態、長期臥床、肥満、脱水状態等の危険因子を有する患者に投与する場合には注意すること。〔「重大な副作用」の項参照〕
相互作用
本剤は、主として薬物代謝酵素CYP3A4 で代謝される。〔「薬物動態」の項参照〕
併用禁忌
(併用しないこと)
薬剤名等
アドレナリン(ボスミン)
臨床症状・措置方法
アドレナリンの作用を逆転させ、重篤な血圧降下を起こすことがある。
機序・危険因子
アドレナリンはアドレナリン作動性α、β-受容体の刺激剤であり、本剤のα- 受容体遮断作用により、β-受容体刺激作用が優位となり、血圧降下作用が増強される。
薬剤名等
CYP3A4を強く阻害する薬剤
アゾール系抗真菌剤(外用剤を除く)
ケトコナゾール(経口剤:国内未発売)
イトラコナゾール(イトリゾール)
等
HIVプロテアーゼ阻害剤
リトナビル(ノービア)
サキナビル(フォートベイス)
等
臨床症状・措置方法
本剤の血中濃度が上昇し、作用が増強するおそれがある。
機序・危険因子
本剤の主要代謝酵素であるCYP3A4を阻害するため、経口クリアランスが減少する可能性がある。外国において、ケトコナゾールとの併用により本剤のAUCが17倍、Cmaxが13倍に増加したとの報告がある。〔「薬物動態」の項参照〕
|
併用注意
(併用に注意すること)
薬剤名等
中枢神経抑制剤
アルコール
臨床症状・措置方法
相互に作用を増強することがあるので、減量するなど慎重に投与すること。
機序・危険因子
本剤及びこれらの薬剤等の中枢神経抑制作用による。
薬剤名等
ドパミン作動薬
レボドパ製剤
ブロモクリプチン等
臨床症状・措置方法
相互に作用が減弱することがある。
機序・危険因子
本剤はドパミン受容体遮断作用を有していることから、ドパミン作動性神経において、作用が拮抗することによる。
薬剤名等
降圧薬
臨床症状・措置方法
降圧作用が増強することがある。
機序・危険因子
本剤及びこれらの薬剤の降圧作用による。
薬剤名等
エリスロマイシン
臨床症状・措置方法
本剤の血中濃度が上昇し、作用が増強するおそれがあるので、観察を十分に行い、必要に応じて減量するなど慎重に投与すること。
機序・危険因子
本剤の主要代謝酵素であるCYP3A4を阻害するため、経口クリアランスが減少する可能性がある。エリスロマイシンとの併用により本剤のAUCが2.7倍、Cmaxが2.4倍に増加したとの報告がある。〔「薬物動態」の項参照〕
薬剤名等
グレープフルーツジュース
臨床症状・措置方法
本剤の血中濃度が上昇し、作用が増強するおそれがあるので、観察を十分に行い、必要に応じて減量するなど慎重に投与すること。
機序・危険因子
本剤の主要代謝酵素であるCYP3A4を阻害するため、経口クリアランスが減少する可能性がある。グレープフルーツジュースとの併用により本剤のAUC、Cmaxが1.8倍に増加したとの報告がある。〔「薬物動態」の項参照〕
薬剤名等
CYP3A4阻害作用を有する薬剤
クラリスロマイシン
シクロスポリン
ジルチアゼム等
臨床症状・措置方法
本剤の血中濃度が上昇し、作用が増強するおそれがあるので、観察を十分に行い、必要に応じて減量するなど慎重に投与すること。
機序・危険因子
本剤の主要代謝酵素であるCYP3A4を阻害するため、経口クリアランスが減少する可能性がある。
薬剤名等
CYP3A4誘導作用を有する薬剤
フェニトイン
カルバマゼピン
バルビツール酸誘導体
リファンピシン等
臨床症状・措置方法
本剤の血中濃度が低下し、作用が減弱するおそれがある。
機序・危険因子
本剤の主要代謝酵素であるCYP3A4を誘導するため、経口クリアランスが増加する可能性がある。
**副作用
副作用等発現状況の概要
承認時までの臨床試験において、891例中673例(75.5%)に臨床検査値異常を含む副作用が認められた。主な副作用は振戦、運動緩慢、流涎過多等のパーキンソン症候群(35.0%)、アカシジア(24.1%)、不眠(22.4%)、プロラクチン上昇(19.6%)、ジスキネジア(14.0%)、眠気(11.8%)、不安・焦燥感・易刺激性(11.2%)等であった。
重大な副作用
1. 悪性症候群(Syndrome malin)(5%未満)
無動緘黙、強度の筋強剛、嚥下困難、頻脈、血圧の変動、発汗等が発現し、それに引き続き発熱がみられる場合は、投与を中止し、体冷却、水分補給等の全身管理とともに適切な処置を行うこと。本症発症時には、白血球の増加や血清CK(CPK)の上昇がみられることが多く、また、ミオグロビン尿を伴う腎機能の低下がみられることがある。なお、高熱が持続し、意識障害、呼吸困難、循環虚脱、脱水症状、急性腎不全へと移行し、死亡することがある。
2. 遅発性ジスキネジア(5%未満)
長期投与により、口周部等の不随意運動があらわれることがあるので、このような症状があらわれた場合は減量又は中止を考慮すること。なお、投与中止後も症状が持続することがある。
3. 麻痺性イレウス(頻度不明)
腸管麻痺(食欲不振、悪心・嘔吐、著しい便秘、腹部の膨満あるいは弛緩及び腸内容物のうっ滞等の症状)を来し、麻痺性イレウスに移行することがあるので、腸管麻痺があらわれた場合には、投与を中止するなど適切な処置を行うこと。なお、本剤は動物実験(イヌ)で制吐作用が認められたため、悪心・嘔吐を不顕性化する可能性があるので注意すること。
4. 横紋筋融解症(頻度不明)
横紋筋融解症があらわれることがあるので、筋肉痛、脱力感、CK(CPK)上昇、血中及び尿中ミオグロビン上昇等が認められた場合には投与を中止し、適切な処置を行うこと。また、横紋筋融解症による急性腎不全の発症に注意すること。
5. 無顆粒球症、白血球減少(頻度不明)
無顆粒球症、白血球減少があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
6. 肺塞栓症、深部静脈血栓症(頻度不明)
抗精神病薬において、肺塞栓症、静脈血栓症等の血栓塞栓症が報告されているので、観察を十分に行い、息切れ、胸痛、四肢の疼痛、浮腫等が認められた場合には、投与を中止するなど適切な処置を行うこと。〔「重要な基本的注意」の項参照〕
重大な副作用(類薬)
1. 抗利尿ホルモン不適合分泌症候群(SIADH)
他の抗精神病薬で、低ナトリウム血症、低浸透圧血症、尿中ナトリウム排泄量の増加、高張尿、痙攣、意識障害等を伴う抗利尿ホルモン不適合分泌症候群(SIADH)があらわれたとの報告があるので、このような場合には投与を中止し、水分摂取の制限等適切な処置を行うこと。
2. 高血糖、糖尿病性ケトアシドーシス、糖尿病性昏睡
他の抗精神病薬で、高血糖や糖尿病の悪化があらわれ、糖尿病性ケトアシドーシス、糖尿病性昏睡に至ることがあるとの報告があり、本剤においても血糖値の上昇が認められているため、口渇、多飲、多尿、頻尿等の症状の発現に注意するとともに、血糖値の測定を行うなど十分な観察を行い、異常が認められた場合には、投与を中止し、インスリン製剤の投与等の適切な処置を行うこと。〔「慎重投与」、「重要な基本的注意」の項参照〕
**その他の副作用
次のような副作用が認められた場合には、必要に応じ、減量、投与中止等の適切な処置を行うこと。
過敏症(注1)
5%未満
発疹、湿疹、そう痒
循環器(注2)
5%未満
血圧低下、起立性低血圧、血圧上昇、心電図異常(QT間隔の延長、T波の変化等)、頻脈、徐脈、不整脈、心室性期外収縮、上室性期外収縮、動悸、心拍数増加、心拍数減少
錐体外路症状(注3)
5%以上又は頻度不明(頻度不明は< >内)
パーキンソン症候群(振戦、筋強剛、流涎過多、寡動、運動緩慢、歩行障害、仮面様顔貌等)、アカシジア(静坐不能)、ジスキネジア(構音障害、嚥下障害、口周部・四肢等の不随意運動等)
錐体外路症状(注3)
5%未満
ジストニア(痙攣性斜頚、顔面・喉頭・頚部の攣縮、眼球上転発作、後弓反張等)
肝臓
5%未満
AST(GOT)、ALT(GPT)、γ-GTP、LDH、ALP、ビリルビンの上昇、肝機能異常
眼
5%未満
調節障害、霧視
消化器
5%以上又は頻度不明(頻度不明は< >内)
便秘、食欲不振、悪心
消化器
5%未満
嘔吐、食欲亢進、下痢、上腹部痛、腹痛、胃不快感、腹部膨満感、口唇炎
内分泌
5%以上又は頻度不明(頻度不明は< >内)
プロラクチン上昇
**内分泌
5%未満
月経異常、乳汁分泌、射精障害、女性化乳房
泌尿器
5%未満
排尿困難、尿閉、尿失禁、頻尿
精神神経系
5%以上又は頻度不明(頻度不明は< >内)
不眠、不安・焦燥感・易刺激性、眠気、めまい・ふらつき、頭重・頭痛、興奮、<しびれ感>、<自殺企図>
精神神経系
5%未満
過鎮静、脱抑制、抑うつ、幻覚・幻聴、妄想、被害妄想、睡眠障害、行動異常、多動、脳波異常、躁状態、意識障害、異常感、会話障害、多弁、緊張、痙攣
血液
5%未満
白血球増加、好中球増加、白血球減少、リンパ球減少、赤血球増加、貧血、赤血球減少、ヘモグロビン減少、ヘマトクリット減少、血小板増加、血小板減少、異型リンパ球出現
**その他
5%以上又は頻度不明(頻度不明は< >内)
倦怠感、口渇、脱力感、<浮腫>、<水中毒>
**その他
5%未満
発汗、発熱、体重増加、体重減少、胸痛、咳嗽、多飲、顔面浮腫、嚥下性肺炎、CK(CPK)上昇、トリグリセリド上昇、血中コレステロール上昇、血中インスリン上昇、血中リン脂質増加、血糖上昇、BUN 上昇、BUN減少、血中総蛋白減少、血中カリウム上昇、血中カリウム減少、血中ナトリウム減少、尿中蛋白陽性、尿中ウロビリン陽性、尿糖陽性
注1:異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
注2:観察を十分に行い、慎重に投与すること。
注3:症状があらわれた場合には必要に応じて減量又は抗パーキンソン薬の投与等、適切な処置を行うこと。
高齢者への投与
高齢者では錐体外路症状等の副作用があらわれやすく、また、一般に生理機能が低下しているので、患者の状態を観察しながら慎重に投与すること。
**妊婦、産婦、授乳婦等への投与
1.
**妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。〔妊娠中の投与に関する安全性は確立していない。妊娠後期に抗精神病薬が投与されている場合、新生児に哺乳障害、傾眠、呼吸障害、振戦、筋緊張低下、易刺激性等の離脱症状や錐体外路症状があらわれたとの報告がある。〕
2.
授乳中の婦人に投与する場合には、授乳を中止させること。〔動物実験(ラット)で乳汁中への移行が報告されている。〕
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない。〔使用経験がない。〕
適用上の注意
薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。〔PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。〕
その他の注意
1.
本剤による治療中、原因不明の突然死が報告されている。
2.
外国で実施された認知症に関連した精神病症状(承認外効能・効果)を有する高齢患者を対象とした17の臨床試験において、類薬の非定型抗精神病薬投与群はプラセボ投与群と比較して死亡率が1.6~1.7倍高かったとの報告がある。なお、本剤との関連性については検討されておらず、明確ではない。また、外国での疫学調査において、定型抗精神病薬も非定型抗精神病薬と同様に死亡率の上昇に関与するとの報告がある。
3.
動物実験(イヌ)で制吐作用が認められたため、他の薬剤に基づく中毒、腸閉塞、脳腫瘍等による嘔吐症状を不顕性化する可能性がある。
4.
げっ歯類(マウス、ラット)に104週間経口投与したがん原性試験において、マウス(1mg/kg/日以上)で乳腺腫瘍、下垂体腫瘍、ラット(1mg/kg/日)で乳腺腫瘍の発生頻度の上昇が
2.
吸収率(参考)
84%(ラット)
3.
血清蛋白結合率
99.7%以上(in vitro 、ヒト血清、10ng/mL~2μg/mL、平衡透析法)
4.
主な代謝産物及び代謝経路
主な代謝産物:
N-脱エチル体(in vivo薬理活性:未変化体の1/4.4~1/25)
7,8位の各水酸化体及びこれらのグルクロン酸抱合体
(参考)
脳内では、主として未変化体及びN-脱エチル体が認められた。(ラット、イヌ、サル)
代謝経路:
ブロナンセリンは、ピペラジン環のN-脱エチル化及びN-オキシド化、シクロオクタン環の酸化、これに続く抱合反応あるいはピペラジン環の開環など広範に代謝される。
5.
排泄経路及び排泄率
排泄経路:
尿中及び糞便中
排泄率:
健康成人(外国人)6例に14C-ブロナンセリン4mgを朝食2時間後単回投与したとき、尿中及び糞便中には、それぞれ投与放射能量の約59%及び約30%が排泄された。尿中に未変化体は認められず、主代謝物として数種類のグルクロン酸抱合体が存在した。また、糞便中には未変化体が少量(糞便中放射能量の5%未満)認められた。
6.
代謝酵素
チトクロームP-450分子種:
CYP3A4(未変化体のピペラジン環のN-脱エチル化及びシクロオクタン環の酸化)
7.
相互作用
エリスロマイシン併用時の薬物動態1)
表4参照
グレープフルーツジュース併用時の薬物動態2)
表5参照
(外国人での成績)
ケトコナゾール併用時の薬物動態
表6参照
表1 血漿中濃度 単回投与(空腹時投与)
(健康成人8例、空腹時1回投与)
投与量
(mg) |
Tmax
(h)a) |
Cmax
(ng/mL)b) |
t1/2
(h)b) |
AUClast
(ng・h/mL)b) |
| 4 |
1.5(1-3) |
0.14±0.04 |
10.7±9.4 |
0.91±0.34 |
| 8 |
1.5(0.5-2) |
0.45±0.22 |
12.0±4.4 |
2.82±1.38 |
| 12 |
1.5(1-3) |
0.76±0.44 |
16.2±4.9 |
6.34±6.34 |
a)中央値(最小値-最大値)、b)平均値±標準偏差
表2 血漿中濃度 単回投与(食後投与)
(健康成人12例、2mg1回投与)
| 投与時期 |
Tmax
(h) |
Cmax
(ng/mL) |
AUC0-12
(ng・h/mL) |
MRT
(h) |
kel
(l/h) |
| 空腹時 |
1.8±0.6 |
0.06±0.03 |
0.36±0.17 |
7.19±1.26 |
0.16±0.03 |
| 食後 |
3.8±1.7 |
0.14±0.07 |
0.83±0.38 |
9.63±4.04 |
0.15±0.05 |
平均値±標準偏差
表3 血漿中濃度 反復投与(食後投与)
〔健康成人10例、1回2mg 1日2回(朝・夕食後)10日間反復投与〕
Tmax
(h)a) |
Cmax
(ng/mL)b) |
t1/2
(h)b) |
AUC0-12
(ng・h/mL)b) |
| 2(2-2) |
0.57±0.19 |
67.9±27.6 |
3.22±1.10 |
a)中央値(最小値-最大値)、b)平均値±標準偏差
(注)本剤の承認された1回用量は4mgから、1日用量は通常8~16mg、最大24mgである。
表4 相互作用 エリスロマイシン併用時の薬物動態
(健康成人12例に本剤2mgを朝食後投与)
| |
Tmax
(h)a) |
Cmax
(ng/mL) b) |
t1/2
(h)b) |
AUClast
(ng・h/mL) b) |
| 単独投与時 |
2(1-3) |
0.26±0.11 |
14.9±8.5 |
1.94±1.03 |
| 併用投与時c) |
3(2-3) |
0.63±0.24 |
27.0±11.0 |
4.93±1.65 |
a)中央値(最小値-最大値)、b)平均値±標準偏差
c)本剤投与7日前より投与前日までエリスロマイシン1,200mg/日(分4)を反復経口投与し、本剤投与時はエリスロマイシン300mgを併用
(注)本剤の承認された1回用量は4mgから、1日用量は通常8~16mg、最大24mgである。
表5 相互作用 グレープフルーツジュース併用時の薬物動態
(健康成人12例に本剤2mgを朝食後投与)
| |
Tmax
(h)a) |
Cmax
(ng/mL) b) |
t1/2
(h)b) |
AUClast
(ng・h/mL)b) |
| 単独投与時 |
2(1-3) |
0.22±0.13 |
12.3±11.7 |
1.73±0.96 |
| 併用投与時c) |
2.5(1-6) |
0.39±0.25 |
15.7±8.7 |
3.17±1.71 |
a)中央値(最小値-最大値)、b)平均値±標準偏差
c)本剤投与60分前及び投与時にグレープフルーツジュース200mLを摂取
(注)本剤の承認された1回用量は4mgから、1日用量は通常8~16mg、最大24mgである。
表6 相互作用 ケトコナゾール併用時の薬物動態
〔健康成人(外国人)12例に本剤2.5mg を朝食後投与〕
| |
Tmax
(h)a) |
Cmax
(ng/mL) b) |
t1/2
(h)b) |
AUClast
(ng・h/mL) b) |
| 単独投与時 |
3(1-5) |
0.32±0.13 |
20.9±9.0 |
3.14±1.71 |
| 併用投与時c) |
4.3(2-5) |
4.22±2.05 |
18.2±5.5 |
50.14±24.47 |
a)中央値(最小値-最大値)、b)平均値±標準偏差
c)本剤投与7日前より投与当日までケトコナゾール400mg/日反復経口投与
(注)本剤の承認された1回用量は4mgから、1日用量は通常8~16mg、最大24mgである。
臨床成績
リスペリドン及びハロペリドールを対照薬として二重盲検比較試験を実施した。本剤(8~24mg)又は対照薬(リスペリドン2~6mg又はハロペリドール4~12mg)は1日2回朝食後及び夕食後に投与した。最終評価時での陽性・陰性症状評価尺度(Positive and Negative Syndrome Scale;PANSS)の合計スコア変化量、改善率及び平均1日投与量は次のとおりであった。なお、リスペリドンとの比較試験ではPANSS 合計スコア変化量(許容差-7)、ハロペリドールとの比較試験では改善率(△=10%)を有効性主要評価項目として本剤と対照薬との非劣性を検証した。
長期投与試験として3試験を実施した。各試験における改善率の推移及び最終評価時の改善率は次のとおりであった。
表7 リスペリドンとの比較試験3)
| |
本剤 |
リスペリドン |
PANSS合計スコア変化量a)
(評価例数) |
-11.1±17.3
(156) |
-11.5±17.4
(144) |
| 薬剤間の差の95%信頼区間 |
-4.40~3.48 |
-4.40~3.48 |
改善率
(中等度改善以上の例数/評価例数) |
51.0%
(79/155) |
56.6%
(81/143) |
| 薬剤間の差の95%信頼区間 |
-5.7~16.9 |
-5.7~16.9 |
| 平均1日投与量 |
16.3mg |
4.0mg |
a)平均値±標準偏差
表8 ハロペリドールとの比較試験4)
| |
本剤 |
ハロペリドール |
PANSS合計スコア変化量a)
(評価例数) |
-10.0±18.4
(114) |
-7.8±18.2
(111) |
| 薬剤間の差の95%信頼区間 |
-2.61~7.00 |
-2.61~7.00 |
改善率
(中等度改善以上の例数/評価例数) |
61.2%
(74/121) |
51.3%
(60/117) |
| 薬剤間の差の95%信頼区間 |
-2.7~22.4 |
-2.7~22.4 |
| 平均1日投与量 |
15.8mg |
8.1mg |
a)平均値±標準偏差
表9 長期投与試験
| |
|
長期投与試験(1) |
長期投与試験(2)5) |
長期投与試験(3)6) |
| 改善率(中等度改善以上の例数/評価例数) |
0週 |
3.9%a)(2/51) |
24.6%a)(15/61) |
24.6%a)(79/321) |
| 改善率(中等度改善以上の例数/評価例数) |
28週後 |
75.9%(22/29) |
75.0%(36/48) |
51.9%(137/264) |
| 改善率(中等度改善以上の例数/評価例数) |
52~56週後 |
70.6%(12/17) |
86.8%(33/38) |
55.5%(86/155) |
| 改善率(中等度改善以上の例数/評価例数) |
最終評価時 |
60.4%(29/48) |
68.3%(41/60) |
48.1%(153/318) |
a)前治療抗精神病薬の改善率
薬効薬理
1.
薬理作用
動物実験において、次の薬理作用が認められている。
2.
作用機序
In vitro受容体結合試験において、ブロナンセリンはドパミンD2受容体サブファミリー(D2、D3)及びセロトニン5-HT2A受容体に対して親和性を示した。主要代謝物である N-脱エチル体もドパミンD2受容体サブファミリー(D2、D3)及びセロトニン5-HT2A受容体に対して親和性を示したが、ドパミンD2受容体への親和性はブロナンセリンの約1/10であった。また、N-脱エチル体はセロトニン5-HT2C受容体及び5-HT6受容体に対しても親和性が認められた。しかし、ブロナンセリン及びN-脱エチル体とも、アドレナリンα1、ヒスタミンH1、ムスカリンM1等の受容体に対する親和性は低かった7)。
表10
作用の種類
(動物種、投与経路) |
EDあるいはED50(mg/kg)
ブロナンセリン |
EDあるいはED50(mg/kg)
ハロペリドール |
備考 |
条件回避反応抑制作用
単回投与(ラット、経口)7)
反復投与(ラット、経口)7) |
ED50:0.55
耐性なし |
ED50:0.62
耐性なし |
抗精神病効果と相関 |
| 側坐核内ドパミン投与による運動過多の抑制作用(ラット、経口)8) |
ED:0.3~3 |
ED:1、3 |
ドパミン仮説に基づく統合失調症の病態モデルへの作用 |
| メタンフェタミン誘発前頭前皮質自発発火障害の改善作用(ラット、静脈内)8) |
ED:1 |
― |
ドパミン仮説に基づく統合失調症の病態モデルへの作用 |
| メタンフェタミン誘発運動過多抑制作用(ラット、経口) |
ED50:0.446 |
ED50:0.287 |
陽性症状改善作用の指標 |
| フェンシクリジン誘発無動改善作用(マウス、経口)7) |
ED:0.3、1 |
― |
陰性症状改善作用の指標 |
| アポモルヒネ誘発プレパルス抑制障害改善作用(ラット、経口)7) |
ED:0.3~3 |
ED:1、3 |
認知障害改善作用の指標 |
| カタレプシー惹起作用(ラット、経口)7) |
ED50:16.4 |
ED50:5.63 |
急性期錐体外路系副作用の指標 |
| SKF38393 誘発異常口唇運動増強作用(ラット、経口)7) |
10mg/kg/dayで作用なし |
ED:3 |
慢性期錐体外路系副作用の指標 |
ED:作用用量、ED
50:50%作用用量
有効成分に関する理化学的知見
一般名
ブロナンセリン Blonanserin
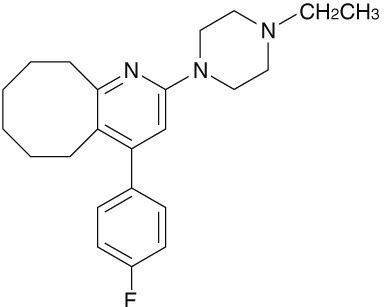
化学名
2-(4-Ethyl-1-piperazinyl)-4-(4-fluorophenyl)-5,6,7,8,9,10-hexahydrocycloocta[b]pyridine
構造式
認められた。これらの所見は、プロラクチンに関連した変化として、げっ歯類ではよく知られている。
分子式
C23H30FN3
分子量
367.50
性状
白色の結晶性の粉末。酢酸(100)に溶けやすく、メタノール又はエタノール(99.5)にやや溶けにくく、水にほとんど溶けない。
融点
123~126℃
*包装
ロナセン錠2mg:[PTP]100錠(10錠×10)
ロナセン錠4mg:[PTP]100錠(10錠×10)、1,000錠(10錠×100) [バラ]1,000錠
ロナセン錠8mg:[PTP]100錠(10錠×10)、1,000錠(10錠×100) [バラ]1,000錠
ロナセン散2%:100g
製造販売元
大日本住友製薬株式会社