|
日本药品和食品卫生理事会的一个评审委员会推荐批准大日本住友公司的Miripla(miriplatin)用于肝细胞癌(HCC)的治疗。同时获得肯定推荐的有ToaYakushin公司的万古霉素(vancomycin)眼科软膏配方,用于范围广泛的眼科感染。这2个产品最终要在今后几个月内经过厚生劳动省(MHLw)的批准,而miriplatin的批准将是世界范围内的第一次。 部分中文Miripla 处方资料(仅供参考) 名称 药品类别医生: 原产地英文商品名: -------------------------------------------------------------------------------- October 16, 2009 -- Dainippon Sumitomo Pharma Co., Ltd. (Head Office: “MIRIPLA®” is first suspended in an oily lymphographic agent and then administered through hepatic artery into hepatocellular carcinoma. As such an oily lymphographic agent, the Company has “MIRIPLA® suspension vehicle 4 mL” (generic name: iodine addition products of the ethylesters of the fatty acids obtained from poppyseed oil), which is approved for suspending MIRIPLA®. The manufacturing and marketing approval for this suspension vehicle was obtained on August 20, 2009 from the competent Ministry. “Lipiodolization” or “Chemo-lipiodlization” is one of the standard methods for treating hepatocellular carcinoma , where an anticancer drug is suspended in an oily lymphographic agent (iodine addition products of the ethylesters of the fatty acids obtained from poppyseed oil, Lipiodol) and then administered into hepatic artery. The Company has carried out a research program to discover an anticancer drug suitable for this treatment and succeeded in development of a lipophilic platinum complex, miriplatin which has high affinity to Lipiodol. MIRIPLA®has a high suspensibility in “MIRIPLA® suspension vehicle 4 mL “. Some of the characteristics of MIRIPLA®are: it accumulates and stays in a tumor after the administration into hepatic artery, platinum component is released gradually over a long duration and yet exposure to entire body is minor. In clinical tests on hepatocellular carcinoma, satisfactory anti-tumor effects were confirmed not only on patients of initial treatment but also on patients who relapsed after treatment such as hepatic resection. Some side effects were observed, but they were regarded as those generally observed under chemo-lipiodolization therapy, and they were thought to be tolerable at medical institutions familiarized with this treatment. There was no adverse event on vessel disorder in hepatic artery related to this drug. The Company has an intention to launch both “MIRIPLA® for intra-arterial injection 70 mg” and “MIRIPLA® suspension vehicle 4 mL” after they are listed on the national health insurance drug price standard. As a result of launching of MIRIPLA®, the Company expects to increase the line-up of products for the liver diseases, which includes Sumiferon®, a natural interferon-alpha product, and to further contribute to the total care of liver diseases.
-------------------------------------------------------------- ミリプラ動注用70mg商標名
MIRIPLA
貯法
2~8℃で保存
使用期限
外箱等に記載
規制区分劇薬
処方せん医薬品注)
注)注意-医師等の処方せんにより使用すること
組成有効成分
1バイアル中ミリプラチン70mg(ミリプラチン水和物71.65mg相当)
性状色・性状
白色~微黄色の塊又は粉末
一般的名称注射用ミリプラチン水和物
原則禁忌 (次の患者には投与しないことを原則とするが、特に必要とする場合には慎重に投与すること) 総ビリルビン値が3mg/dL以上の患者又は肝障害度Cの患者〔肝不全を起こすことがある。〕 効能又は効果肝細胞癌におけるリピオドリゼーション 用法及び用量ミリプラチン70mgを本剤懸濁用液3.5mLに懸濁し、1日1回肝動脈内に挿入されたカテーテルより投与する。本剤の投与は、腫瘍血管に懸濁液が充満した時点で終了すること。ただし、上限を1回6mL(ミリプラチンとして120mg)とする。また、繰り返し投与する場合には、4週間以上の観察期間をおくこと。
用法及び用量に関連する使用上の注意1.
多孔性ゼラチン粒等の塞栓材を併用した場合の有効性及び安全性は確立していない。
2.
他の抗悪性腫瘍剤と併用した場合の有効性及び安全性は確立していない。
3.
X線透視下に懸濁液が粒状になる速度で少量ずつ投与すること。〔「重要な基本的注意」の項参照〕
使用上の注意慎重投与(次の患者には慎重に投与すること) 1.
腎障害のある患者〔腎機能が低下しているので、副作用が強くあらわれるおそれがある。〕
2.
本剤、他の白金を含む薬剤又はヨード系薬剤に対する過敏症の既往歴のある患者〔「禁忌」の項参照〕
3.
甲状腺疾患のある患者〔「禁忌」の項参照〕
4.
高齢者〔「高齢者への投与」の項参照〕
5.
血管造影で明らかな肝内シャントがある患者〔本剤が肝内シャントを介して正常組織に流入し、血管塞栓による重篤な副作用を起こすおそれがある。〕
6.
血管造影で明らかな門脈腫瘍栓がある患者〔門脈血が遮断されているため、本剤の投与により投与部位の血流が低下し、肝不全を起こすおそれがある。〕
重要な基本的注意1.
発熱がほとんど全例にあらわれるため、患者の状態を十分に観察し、解熱剤の投与等適切な処置を行うこと。 2.
肝機能障害があらわれることがあるので、定期的に肝機能検査を行うなど、患者の状態を十分に観察し、異常が認められた場合には適切な処置を行うこと。 3.
本剤投与時にショック、血圧低下、徐脈等があらわれることがあるので、投与中及び投与直後は経過観察を十分に行い、異常が認められた場合には適切な処置を行うこと。 4.
標的とする部位以外への流入により、重篤な胃穿孔、消化管出血、胃・十二指腸潰瘍、脳梗塞、肺梗塞、肺塞栓、成人呼吸窮迫症候群、脊髄梗塞等が起こるおそれがあるので、投与に際しては以下の点に注意すること。〔「用法・用量に関連する使用上の注意」の項参照〕
(1)
本剤は肝動脈(固有肝動脈、右肝動脈、左肝動脈、中肝動脈等)内投与にのみ使用すること。また、固有肝動脈より可能な限り末梢から投与すること。ただし、腫瘍の栄養血管が下横隔動脈、左胃動脈等肝動脈以外である場合は、それらの栄養血管の血管走行を十分検査し、投与すること。投与に際しては、本剤の大動脈への逆流及び胃十二指腸動脈内への流入を回避するように十分注意して、カテーテルを挿入しX線透視下に少量ずつ投与すること。 (2)
門脈本幹との著明なAPシャントのある患者に投与する場合には、シャントより肝側までカテーテルを挿入し、X線透視下で少量ずつ投与すること。 副作用副作用等発現状況の概要臨床試験における安全性評価対象例113例の全例に副作用(臨床検査値の異常変動を含む)が認められ、主な副作用は発熱107例(94.7%)、CRP上昇103例(91.2%)、好酸球増多91例(80.5%)、NAG上昇86例(76.1%)等であった。(承認時)
重大な副作用本剤投与直後よりAST(GOT)、ALT(GPT)、ビリルビン、ALP、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがある。また、肝不全に至ることがあるので、観察を十分に行い、異常が認められた場合には、適切な処置を行うこと。
胆嚢炎、胆汁性嚢胞、肝膿瘍等の肝・胆道障害があらわれることがあるので、観察を十分に行い、異常が認められた場合には、適切な処置を行うこと。
感染症が併発した場合に重症化して敗血症(1%未満)があらわれることがあるので、患者の全身状態を十分に観察し、異常が認められた場合には、適切な処置を行うこと。本剤投与直後及び投与後1週間以降に発熱が認められることがあるので、経過観察を十分に行い、発熱の遷延が認められ、感染症の兆候がある場合は、感染症に対する処置も行うこと。
好中球減少(1%未満)等の骨髄抑制があらわれることがあるので、観察を十分に行い、異常が認められた場合には適切な処置を行うこと。
ショック、アナフィラキシー様症状があらわれることがあるので、観察を十分に行い、呼吸困難、血圧低下等の異常が認められた場合には、直ちに投与を中止し、適切な処置を行うこと。
間質性肺炎があらわれることがあるので、発熱、咳嗽、呼吸困難等の臨床症状を十分に観察し、異常が認められた場合には、胸部X線、胸部CT、血清マーカー等の検査を実施すること。間質性肺炎が疑われた場合には、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
急性腎不全等の重篤な腎障害があらわれることがあるので、観察を十分に行い、BUN、血清クレアチニン値等の異常が認められた場合には、適切な処置を行うこと。
その他の副作用10%未満
鼻咽頭炎、腎盂腎炎、唾液腺炎
10%以上
AST(GOT)上昇(58.4%)、ALT(GPT)上昇(53.1%)、LDH増加(49.6%)、血中ビリルビン増加(48.7%)、γ-GTP上昇(39.8%)、血中アルブミン減少(37.2%)、ALP上昇(26.5%)、ウロビリン尿(18.6%)
10%未満
腹水
頻度不明
LAP上昇、HPT値減少
10%以上
背部痛(10.6%)
10%未満
関節痛、肩部痛、顎関節症、頚部痛、四肢痛
10%以上
好酸球増多(80.5%)注1)、リンパ球減少(42.5%)、血小板減少(37.2%)、好中球減少(37.2%)、白血球減少(29.2%)、単球増多(28.3%)、プロトロンビン時間延長(26.5%)、好塩基球増多(18.6%)、赤血球減少(17.7%)、白血球増多(16.8%)、ヘモグロビン減少(11.5%)
10%未満
白血球分画異常、好中球増多、単球減少、リンパ球増多、好酸球減少、好塩基球減少、血小板増多
頻度不明
ヘマトクリット減少
10%未満
咳嗽、呼吸困難、咽頭不快感、湿性咳嗽
10%未満
血圧上昇、血圧低下、心電図異常、ほてり、徐脈、潮紅、動悸
10%以上
悪心・嘔吐(52.2%)、食欲不振(32.7%)、血中アミラーゼ増加(16.8%)、下痢(13.3%)
10%未満
腹痛、便秘、胃部不快感、腹部不快感、口内炎、腹部膨満感、口渇、胃炎、胃潰瘍、血中アミラーゼ減少、心窩部不快感
頻度不明
リパーゼ増加
10%未満
頭痛、不眠、めまい、感覚鈍麻、肝性脳症、頭部不快感
10%以上
発熱(94.7%)注2)、倦怠感(29.2%)、悪寒(27.4%)
10%未満
浮腫、脱力感
10%以上
疼痛(39.8%)
10%未満
静脈周囲炎
10%以上
NAG上昇(76.1%)、カリウム、カルシウム、ナトリウム、クロール等の電解質異常(37.2%)、尿中クレアチニン上昇(31.9%)、尿中クレアチニン減少(28.3%)、総蛋白減少(26.5%)、総蛋白増加(17.7%)、尿中蛋白陽性(15.0%)
10%未満
BUN上昇、血中クレアチニン上昇、尿潜血、排尿困難、乏尿
10%未満
発疹・湿疹、紅斑、そう痒
10%以上
CRP上昇(91.2%)、血糖上昇(23.9%)
10%未満
尿糖陽性、インスリン分泌能低下、HbA1C増加、血糖低下、高アンモニア血症、眼瞼出血、胸痛、耳鳴、糖尿病
注1)承認までの臨床試験において、好酸球増多が多くの患者で認められ、投与後3週間程度で最高値に達し、特に処置なく投与後5週間程度で回復した。2回目の投与時は、好酸球数が増加する患者の割合は減少し、増加の程度も低下した。
注2)承認までの臨床試験において、ほとんど全例に本剤の投与直後及び投与後1週間以降に発熱が認められた。(「重要な基本的注意」の項参照)
高齢者への投与高齢者では、一般に生理機能(骨髄機能、肝機能、腎機能等)が低下しているので、投与量及び投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。
妊婦、産婦、授乳婦等への投与1.
妊婦又は妊娠している可能性のある婦人には投与しないこと。〔動物実験(ラット)で胎児への移行が報告されている。また、本剤は遺伝毒性を有する。「その他の注意」の項参照〕
2.
妊娠する可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。〔本剤投与10~14ヵ月後でも、Cmaxの約17%の血漿中ミリプラチン由来白金濃度が検出された。「薬物動態」の項参照〕
3.
授乳婦に投与する場合には、授乳を中止させること。〔動物実験(ラット)で乳汁中への移行が報告されている。〕
小児等への投与低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立されていない。〔使用経験がない。〕
適用上の注意1. 調製時
(1)
本剤の使用にあたっては、本剤懸濁用液を使用すること。 (2)
懸濁液の調製にあたっては、ミリプラチン70mgに本剤懸濁用液を3.5mL加えた後、直ちに(1分間以内に)均一な懸濁液が得られるまで液を激しく振り混ぜ、液中に明らかな塊がないことを確認した上で使用すること。 (3)
調製後の懸濁液は粘稠なため、バイアルを反転させバイアル壁にそって懸濁液を流下させた後、ゆっくりと注射筒へ吸引すること。 (4)
懸濁液は用時調製し、調製後は速やかに(1時間以内に)使用すること。 (5)
*調製時に、注射針に塗布されているシリコーン油により不溶物を生じることがある。調製後に懸濁液中に不溶物がないか目視で確認すること。不溶物が認められた場合は使用しないこと。 2. 使用時
(1)
調製後の懸濁液は油性成分を含有しているため、ポリカーボネート製の三方活栓や延長チューブ等を使用すると、そのコネクター部分が破損し、血液及び薬液漏れ、空気混入等の可能性があるので使用を避けること。 (2)
ポリ塩化ビニル製のカテーテル、延長チューブ等を使用した場合、可塑剤であるDEHP〔di-(2-ethylhexyl)phthalate:フタル酸ジ-2-エチルヘキシル〕が懸濁液中に溶出するおそれがあるので、DEHPを含まないカテーテル、延長チューブ等を使用すること。 その他の注意本剤は、細菌に対する遺伝子突然変異誘発能が認められている。また、活性体であるジクロロ 1,2-ジアミノシクロヘキサン白金は、マウス小核試験で遺伝毒性を示すことが報告されている。
薬物動態1. 血漿中濃度
肝細胞癌患者の肝動脈内にミリプラチン懸濁液20mg/mL(最大投与液量6mL)を1回又は2回投与したとき、血漿中ミリプラチン由来白金濃度は、1回目投与後(15例)は18~37日に6.3~22ng/mLの、2回目投与後(11例)は7~34日に8.9~54 ng/mLのCmaxに達した後、緩やかに減少し、投与12~15週後、投与6~8ヵ月後、投与10~14ヵ月後に、それぞれCmaxの47.3±12.5%(13例、平均値±標準偏差)、31.0±6.4%(8例)、17.1±3.7%(5例)が検出された1)。 2. 肝臓中濃度肝細胞癌患者2例の肝動脈内にミリプラチン懸濁液20mg/mLを2回(1例は総投与量60mg1)、他の1例は200mg)投与したとき、肝臓中にミリプラチン由来白金が高濃度で検出され、非腫瘍部位よりも腫瘍部位がより高濃度であった。 表1参照 3. 相互作用
ヒト凍結肝細胞で、肝細胞癌患者における血漿中ミリプラチン由来白金濃度の最大値(54ng/mL)の14倍の曝露レベルにおいても、ミリプラチン懸濁液はCYP3A4 活性に影響を及ぼさなかった(in vitro)。
臨床成績臨床試験成績の概要は以下のとおりであった2)。なお、本剤の延命効果は検証されていない。 表2参照 臨床成績の表
薬効薬理1. 薬理作用
(1) 細胞増殖抑制作用
ヒト肝癌株HepG2、Li-7及びラット肝癌株AH109Aに対して、細胞増殖抑制作用を示した3, 4)。 (2) 抗腫瘍作用
ラット肝臓に移植したラット肝癌株AH109A及びヒト肝癌株Li-7に対して、肝動脈内単回投与により用量依存的な抗腫瘍作用を示した4-6)。 2. 作用機序
ミリプラチンは生体内でジクロロ 1,2-ジアミノシクロヘキサン白金等に変換され、癌細胞内のDNA鎖と共有結合した白金-DNA架橋を形成すると考えられた4, 6-8)。 有効成分に関する理化学的知見
一般名
ミリプラチン水和物 Miriplatin Hydrate 化学名 (SP-4-2)- [(1R,2R)-Cyclohexane-1,2-diamine-N, N’] bis(tetradecanoato-O)platinum monohydrate 構造式 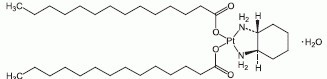 分子式 C34H68N2O4Pt・H2O 分子量 782.01 性状 白色~微黄色の塊又は粉末である。水にほとんど溶けず、エタノール(99.5)に溶けにくい。 *取扱い上の注意ゴム栓への針刺しはゴム栓面に垂直にゆっくりと行うこと。〔斜めに刺すと、ゴムの削片が懸濁液中に混入するおそれがある。〕 包装 ミリプラ動注用70mg:1バイアル 製造販売元
大日本住友製薬株式会社 |
Miripla(miriplatin)-主治肝细胞癌简介:
日本药品和食品卫生理事会的一个评审委员会推荐批准大日本住友公司的Miripla(miriplatin)用于肝细胞癌(HCC)的治疗。同时获得肯定推荐的有ToaYakushin公司的万古霉素(vancomycin)眼科软膏配方,用 ... 责任编辑:admin |
最新文章更多推荐文章更多热点文章更多 |