VANIHEP Capsules バニヘップカプセル150mg
--------------------------------------------------------------------------------
作成又は改訂年月
** 2014年11月改訂(第2版)
2014年9月作成
日本標準商品分類番号
87625
日本標準商品分類番号等
- 国際誕生年月
2014年9月
薬効分類名
抗ウイルス剤
承認等
- 販売名
バニヘップカプセル150mg
販売名コード
6250041M1024
承認・許可番号
- 承認番号
22600AMX01313000
- 商標名
VANIHEP Capsules 150mg
薬価基準収載年月
**2014年11月
販売開始年月
**2014年11月
貯法・使用期限等
- 貯法
室温保存
- 注意
「取扱い上の注意」の項参照
- 使用期間
24箇月
- 使用期限
外箱等に記載
規制区分
- 劇薬
- 処方箋医薬品
注意-医師等の処方箋により使用すること
組成
- 有効成分
バニプレビル
- 含量
1カプセル中に150mg
- 添加物
グリセリン脂肪酸エステル、ポリソルベート80、ポリオキシル35ヒマシ油、ブチルヒドロキシアニソール、ジブチルヒドロキシトルエン、中鎖脂肪酸トリグリセリド、レシチン、ゼラチン、ソルビトールソルビタン液、グリセリン、酸化チタン、三二酸化鉄、黄色三二酸化鉄
性状
- 剤形
軟カプセル
- 性状
黄赤色、不透明、長円形のカプセル
- 外形

長径:24.5mm
短径:8.5mm
- 識別コード
MSD 700(ブリスター包装)
一般的名称
バニプレビルカプセル
警告
本剤は、ウイルス性肝疾患の治療に十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される患者に対してのみ投与すること。
|
禁忌
(次の患者には投与しないこと)
1. 本剤の成分に対して過敏症の既往歴のある患者
- 2. 重度の肝機能障害(Child-Pugh C)のある患者[バニプレビルの血中濃度が上昇するおそれがある。](「薬物動態」の項参照)
- 3. 下記の薬剤を投与中の患者(「相互作用」の項参照)
リファンピシン、リファブチン、カルバマゼピン、フェニトイン、フェノバルビタール、セイヨウオトギリソウ(St. John's Wort:セント・ジョーンズ・ワート)含有食品、コビシスタット含有製剤、インジナビル、イトラコナゾール、リトナビル、ボリコナゾール、クラリスロマイシン、ネルフィナビル、サキナビル、シクロスポリン、アタザナビル、ロピナビル・リトナビル、エルトロンボパグ
|
効能又は効果
セログループ1(ジェノタイプI(1a)又はII(1b))のC型慢性肝炎における次のいずれかのウイルス血症の改善
- (1) 血中HCV RNA量が高値の未治療患者
- (2) インターフェロンを含む治療法で無効又は再燃となった患者
効能又は効果に関連する使用上の注意
- 1. 本剤の使用にあたっては、血中HCV RNAが陽性であること、及び組織像又は肝予備能、血小板数等により、肝硬変でないことを確認すること。 2. 血中HCV RNA量が高値の未治療患者に用いる場合は、血中HCV RNA量がRT-PCR法で5.0LogIU/mL以上に相当することを確認すること。 3. インターフェロンを含む治療法のうち、他のプロテアーゼ阻害剤による既治療例に対する投与経験はない。これらの患者に対しては、ウイルス性肝疾患の治療に十分な知識・経験を持つ医師が前治療の種類、前治療に対する反応性、耐性変異の有無、患者の忍容性等を考慮した上で、本剤投与の可否を判断すること。
用法及び用量
本剤は、ペグインターフェロン アルファ-2b(遺伝子組換え)及びリバビリンと併用すること。
- ●血中HCV RNA量が高値の未治療患者、あるいはインターフェロンを含む治療法で再燃となった患者に使用する場合
通常、成人にはバニプレビルとして1回300mgを1日2回、12週間経口投与する。
- ●インターフェロンを含む治療法で無効となった患者に使用する場合
通常、成人にはバニプレビルとして1回300mgを1日2回、24週間経口投与する。
用法及び用量に関連する使用上の注意
- 1. 本剤の単独投与は行わないこと。(本剤の単独投与による有効性及び安全性は確立していない。) 2. 本剤、ペグインターフェロン アルファ-2b(遺伝子組換え)及びリバビリンを併用する場合は、3剤併用投与で治療を開始する。本剤を血中HCV RNA量が高値の未治療患者、あるいはインターフェロンを含む治療法で再燃となった患者に使用する場合、最初の12週間は3剤併用投与し、続く12週間はペグインターフェロン アルファ-2b(遺伝子組換え)及びリバビリンによる2剤併用投与を実施すること。本剤をインターフェロンを含む治療法で無効となった患者に使用する場合、24週間3剤併用投与を実施すること。なお、本剤、ペグインターフェロン アルファ-2b(遺伝子組換え)及びリバビリンを、24週間を超えて併用投与した際の有効性及び安全性は確立していない。 3. 治療中の抗ウイルス効果が不十分な場合、潜在的に又は新たに誘発された薬剤耐性ウイルスが出現していることがあるので、治療中止を考慮すること。 4. ペグインターフェロン アルファ-2b(遺伝子組換え)及びリバビリンの投与量は、各製品の添付文書に定められた用法・用量に従うこと。併用にあたっては、投与開始前に各製品の添付文書に定められた臨床検査値基準を満たしていることを確認すること。また、投与中に各製品の用量調節や投与中止を必要とする副作用が発現した場合には、各製品の添付文書を参照すること。なお、白血球数、好中球数、血小板数については以下の5.を参照すること。 5.本剤とペグインターフェロン アルファ-2b(遺伝子組換え)及びリバビリンを併用するにあたっては、白血球数が4,000/mm3以上又は好中球数が1,500/mm3以上、血小板数が100,000/mm3以上であることが望ましい。また、投与中に白血球数、好中球数又は血小板数の低下が認められた場合には、下記を参考にペグインターフェロン アルファ-2b(遺伝子組換え)の用量を調節、あるいは本剤、ペグインターフェロン アルファ-2b(遺伝子組換え)及びリバビリンの投与を中止すること。
- 検査項目:数値
白血球数:1,500/mm3未満に減少
好中球数:750/mm3未満に減少
血小板数:80,000/mm3未満に減少
リバビリン:用量変更なし
ペグインターフェロン アルファ-2b(遺伝子組換え):減量※
本剤:用量変更なし
- 検査項目:数値
白血球数:1,000/mm3未満に減少
好中球数:500/mm3未満に減少
血小板数:50,000/mm3未満に減少
- リバビリン:投与中止
ペグインターフェロン アルファ-2b(遺伝子組換え):投与中止
本剤:投与中止 - ※;ペグインターフェロン アルファ-2b(遺伝子組換え)の減量時用量
- 体重(kg):35~45
- 第1段階(1.0μg/kg)
投与量(μg):40
使用バイアル:50μg/0.5mL用
液量(mL):0.4
- 第2段階(0.5μg/kg)
投与量(μg):20
使用バイアル:50μg/0.5mL用
液量(mL):0.2
- 体重(kg):46~60
- 第1段階(1.0μg/kg)
投与量(μg):50
使用バイアル:50μg/0.5mL用
液量(mL):0.5
- 第2段階(0.5μg/kg)
投与量(μg):25
使用バイアル:50μg/0.5mL用
液量(mL):0.25
- 体重(kg):61~75
- 第1段階(1.0μg/kg)
投与量(μg):70
使用バイアル:100μg/0.5mL用
液量(mL):0.35
- 第2段階(0.5μg/kg)
投与量(μg):35
使用バイアル:50μg/0.5mL用
液量(mL):0.35
- 体重(kg):76~90
- 第1段階(1.0μg/kg)
投与量(μg):80
使用バイアル:100μg/0.5mL用
液量(mL):0.4
- 第2段階(0.5μg/kg)
投与量(μg):40
使用バイアル:50μg/0.5mL用
液量(mL):0.4
- 体重(kg):91~120
- 第1段階(1.0μg/kg)
投与量(μg):100
使用バイアル:100μg/0.5mL用
液量(mL):0.5
第2段階(0.5μg/kg)
投与量(μg):50
使用バイアル:50μg/0.5mL用
液量(mL):0.5
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
- 1. 高齢者(「高齢者への投与」の項参照)
- 2. 中等度の肝機能障害患者〔バニプレビルの血中濃度が上昇することがある。〕(「薬物動態」の項参照)
重要な基本的注意
- 1. 本剤は、ペグインターフェロン アルファ-2b(遺伝子組換え)及びリバビリンと併用するため、ペグインターフェロン アルファ-2b(遺伝子組換え)及びリバビリンの添付文書に記載されている警告、禁忌、併用禁忌、慎重投与、重要な基本的注意、重大な副作用等の「使用上の注意」を、以下の2.及び3.の注意及び副作用を含めて必ず確認すること。
- 2. ヘモグロビン濃度、白血球数、好中球数及び血小板数の血液検査は、投与前及び投与開始8週間は少なくとも毎週、その後は4週間に1度定期的に実施すること。
- 3. 抑うつ、自殺企図をはじめ、躁状態、攻撃的行動、不眠、不安、焦燥、興奮、攻撃性、易刺激性等の精神神経症状発現の可能性について患者及びその家族に十分理解させ、これらの症状があらわれた場合には直ちに連絡するよう注意を与えること。躁状態、攻撃的行動が他害行為に至ることがある。患者の精神状態に十分注意し、不眠、不安、焦燥、興奮、攻撃性、易刺激性等があらわれた場合には本剤投与を中止するなど、治療継続の可否について慎重に検討すること。また、これらの症状が認められた場合には、投与終了後も観察を継続すること。
相互作用
バニプレビルは主にCYP3Aによって代謝される。また、バニプレビルはOATP1B1及びOATP1B3の基質である。(「薬物動態」の項参照)
併用禁忌
(併用しないこと) - 1. 薬剤名等
- リファンピシン(リファジン)
- 臨床症状・措置方法
併用初期に肝トランスポーターの阻害によりバニプレビルの血中濃度が上昇するおそれがある。
バニプレビルを高用量で投与したとき、悪心、嘔吐、下痢の発現増加の報告がある。
また、併用継続により代謝酵素が誘導され、併用初期よりもバニプレビルの血中濃度が低下するおそれがある。
- 機序・危険因子
リファンピシン併用中はOATP1B1及びOATP1B3阻害作用により、バニプレビルの肝取込みが抑制される。また、リファンピシンは反復投与によりCYP3A誘導作用を発現するためバニプレビルの代謝が亢進される。
- 2. 薬剤名等
- リファブチン(ミコブティン)、カルバマゼピン(テグレトール)、フェニトイン(アレビアチン)、フェノバルビタール(フェノバール)、セイヨウオトギリソウ(St. John’s Wort:セント・ジョーンズ・ワート)含有食品
- 臨床症状・措置方法
併用によりバニプレビルの血中濃度を低下させ、効果を減弱させるおそれがある。
- 機序・危険因子
これら薬物あるいは食品のCYP3A誘導作用によりバニプレビルの代謝が亢進される。
- 3. 薬剤名等
- コビシスタット含有製剤(スタリビルド)、インジナビル(クリキシバン)、イトラコナゾール(イトリゾール)、リトナビル(ノービア)、ボリコナゾール(ブイフェンド)、クラリスロマイシン(クラリス、クラリシッド)、ネルフィナビル(ビラセプト)、サキナビル(インビラーゼ)
- 臨床症状・措置方法
併用によりバニプレビルの血中濃度が上昇するおそれがある。バニプレビルを高用量で投与したとき、悪心、嘔吐、下痢の発現増加の報告がある。
- 機序・危険因子
これら薬物のCYP3Aに対する阻害作用により、バニプレビルの代謝が抑制される。
- 4. 薬剤名等
- シクロスポリン(サンディミュン、ネオーラル)、アタザナビル(レイアタッツ)、ロピナビル・リトナビル(カレトラ)、エルトロンボパグ(レボレード)
- 臨床症状・措置方法
併用によりバニプレビルの血中濃度が上昇するおそれがある。バニプレビルを高用量で投与したとき、悪心、嘔吐、下痢の発現増加の報告がある。
- 機序・危険因子
これら薬物のOATP1B1及び/又はOATP1B3阻害作用により、バニプレビルの肝取込みが抑制される。
|
併用注意
(併用に注意すること)
- 1. 薬剤名等
ボセンタン - 臨床症状・措置方法
ボセンタンの併用によりバニプレビルの血中濃度を低下させるおそれがある。ボセンタンと併用する際は、ウイルス学的な反応性を慎重に観察すること。また、本剤の併用はボセンタンの血中濃度を上昇させるおそれがある。
- 機序・危険因子
ボセンタンのCYP3A誘導作用によりバニプレビルの代謝が亢進される。また、バニプレビルはOATP1B1及びOATP1B3を阻害する可能性がある。
- 2. 薬剤名等
エファビレンツ、モダフィニル、エトラビリン - 臨床症状・措置方法
併用によりバニプレビルの血中濃度を低下させるおそれがある。これら薬物と併用する際は、ウイルス学的な反応性を慎重に観察すること。
- 機序・危険因子
これら薬物のCYP3A誘導作用によりバニプレビルの代謝が亢進される。
- 3. 薬剤名等
タクロリムス、ジヒドロエルゴタミン、エルゴタミン、フェンタニル、ピモジド、キニジン - 臨床症状・措置方法
本剤の併用はこれら薬物の血中濃度を上昇させるおそれがある。これら薬物と併用する際は、慎重に投与すること。また、これら薬物の添付文書を参照すること。
- 機序・危険因子
バニプレビルのCYP3A阻害作用により、これら薬物の代謝が抑制される。
- 4. 薬剤名等
ジゴキシン - 臨床症状・措置方法
本剤の併用はジゴキシンの血中濃度を上昇させるおそれがある。ジゴキシンと併用する際は、慎重に投与すること。また、ジゴキシンの添付文書を参照すること。
- 機序・危険因子
バニプレビルのP-糖蛋白阻害作用により、ジゴキシンの腸管での排出が抑制され、血中濃度が上昇する。
- 5. 薬剤名等
ロスバスタチン、アトルバスタチン、フルバスタチン、シンバスタチン、ピタバスタチン、プラバスタチン、バルサルタン、オルメサルタン、テルミサルタン、レパグリニド、エゼチミブ、メトトレキサート、ミトキサントロン、イリノテカン、イマチニブ、ラパチニブ、フェキソフェナジン、グリベンクラミド、ナテグリニド - 臨床症状・措置方法
本剤の併用はこれら薬物の血中濃度を上昇させるおそれがある。
- 機序・危険因子
バニプレビルはOATP1B1、OATP1B3及びBCRPを阻害する可能性がある。
- 6. 薬剤名等
グレープフルーツジュース - 臨床症状・措置方法
バニプレビルの血中濃度を上昇させるおそれがある。本剤服用中はグレープフルーツジュースの摂取を避けさせること。
- 機序・危険因子
グレープフルーツジュースに含まれる成分のCYP3Aに対する阻害作用により、バニプレビルの代謝が抑制される。
副作用
副作用等発現状況の概要
本剤とペグインターフェロン アルファ-2b(遺伝子組換え)及びリバビリンを併用した国内第III相臨床試験において、安全性評価対象となった288例中287例(99.7%)に副作用が認められた。主な副作用は、発熱211例(73.3%)、好中球減少146例(50.7%)、頭痛127例(44.1%)、白血球減少123例(42.7%)、悪心96例(33.3%)、ヘモグロビン減少95例(33.0%)、血小板減少92例(31.9%)、倦怠感91例(31.6%)、脱毛症91例(31.6%)、そう痒症90例(31.3%)、発疹90例(31.3%)であった。
本剤をペグインターフェロン アルファ-2b(遺伝子組換え)及びリバビリンと併用した際の副作用は以下のとおりである。なお、副作用の発現頻度は、本剤、ペグインターフェロン アルファ-2b(遺伝子組換え)及びリバビリンの3剤併用の3試験のデータを統合して算出した。
重大な副作用
- 1. 血液障害(血小板減少(31.9%)、好中球減少(50.7%)、白血球減少(42.7%))
血球数減少が報告されているため、定期的に臨床検査(血液検査等)を行うなど患者の状態を十分に観察すること。異常の程度が著しい場合には、投与を中止し、適切な処置を行うこと。
- 2. 貧血(21.9%)、ヘモグロビン減少(33.0%)
貧血、ヘモグロビン減少が報告されているため、定期的に血液検査を行うなど観察を十分に行い、異常の程度が著しい場合には、投与を中止し、適切な処置を行うこと。
- 3. うつ病(2.1%)
うつ病があらわれることがあるので、観察を十分に行い、不眠、不安、焦燥、自殺念慮等があらわれた場合には、投与を中止するなど適切な処置を行うこと。
その他の副作用
- 1. 全身症状
5%以上
発熱、倦怠感、疲労、インフルエンザ様疾患
- 2. 全身症状
1%以上5%未満
悪寒、口渇
- 3. 血液
5%以上
ヘマトクリット減少、赤血球数減少
- 4. 血液
1%以上5%未満
リンパ球数減少、網状赤血球数減少、網状赤血球数増加、溶血性貧血
- 5. 消化器
5%以上
悪心、腹部不快感、上腹部痛、口唇炎、便秘、下痢、消化不良、口内炎、嘔吐
- 6. 消化器
1%以上5%未満
腹部膨満、腹痛、口内乾燥、心窩部不快感、胃炎、胃食道逆流性疾患
- 7. 皮膚
5%以上
脱毛症、湿疹、そう痒症、発疹、皮膚乾燥
- 8. 皮膚
1%以上5%未満
薬疹、紅斑、全身性そう痒症、皮膚炎、乾癬、脂漏性皮膚炎、蕁麻疹、白癬感染
- 9. 精神・神経系
5%以上
頭痛、浮動性めまい、味覚異常、不眠症
- 10. 精神・神経系
1%以上5%未満
体位性めまい、感覚鈍麻、嗅覚錯誤、傾眠、不安、退屈感
- 11. 循環器
1%以上5%未満
高血圧、血圧低下、胸痛、胸部不快感、動悸、心房細動
- 12. 肝臓
5%以上
血中ビリルビン増加、γ-GTP増加
- 13. 肝臓
1%以上5%未満
AST(GOT)上昇、ALT(GPT)上昇、抱合ビリルビン増加、血中アルブミン減少、血中ALP増加、肝機能異常
- 14. 腎臓及び尿路
1%以上5%未満
膀胱炎、頻尿、腎結石症
- 15. 筋・骨格系
5%以上
関節痛、背部痛、筋肉痛
- 16. 筋・骨格系
1%以上5%未満
筋骨格硬直、関節炎、筋痙縮、筋骨格痛
- 17. 呼吸器
5%以上
咳嗽、口腔咽頭痛
- 18. 呼吸器
1%以上5%未満
気管支炎、呼吸困難、口腔咽頭不快感
- 19. 内分泌
1%以上5%未満
血中甲状腺刺激ホルモン増加、血中甲状腺刺激ホルモン減少、甲状腺機能低下症、自己免疫性甲状腺炎
- 20. 眼
1%以上5%未満
眼精疲労、眼乾燥、網膜症、視力低下、網膜滲出物
- 21. 耳
1%以上5%未満
耳鳴、回転性めまい
- 22. 代謝
1%以上5%未満
高尿酸血症
- 23. その他
5%以上
注射部位反応、注射部位紅斑、注射部位そう痒感、鼻咽頭炎、体重減少、食欲減退、血中カルシウム減少、血中リン減少
- 24. その他
1%以上5%未満
注射部位皮膚炎、注射部位腫脹、歯肉炎、咽頭炎、血中LDH増加、血中カリウム減少、血中尿酸増加、細胞マーカー増加、低カリウム血症、総蛋白減少
高齢者への投与
一般に高齢者では生理機能が低下しているので、患者の状態を観察しながら、慎重に投与すること。
妊婦、産婦、授乳婦等への投与
- 1. 本剤はペグインターフェロン アルファ-2b(遺伝子組換え)及びリバビリンと併用するため、妊婦又は妊娠している可能性のある婦人には使用しないこと。また、妊娠していないことを確認するため、リバビリンの添付文書を参照し、妊娠検査を実施すること。〔リバビリンの動物実験で催奇形性及び胚・胎児致死作用が認められている。動物実験(ラット及びウサギ)で、バニプレビルの催奇形性作用は認められていないが、胎盤を通過することが報告されている。〕
- 2. 授乳中の婦人には、投与を避けること。やむを得ず投与する場合は、授乳を避けさせること。〔動物実験(ラット)で、バニプレビルを投与した親動物から授乳された児(離乳前及び離乳後)に毒性は認められていないが、乳汁中に移行することが報告されている。〕
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない。〔使用経験がない。〕
薬物動態
- 1. 吸収及び血漿中濃度
- 〈日本人における成績〉
- 1) 単回経口投与
健康成人に本剤300mgを空腹時単回経口投与した際、血漿中バニプレビル濃度は投与後2時間(中央値)でCmaxに達し、その後6.15時間(幾何平均)のt1/2で消失した1)。また、バニプレビルを40~1000mgの用量範囲で空腹時単回経口投与した際、Cmax及びAUCは用量比例性を上回って増大した2)。(表1)
- 2) 食事の影響
健康成人にバニプレビル300mgを食後単回経口投与した際、空腹時投与に対するAUC0-∞及びCmaxの幾何平均比(90%信頼区間)はそれぞれ1.34(1.13,1.58)及び1.47(1.15,1.89)であった。Tmax及びt1/2にはほとんど変化はみられなかった。食事により臨床的に意味のある変化は認められなかった1)。
- 3) 反復経口投与(ペグインターフェロンα-2a、リバビリン併用)
C型慢性肝炎患者に、ペグインターフェロンα-2a週1回及びリバビリン1日2回とともにバニプレビル100、300及び600mgを1日2回12時間ごとに28日間反復経口投与した際、バニプレビルのCmax及びAUC0-12hrは用量比例性を上回って増大した。また、300mg投与時の投与第28日の定常状態下のCmax及びAUC0-12hrはそれぞれ投与初日に比べ3.3倍及び2.5倍に増大した3)。

図 C型慢性肝炎患者にペグインターフェロンα-2a週1回及びリバビリン1日2回とともにバニプレビル100~600mgを1日2回12時間ごとに反復経口投与した際の投与第28日の平均血漿中バニプレビル濃度推移(表2)
- 〈外国人における成績〉
- 1) 生物学的利用率
健康成人にバニプレビル100及び600mgを空腹時単回経口投与した際の絶対生物学的利用率はそれぞれ7.9%及び33.0%であった4)。
- 2. 分布
バニプレビルを経口投与した際、定常状態における見かけの分布容積は450Lを超えると推定された。バニプレビルのヒト血漿蛋白との結合率は97.0%~98.3%と高かった。また、バニプレビルは血球へほとんど移行しなかった5),6)。
- 3. 代謝
バニプレビルは主としてCYP3Aにより複数の酸化型代謝物に代謝されて消失した7),8)。
- 4. 排泄
日本人健康成人男性にバニプレビル1000mgを空腹時単回経口投与した際、投与後12時間までの尿中排泄率は投与量の0.2%であった2)。
外国人健康成人男性に[14C]標識バニプレビル575mgを投与した際、投与後96時間までの平均総放射能回収率は投与量の94%であり、投与量の93.3%が糞中、0.4%が尿中に排泄された。糞中に回収された放射能は主に酸化型代謝物に由来していた8)。
- 5. 肝機能障害患者
Child-Pugh分類に基づく軽度(Child-Pugh A)、中等度(Child-Pugh B)及び重度(Child-Pugh C)肝機能障害外国人患者にバニプレビルを空腹時単回経口投与した際のAUC0-∞及びCmaxの幾何平均は、健康被験者よりいずれも高く、それぞれ軽度肝機能障害患者では1.82倍及び1.57倍、中等度肝機能障害患者では3.11倍及び2.21倍、重度肝機能障害患者では8.42倍及び6.16倍に増大した。また、これら肝機能障害患者の血漿蛋白結合率は健康被験者と類似していた9)。
- 6. 薬物相互作用
バニプレビルはCYP3A、OATP1B1及びOATP1B3の基質であるが、P-糖蛋白のバニプレビルの体内動態への関与はわずかである。臨床薬物間相互作用試験において、バニプレビルは弱いCYP3A阻害作用を示し、消化管のP-糖蛋白、OATP1B1、OATP1B3及びBCRPに対しても阻害作用を有しているが、CYP2C9に対する阻害は認められなかった。In vitroで認められたCYP1A2、2B6、2C8、2C19、2D6及びUGT1A1に対するバニプレビルの阻害作用はCYP2C9に対する阻害作用よりも弱いか、あるいは同程度であり、BSEP、MRP2、MRP3及びMRP4に対する阻害作用はP-糖蛋白に対する阻害作用よりも強いか、あるいは同程度であった。また、in vitroでバニプレビルはCYP2B6及び1A2を誘導しなかった10)。
臨床薬物間相互作用試験で認められたバニプレビルの血漿中薬物動態が併用薬から受ける影響及びバニプレビルが併用薬の薬物動態に及ぼす影響について表3、表4に示す11)~18)。
- 7. 心電図に対する影響
日本人健康成人48例に本剤1650mgを単回経口投与したとき、QTcF間隔に臨床的に有意な影響を及ぼさなかった19)。
-
表1 健康成人に本剤300mgを空腹時単回経口投与した際の血漿中バニプレビル薬物動態パラメータ
投与量
(mg) |
AUC0-∞
(nM・hr) |
Cmax
(nM) |
C12hr
(nM) |
| 300 |
1890
(1470,2440) |
701
(511,960) |
13.5
(10.9,16.6) |
15例、幾何平均(95%信頼区間)
表2 C型慢性肝炎患者にペグインターフェロンα-2a週1回及びリバビリン1日2回とともにバニプレビル300mgを1日2回12時間ごとに反復経口投与した際のバニプレビルの血漿中薬物動態パラメータ
| 投与日 |
AUC0-12hr
(nM・hr) |
Cmax
(nM) |
C12hra)
(nM) |
Tmaxb)
(hr) |
t1/2c)
(hr) |
| 初日 |
5060
(2840,9010) |
1460
(796,2690) |
NA |
2.5
(2.0,7.9) |
2.5
(0.8) |
| 28日 |
12700
(7120,22600) |
4780
(2600,8790) |
85.5
(65.7,111) |
1.5
(1.0,3.0) |
2.3
(0.8) |
4例、幾何平均(95%信頼区間)、NA:該当なし
a):17例(投与第7日及び投与第28日の併合データ)、b):中央値(最小値,最大値)、c):調和平均(標準偏差)
表3 バニプレビルの薬物動態に及ぼす併用薬の影響(外国人データ)
| 併用薬 |
併用薬の
1回用量 |
本剤の
1回用量 |
例数
併用/
非併用 |
バニプレビルの血漿中薬物動態パラメータ比
併用時/非併用時(90%信頼区間)
AUC |
バニプレビルの血漿中薬物動態パラメータ比
併用時/非併用時(90%信頼区間)
Cmax |
ケトコナゾールa)
(経口)11) |
400mg
(QD、反復) |
300mg
(単回) |
8/8 |
9.02
(6.53,12.46) |
5.92
(4.30,8.15) |
| リトナビル12) |
100mg
(BID、反復) |
300mg
(単回) |
9/10 |
11.10
(7.88,15.64) |
4.34
(2.93,6.42) |
| ジルチアゼム13) |
240mg
(QD、反復) |
300mg
(単回) |
10/10 |
1.95
(1.63,2.32) |
2.02
(1.52,2.68) |
| リファンピシン14) |
600mg
(単回) |
300mg
(単回) |
8/8 |
7.82
(6.22,9.85) |
7.15
(5.90,8.66) |
| リファンピシン14) |
600mg
(QD、反復) |
300mg
(BID、反復) |
8/8 |
1.22
(0.83,1.80) |
1.26
(0.86,1.85) |
QD:1日1回投与、BID:1日2回投与
a):経口剤は国内未発売
表4 併用薬の薬物動態に及ぼすバニプレビルの影響(外国人データ)
| 併用薬 |
併用薬の
1回用量 |
本剤の
1回用量 |
例数
併用/
非併用 |
併用薬の血漿中薬物動態パラメータ比
併用時/非併用時(90%信頼区間)
AUC |
併用薬の血漿中薬物動態パラメータ比
併用時/非併用時(90%信頼区間)
Cmax |
| ミダゾラム15) |
2mg
(単回) |
600mg
(BID、反復) |
12/12 |
1.81
(1.56,2.10) |
1.26
(1.14,1.39) |
| ジゴキシン16) |
0.5mg
(単回) |
600mg
(BID、反復) |
14/14 |
1.63
(1.43,1.85) |
1.38
(1.20,1.57) |
| ロスバスタチンa),17) |
5mg
(単回) |
300mg
(BID、反復) |
12/12 |
1.22
(1.09,1.36) |
2.88
(2.40,3.46) |
| ワルファリン18) |
30mg
(単回) |
600mg
(BID、反復) |
12/11 |
R(+)体
1.09
(1.04,1.14) |
R(+)体
0.94
(0.88,1.00) |
| ワルファリン18) |
30mg
(単回) |
600mg
(BID、反復) |
12/11 |
S(-)体
1.00
(0.97,1.04) |
S(-)体
0.88
(0.83,0.94) |
BID:1日2回投与
a):日本人データ
臨床成績
日本人C型慢性肝炎患者を対象とした国内第III相試験成績概要は以下のとおりであった。
- (1) 過去にインターフェロン等の治療を受けたことのない患者20)
ジェノタイプ1かつ高ウイルス量(コバスTaqMan HCV「オート」:5.0LogIU/mL以上)のC型慢性肝炎未治療患者を対象として、本剤a)の有効性及び安全性を検討することを目的としたプラセボb)対照無作為化並行群間比較試験を実施した。その結果、投与終了後24週目のHCV RNA陰性化率は、対照群で55.1%(54/98例)、本剤群で83.7%(82/98例)であり、本剤群と対照群との対比較において、統計学的に有意な差が認められた(p<0.001、IL28B遺伝子の一塩基多型及び年齢を層としCochran-Mantel-Haenszel法で調整した)。
- (2) 過去のインターフェロン等の治療後に再燃した患者21)
ジェノタイプ1かつ高ウイルス量(コバスTaqMan HCV「オート」:5.0LogIU/mL以上)のC型慢性肝炎既治療再燃患者を対象として、本剤a)の有効性と安全性を検討することを目的とした非盲検試験を実施した。その結果、投与終了後24週目のHCV RNA陰性化率は、92.0%(23/25例)であった。
- (3) 過去のインターフェロン等の治療が無効であった患者22)
ジェノタイプ1かつ高ウイルス量(コバスTaqMan HCV「オート」:5.0LogIU/mL以上)のC型慢性肝炎既治療無効患者を対象として、本剤c)の有効性と安全性を検討することを目的とした非盲検試験を実施した。その結果、投与終了後24週目のHCV RNA陰性化率は、61.9%(26/42例)であった。
-
表 国内第III相臨床試験成績
| 前治療 |
投与群 |
投与終了後24週目のHCV RNA陰性化率 |
| 初回 |
対照b)群 |
55.1%(54/98例) |
| 初回 |
本剤a)群(12週投与群) |
83.7%(82/98例) |
| 再燃 |
本剤a)群(12週投与群) |
92.0%(23/25例) |
| 無効 |
本剤c)群(24週投与群) |
61.9%(26/42例) |
a)バニプレビル(12週間投与)とペグインターフェロンα-2b及びリバビリン(24週間投与)の3剤併用投与
b)ペグインターフェロンα-2b及びリバビリン(48週間投与)の2剤併用投与
c)バニプレビル、ペグインターフェロンα-2b及びリバビリン(24週間投与)の3剤併用投与
薬効薬理
- 1. 作用機序23)~25)
バニプレビルはHCV複製に必須であるHCV NS3/4Aセリンプロテアーゼに可逆的に結合する大環状ペプチド構造の阻害剤である。バニプレビルはヒトセリンプロテアーゼや他のプロテアーゼと比較してHCV NS3/4Aセリンプロテアーゼに高い選択性を持つ。
- 2. 抗ウイルス作用(in vitro)23)
バニプレビルの各酵素に対する阻害作用は、HCVジェノタイプ1a、1b、4a、5a及び6aでは強く(IC50<0.20nM)、ジェノタイプ2a及び2bではやや弱く、ジェノタイプ3aでは弱かった。バニプレビルはHCVジェノタイプ1a及び1bレプリコン細胞で顕著な阻害活性を示し、EC90値はそれぞれ4.0及び3.9nMであった。また、40%正常ヒト血清存在下での活性変化は、7倍未満であった。バニプレビルは細胞毒性を示さなかった(Hela細胞及びHuh-7細胞でのCC50値:それぞれ>25μM及び>50μM)。レプリコン細胞でのバニプレビルとインターフェロンα-2b又はリバビリンとの併用効果は概して相加的若しくは相加/相乗的であった。
- 3. 抗ウイルス作用(in vivo)26)
HCV感染チンパンジー(HCVジェノタイプ1a)にバニプレビルを7日間(5mg/kg、1日2回)経口投与したところ、投与第2~5日に血漿中HCV RNA量が速やかに1/105未満に減少し、この低下は投与期間中維持された。
- 4. 薬剤耐性20)~23)
HCVジェノタイプ1a及び1bレプリコン細胞パネルを用いてバニプレビルの抗ウイルス活性の変化をみたところ、R155、A156及びD168のアミノ酸変異によりバニプレビルに対する感受性の変化がみられた。EC90値が100倍以上となったのは、HCVジェノタイプ1aではR155K/T及びD168A、また、HCVジェノタイプ1bではR155G/K/Q/W、A156T/V及びD168A/G/K/T/V/Yの各変異であった。他方、V36、T54、Y56及びQ80を含む他のアミノ酸配列における変異に対するバニプレビルのEC90値の変化は、HCVジェノタイプ1bのF43S(14.8倍)を除き概ね5倍未満であった。
国内第III相臨床試験でのバニプレビルによる治療非奏効にはD168の変異a)の関与が大きいことが示唆された。また、治療開始前に既に存在していた変異として多く見られたものはY56、Q80及びV170の変異a)であったが、これらはバニプレビルを含む3剤併用療法の成果に顕著な影響を及ぼさなかった。
a)ABI 3730XL DNA Analyzer(ダイレクトシークエンス法)を使用
有効成分に関する理化学的知見
- 一般名
バニプレビル
- 化学名
(5R, 7S, 10S)-10-(1, 1-Dimethylethyl)-N-{(1R, 2R)-1-[N-(cyclopropanesulfonyl)carbamoyl]-2-ethylcyclopropyl}-15, 15-dimethyl-3, 9, 12-trioxo-2, 3, 5, 6, 7, 8, 9, 10, 11, 12, 14, 15, 16, 17, 18, 19-hexadecahydro-2, 23:5, 8-dimethano-1H-benzo[n][1, 10, 3, 6, 12]dioxatriazacyclohenicosine-7-carboxamide
- 分子式
C38H55N5O9S
- 分子量
757.94
- 構造式
-
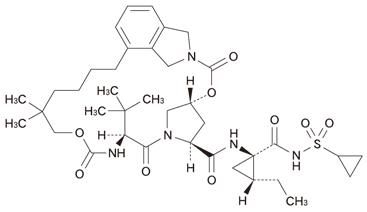
- 性状
- 白色の粉末。メタノールに溶けやすく、エタノール(99.5)にやや溶けやすく、水に極めて溶けにくい。
取扱い上の注意
冷蔵保存しないこと(カプセルが脆くなる可能性があるため)。
包装
バニヘップカプセル150mg:28カプセル(ブリスター 4カプセル×7)
主要文献及び文献請求先
主要文献
- 1) バニプレビルの薬物動態の検討(社内資料 049)
- 2) バニプレビルの薬物動態の検討(社内資料 008)
- 3) バニプレビルの薬物動態の検討(社内資料 016)
- 4) バニプレビルの薬物動態の検討(社内資料 015)
- 5) バニプレビルの薬物動態の検討(社内資料 048)
- 6) バニプレビルの蛋白結合に関する検討(社内資料)
- 7) バニプレビルの代謝に関する検討(社内資料)
- 8) バニプレビルの薬物動態の検討(社内資料 012)
- 9) バニプレビルの薬物動態の検討(社内資料 005)
- 10) バニプレビルのin vitro酵素阻害及び誘導に関する検討(社内資料)
- 11) バニプレビルの薬物動態に及ぼすケトコナゾールの影響の検討(社内資料 020)
- 12) バニプレビルの薬物動態に及ぼすリトナビルの影響の検討(社内資料 006)
- 13) バニプレビルの薬物動態に及ぼすジルチアゼムの影響の検討(社内資料 030)
- 14) バニプレビルの薬物動態に及ぼすリファンピシンの影響の検討(社内資料 026)
- 15) ミダゾラムの薬物動態に及ぼすバニプレビルの影響の検討(社内資料 010)
- 16) ジゴキシンの薬物動態に及ぼすバニプレビルの影響の検討(社内資料 024)
- 17) ロスバスタチンの薬物動態に及ぼすバニプレビルの影響の検討(社内資料 046)
- 18) ワルファリンの薬物動態に及ぼすバニプレビルの影響の検討(社内資料 025)
- 19) バニプレビルのQT間隔に対する作用の検討(社内資料 011)
- 20) 国内第III相臨床試験成績(社内資料 043)
- 21) 国内第III相臨床試験成績(社内資料 044)
- 22) 国内第III相臨床試験成績(社内資料 045)
- 23) バニプレビルのin vitroでの作用(社内資料)
- 24) バニプレビルの選択性の検討(社内資料)
- 25) Liverton, N. J. et al.:Antimicrob Agents Chemother. 2010;54:305
- 26) バニプレビルのin vivoでの作用(社内資料)
文献請求先
文献請求先・製品情報お問い合わせ先
主要文献に記載の社内資料につきましても下記にご請求下さい。
MSD株式会社 MSDカスタマーサポートセンター
東京都千代田区九段北1-13-12
医療関係者の方:フリーダイヤル0120-024-961
長期投与医薬品に関する情報
**本剤は新医薬品であるため、厚生労働省告示第107号(平成18年3月6日付、一部改正)に基づき、平成27年11月末日までは、投薬は1回14日分を限度とされている。
製造販売業者等の氏名又は名称及び住所
- 製造販売元
MSD株式会社
東京都千代田区九段北1-13-12 |






