|
【英文药名】sitafloxacin hydrate
【适应症】用于治疗严重难治的细菌感染。
【包装规格:】50毫克 100片/盒
【生产企业】日本第一制药三共株式会社
西他沙星片药品介绍;
日本厚生省批准第一制药三共株式会社(Daiichi Sankyo)的广谱抗生素西他沙星水合物50 mg片和10%细粒剂(sitafloxacin hydrate,商Gracevit)上市,用于治疗严重难治的细菌感染。
本品系一新颖的N-1-氟环丙基喹诺酮,对耐甲氧西林金黄色葡萄球菌、耐甲氧西林表皮葡萄球菌、厌氧菌(包括脆弱类杆菌)以及支原体、衣原体等均具较强的抗菌活性。化学结构上有一顺式(1R,5R)-2-氟环丙胺基团,显示良好的药代动力学特性,且可减少不良反应。该药不仅显著增强抗革兰阳性菌活性,而且对临床分离的许多耐氟喹诺酮类的菌株也具抗菌活性。
本品体外抗菌活性的研究表明,其具广谱抗菌作用,不仅对革兰阴性菌有抗菌活性,而且对革兰阳性菌以及对许多临床常见耐氟喹诺酮类菌株也有良好杀菌作用。本品口服吸收好、生物利用度大于70%,组织分布广,在中枢神经系统外的多种组织中的药物浓度均高于血清药物浓度,因此,本品可望成为治疗呼吸道、泌尿生殖道、腹腔以及皮肤软组织等单一或混合细菌感染的重要药物。
グレースビット錠50mg/グレースビット細粒10%
一般名
シタフロキサシン水和物 (Sitafloxacin Hydrate)
略名
STFX
化学名
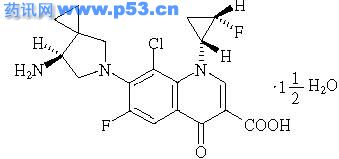
(-)-7-[(7S )-7-Amino-5-azaspiro[2.4]heptan-5-yl]-8-chloro-6-fluoro-1-[(1R ,2S )-2-fluoro-1-cyclopropyl]-1,4-dihydro-4-oxo-3-quinolinecarboxylic acid sesquihydrate
分子式
C19H18ClF2N3O3・11/2H2O
分子量
436.84
構造式
性状
微黄白色~黄白色の結晶又は結晶性の粉末である。
リン酸試液にやや溶けにくく、0.1mol/L塩酸試液、アセトニトリル又はメタノールに溶けにくく、エタノール (99.5) に極めて溶けにくく、水にほとんど溶けない。光によって淡黄褐白色となる。
(リン酸試液: リン酸50gを水950mLに溶かす)
融点
217~223℃
分配係数
1-オクタノール/水 (25℃); 0.244
効能又は効果
効能又は効果/用法及び用量
〈適応菌種〉
本剤に感性のブドウ球菌属、レンサ球菌属、肺炎球菌、腸球菌属、モラクセラ (ブランハメラ)・カタラーリス、大腸菌、シトロバクター属、クレブシエラ属、エンテロバクター属、セラチア属、プロテウス属、モルガネラ・モルガニー、インフルエンザ菌、緑膿菌、レジオネラ・ニューモフィラ、ペプトストレプトコッカス属、プレボテラ属、ポルフィロモナス属、フソバクテリウム属、トラコーマクラミジア (クラミジア・トラコマティス)、肺炎クラミジア (クラミジア・ニューモニエ)、肺炎マイコプラズマ (マイコプラズマ・ニューモニエ)
〈適応症〉
○咽頭・喉頭炎、扁桃炎 (扁桃周囲炎、扁桃周囲膿瘍を含む)、急性気管支炎、肺炎、慢性呼吸器病変の二次感染
○膀胱炎、腎盂腎炎、尿道炎
○子宮頸管炎
○中耳炎、副鼻腔炎
○歯周組織炎、歯冠周囲炎、顎炎
効能又は効果に関連する使用上の注意
本剤は下痢、軟便が高頻度に認められているため、本剤の使用に際しては、リスクとベネフィットを考慮すること (「副作用」の項参照)。
用法及び用量
通常、成人に対してシタフロキサシンとして1回50mg (錠: 1錠又は細粒: 0.5g) を1日2回経口投与する。なお、効果不十分と思われる症例には、シタフロキサシンとして1回100mg (錠: 2錠又は細粒: 1.0g) を1日2回経口投与することができる。
用法及び用量に関連する使用上の注意
1.
本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
2.
腎機能が低下している患者では、本剤の血中濃度が上昇するため、投与量、投与間隔を調節すること (「薬物動態」の項参照)。
使用上の注意
慎重投与(次の患者には慎重に投与すること)
1.
腎機能障害のある患者[高い血中濃度の持続が認められている (「薬物動態」の項参照)。]
2.
てんかん等の痙攣性疾患又はこれらの既往歴のある患者[類薬で痙攣を起こすとの報告がある。]
3.
*重症筋無力症の患者1)[類薬で症状を悪化させるとの報告がある。]
4.
高齢者 (「高齢者への投与」の項参照)
相互作用
併用注意
(併用に注意すること)
1.
薬剤名等
アルミニウム又はマグネシウム含有の制酸薬等、カルシウム剤、鉄剤
臨床症状・措置方法
本剤の効果が減弱されるおそれがある。これらの薬剤は本剤投与後2時間以上あけて投与する。
機序・危険因子
これらの薬剤とキレートを形成し、本剤の吸収が低下すると考えられている。
2.
薬剤名等
フェニル酢酸系又はプロピオン酸系非ステロイド性消炎鎮痛薬
ケトプロフェン等
臨床症状・措置方法
他のキノロン系抗菌薬で、痙攣を起こしたとの報告がある。
機序・危険因子
中枢神経におけるGABAA受容体への結合阻害が増強されると考えられている。
副作用
副作用等発現状況の概要
承認前の調査1,071例中報告された副作用 (臨床検査値異常変動を含む) は33.5% (359例) で、主な副作用は、下痢62例 (5.8%)、軟便79例 (7.4%)、頭痛22例 (2.1%)、ALT (GPT) 上昇59例 (5.5%)、AST (GOT) 上昇45例 (4.2%)、好酸球数増加42例 (3.9%) 等であった。なお、下痢、軟便の発現頻度は比較試験の対照薬よりも高かった。
重大な副作用
1. 肝機能障害
頻度不明
肝機能障害 (AST (GOT) 上昇、ALT (GPT) 上昇等) があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
重大な副作用(類薬)
他のニューキノロン系抗菌薬で以下の重大な副作用が報告されているので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
(1)
ショック、アナフィラキシー様症状
(2)
*中毒性表皮壊死融解症 (Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群 (Stevens-Johnson症候群)
(3)
痙攣
(4)
急性腎不全
(5)
黄疸
(6)
間質性肺炎
(7)
偽膜性大腸炎
(8)
横紋筋融解症
(9)
低血糖
(10)
腱障害
(11)
無顆粒球症
(12)
汎血球減少症
(13)
血小板減少
(14)
溶血性貧血
(15)
錯乱、せん妄、幻覚などの精神症状
(16)
*重症筋無力症の悪化1)
その他の副作用
1. 過敏症
1~10%未満
発疹
2. 過敏症
1%未満
そう痒症、蕁麻疹
3. 精神神経系
1~10%未満
頭痛
4. 精神神経系
1%未満
不眠症、めまい
5. 消化器
1~10%未満
腹痛、下痢、軟便、悪心、胃不快感
6. 消化器
1%未満
腹部膨満、口唇炎、便秘、消化不良、排便回数増加、口内炎、嘔吐、口の錯感覚、口渇
7. 肝臓
1~10%未満
ALT (GPT) 上昇、AST (GOT) 上昇、γ-GTP上昇
8. 肝臓
1%未満
LDH上昇、トリグリセリド増加、ALP上昇
9. 血液
1~10%未満
好酸球数増加
10. 血液
1%未満
血中カリウム増加、血中カリウム減少、好中球数減少、血小板数増加、白血球数減少
11. その他
1%未満
腟カンジダ症、悪寒、異常感、倦怠感、CK (CPK) 上昇、血糖減少、尿蛋白陽性
上記の副作用があらわれることがあるので、異常が認められた場合には必要に応じ投与を中止するなど適切な処置を行うこと。
高齢者への投与
一般に高齢者では生理機能が低下しているので、患者の状態を十分に観察しながら慎重に投与すること (「薬物動態」の項参照)。
妊婦、産婦、授乳婦等への投与
1.
妊婦又は妊娠している可能性のある婦人には投与しないこと。[妊娠中の投与に関する安全性は確立していない。]
2.
授乳中の婦人には本剤投与中は授乳を避けさせること。[動物実験 (ラット) で乳汁中へ移行することが報告されている。]
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していないので、投与しないこと (「その他の注意」の項参照)。
過量投与
(海外データ)
本剤500mg 1日1回又は2回の経口投与後、紫外光照射により光毒性を示した。
また、本剤400~800mg 1日2回の静脈内投与で、QT間隔延長に用量相関性を認め、変動幅の平均は10msec以下であった。
適用上の注意
薬剤交付時:
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
その他の注意
1.
動物実験 (幼若犬) で関節部の軟骨障害が認められている。
2.
培養細胞 (チャイニーズ・ハムスター由来) で、光染色体異常誘発性が認められている。
包装
グレースビット錠50mg
(バラ) 100錠
(PTP) 100錠 500錠
グレースビット細粒10% (バラ) 30g 
生产商:第一三共株式会社
|